Введение
Большинство крупномасштабных радиационных аварий, таких как санкционированный сброс в бассейн реки Теча (в 1949–1952 гг.) жидких радиоактивных отходов производства атомного комбината «Маяк», термохимический взрыв с разрушением емкости, содержавшей жидкие радиоактивные отходы того же комбината, в 1957 г., авария на четвертом энергоблоке Чернобыльской атомной электростанции (ЧАЭС) 26 апреля 1986 г., произошло на территории бывшего СССР. Накопленный в этой принципиально новой проблеме уникальный опыт исследований способствовал развитию отечественной радиобиологии, радиационной медицины и радиоэкологии [1–3]. В результате аварии на ЧАЭС большая часть ликвидаторов подверглись воздействию малых доз ионизирующих излучений (ИИ). В послеаварийном периоде среди этой категории лиц отмечается рост заболеваемости и инвалидности [4–8]. К настоящему времени накапливается все больше информации о возможности развития у них не только онкологических, но и соматических заболеваний, индуцированных малыми дозами ИИ [9].
Изучению здоровья ликвидаторов последствий аварии (ЛПА) на ЧАЭС посвящено впечатляющее количество клинических исследований. При его оценке важно, чтобы современный синтетический клинический диагноз кроме этиологического, функционального и симптоматического содержал морфологический компонент – клеточную основу патологии, который является важнейшим и часто определяющим. При этом проведенные в течение последних десятилетий экспериментальные исследования, применение современных диагностических методов в клинике показали радиационно-индуцированное преждевременное развитие сенесенса эндотелиальных клеток при остром и хроническом облучении низкими дозами ИИ, возможность вклада ремоделирования сосудов в патоморфоз регистрируемых заболеваний. Эндотелий является важным функциональным компонентом интимы сосудов и основным структурно-функциональным элементом сосудов микроциркуляторного русла (МЦР), поэтому сосуды МЦР могут выступать в качестве эндотелиальной васкулярной модели при воздействии радиации и возможного механизма, приводящего к поражению внутренних органов [10–13].
Анализ результатов клинических исследований, проведенных по данной проблеме, свидетельствует о необходимости изучения и обобщения всех компонентов синтетического диагноза. Влияние нерадиационных факторов (заболеваний, психоэмоционального стресса, курения, злоупотребления алкоголем и др.) на изучаемые параметры может быть преодолено единственно возможным используемым в клинической медицине способом – созданием репрезентативных групп сравнения: пациенты с перечисленными факторами, не подвергавшиеся облучению, и контроля (здоровые лица, не подвергшиеся облучению); включением в исследование практически здоровых работников атомного производства, где эти факторы сведены к минимуму.
Материал и методы
В период с 1996 по 2002 г. в ГБОУ ВПО СибГМУ были обследованы 117 ЛПА на ЧАЭС и 24 работника исследовательского ядерного реактора типового (ИЯРТ). Группу ЛПА на ЧАЭС составили мужчины в возрасте от 28 лет до 61 года (в среднем 43,1±0,7 года), которые с июня 1986 г., в 1987 и 1988 гг. выполняли в течение 0,5–4,5 месяцев (в среднем 3,1±0,9 месяца) разную по характеру (дезактивация, уборка территории, строительство, администрирование) и месту проведения (в помещении, на технике, на открытой местности) работу в 30-километровой зоне ЧАЭС. В 1986 г. в ликвидации последствий аварии участвовали 59 представителей данной группы, в 1987 г. – 40 и в 1988 г. – 18. По персональным документам поглощенные дозы внешнего γ-излучения составили от 50 до 270 мГр (в среднем 163,06±9,54 мГр), т.е. превышали основной дозовый предел, но были меньше, чем величина предельно допустимой дозы аварийного облучения, установленная Нормами радиационной безопасности, действовавшими в СССР в 1986 г.
Всем ЛПА на ЧАЭС было проведено общеклиническое обследование, исследование иммунного статуса, по показаниям специальные методы диагностики (лучевые, функции внешнего дыхания, эндоскопические, нейрофизиологические, клеточного состава костного мозга). У 49 человек диагностированы заболевания легких и состояние предболезни (хроническая обструктивная болезнь легких, хронический бронхит, «безусловные» курильщики табака), у 61 – заболевания сердечно-сосудистой системы (ишемическая болезнь сердца, гипертоническая болезнь, соматоформная вегетативная дисфункция сердца и сердечно-сосудистой системы), у 61 – заболевания органов пищеварения: у 7 из них в виде основного заболевания (язвенная болезнь желудка и 12-перстной кишки), у 54 – в качестве сопутствующей патологии (хронический гастрит с эрозиями, дуоденит, хронический холецистит).
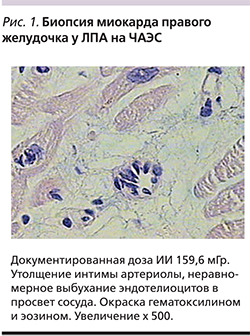 У 14 ЛПА на ЧАЭС с атипичной стенокардией выявлена микроваскулярная форма ИБС, они прошли обследование в ФГБУ НИИ кардиологии СО РАМН, включившее велоэргометрию, селективную коронарографию и вентрикулокардиографию с биопсией миокарда правого желудочка. При обследовании 81 ЛПА на ЧАЭС в ФГБУ НИИ психического здоровья СО РАМН диагностированы непсихотические психические расстройства: в 36 случаях – органическое астеническое расстройство, в 24 – органическое аффективное, в 17 – органическое расстройство личности, в 4 случаях – органическое тревожное расстройство.
У 14 ЛПА на ЧАЭС с атипичной стенокардией выявлена микроваскулярная форма ИБС, они прошли обследование в ФГБУ НИИ кардиологии СО РАМН, включившее велоэргометрию, селективную коронарографию и вентрикулокардиографию с биопсией миокарда правого желудочка. При обследовании 81 ЛПА на ЧАЭС в ФГБУ НИИ психического здоровья СО РАМН диагностированы непсихотические психические расстройства: в 36 случаях – органическое астеническое расстройство, в 24 – органическое аффективное, в 17 – органическое расстройство личности, в 4 случаях – органическое тревожное расстройство.
Группу ИЯРТ составили профессиональные работники ядерного реактора – 20 мужчин и 4 женщины в возрасте от 31 года до 57 лет (средний возраст – 47,1±1,4 года), которые подвергались внешнему γ-излучению в диапазоне предельно допустимых доз в соответствии с нормами радиационной безопасности (НРБ-79/87), существовавшими до 2000 г. Производственный стаж на момент исследования в данной группе составил от 8 до 27 лет (в среднем 17,6±1,6 года), суммарные дозы – от 24,25 до 279,97 мГр (в среднем 78,93±11,84 мГр). Все включенные работники ИЯРТ были практически здоровыми лицами, имели индивидуальные дозиметрические данные и медицинские карты диспансерного наблюдения. В двух случаях был диагностирован хронический холецистит, еще в двух – хронический гастрит, в одном – гипертоническая болезнь, в одном случае – хронический бронхит, в 18 – остеохондроз позвоночника самостоятельно или в сочетании с патологией ЛОР-органов и органов зрения (хронический ларингит, хронический фарингит, легкая степень тугоухости, нетяжелая миопия). Однократное исследование периферической крови проведено 24 работникам, 4 лицам по амбулаторным картам проведен анализ показателей периферической крови в динамике за весь период работы и исследован клеточный состав костного мозга через 11–22 года после начала профессиональной деятельности.
МЦР было исследовано нами в биоптатах кожно-мышечного лоскута из области голени у 36 ЛПА на ЧАЭС и у 7 добровольцев – работников ИЯРТ. Одновременно биопсия из области голени и плеча выполнена 5 ЛПА на ЧАЭС. Из выявленных при морфологическом исследовании структурных сдвигов в системе МЦР выделяли собственно сосудистые и внесосудистые патологические изменения [14]. Обращали внимание на тип воспалительной реакции, глубину поражения сосудистой стенки и калибр измененных сосудов, подсчитывали плотность инфильтрата в расчете на 1 мм2 среза. При описании поражения сосудов воспалительного характера использовали более часто употребляемый термин «васкулит», эквивалентный термину «ангиит» [15]. Под васкулитом понимали повреждение сосудистой стенки с ее инфильтрацией клеточными элементами. Продуктивный васкулит выраженной степени характеризовался густой клеточной инфильтрацией сосудистой стенки, периваскулярной соединительной ткани с распространенным (более 75%) поражением элементов МЦР, наличием периваскулярного склероза и облитерации сосудов. Продуктивный васкулит минимальной степени проявлялся негустой клеточной инфильтрацией сосудистой стенки с вовлечением менее 25% элементов МЦР. Пролиферация эндотелия в отсутствие клеточной воспалительной реакции расценивалась как проявление пролиферативной васкулопатии.
Группы сравнения состояли из мужчин аналогичного возраста без дополнительного облучения сверхрадиационного фона, сопоставимые с ЛПА на ЧАЭС по основным заболеваниям, поведенческим и биологическим факторам риска. Морфологическое исследование сосудов МЦР в биоптате кожно-мышечного лоскута проведено 21 из этих пациентов. Контрольные группы состояли из здоровых лиц, не подвергавшихся облучению, сопоставимых с ЛПА на ЧАЭС, и пациентов группы сравнения по полу и возрасту. Все пациенты в соответствии с Хельсинкской декларацией по правам человека подписали информированное согласие на проведение исследования. В качестве морфологического контроля исследовано МЦР из области голени у 16 здоровых лиц, погибших вследствие острых травм. Статистическую обработку полученных данных проводили с помощью пакета программ Statistica 6.0 for Windows (StatSoft Ins., США). Для сравнения частот встречаемости качественных признаков в исследуемых группах использовался точный критерий Фишера. Статистически значимыми считали различия при p<0,05.
Результаты
Проведенное обследование ЛПА на ЧАЭС и работников ИРТ установило, что ликвидаторы с заболеванием органов дыхания и «безусловные» курильщики табака имеют большую выраженность одышки при нормальных интегральных показателях вентиляционной функции легких (жизненная емкость легких, объем форсированного выдоха1 [ОФВ1]). У них чаще выявляются увеличение минутного объема дыхания, эластической фракции работы дыхания, снижение статической растяжимости легких, повышение тканевого трения на выдохе, снижение мембранного компонента диффузионной способности легких и апикально-базального коэффициента перфузии за счет периваскулярного фиброза и гипервентиляционный синдром. Ликвидаторы с заболеванием сердечно-сосудистой системы характеризуются высокой частотой развития атипичной стенокардии, усилением парасимпатической автономной регуляции сердца и нарушением его диастолической функции. При атипичной стенокардии с неизмененными коронарными артериями, по данным селективной коронарографии, в артериолах и капиллярах биоптатов миокарда правого желудочка выявлены морфологические признаки микроваскулярной формы ишемической болезни сердца (рис. 1). Ликвидаторы с заболеваниями органов пищеварения имеют большую частоту хронического поверхностного гастрита с «полными» эрозиями в антральном отделе желудка.
Обследованием установлено, что для ЛПА на ЧАЭС характерны высокий уровень психоэмоционального напряжения и частота непсихотических психических расстройств органического регистра, изменение неврологического статуса в виде рассеянной симптоматики с преобладанием цефалгического, вестибуло-атактического, астенического синдромов и сенсорной полиневропатии, наличие функциональных и морфологических признаков изменения нервных проводников миелинового типа.
Результаты исследования показали, что у ЛПА на ЧАЭС и работников ИЯРТ выявляются изменения в системе крови: увеличение количества лимфоцитов и моноцитов при динамическом исследовании, признаки «раздражения» костного мозга. При максимальной экспозиции ИИ установлено снижение количества сегментоядерных нейтрофилов, полихроматофильных нормоцитов в миелограмме и развитие в периферической крови анемии, ретикулоцитоза, нейтропении.
В отсутствие клинических проявлений у ЛПА на ЧАЭС выявлены отдельные лабораторные признаки иммунной недостаточности. Общей направленностью изменений было снижение поглотительной способности нейтрофилов и повышение уровня циркулирующих иммунных комплексов, свидетельствующее о развитии функциональной недостаточности моноцитарно-макрофагальной системы, нарушении ее клиренсовой функции.
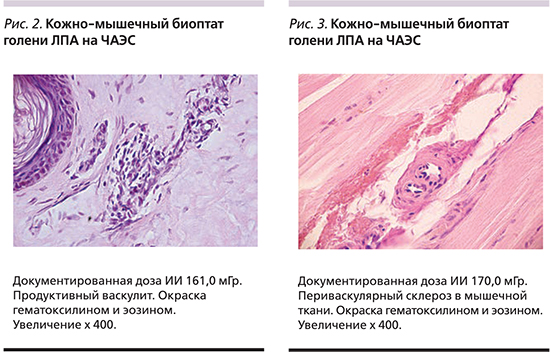
Основными патологическими изменениями сосудов МЦР, выявленными в кожно-мышечных биоптатах у ЛПА на ЧАЭС и работников ИЯРТ, были повреждение эндотелиоцитов, плазматическое пропитывание сосудистой стенки, мукоидное набухание и адаптивная реакция в виде пролиферации эндотелиоцитов, продуктивного васкулита разной степени выраженности с мононуклеарной инфильтрацией сосудистой стенки и исходом в склероз (рис. 2). В группе ЛПА на ЧАЭС реже, чем у пациентов группы сравнения и лиц контрольной группы, выявлялись сосуды без изменений – 4 случая (11,1%) против 13 (61,9%), (p=0,0002) и 12 (75,0%), (p=0,0005) соответственно. Особенностью структурного ремоделирования сосудов МЦР у ЛПА на ЧАЭС было наличие продуктивного васкулита с конечно воспалительными изменениями в большинстве из них – склероза сосудистой стенки, периваскулярного склероза и облитерации сосудов (рис. 3). Морфологическая картина из области плеча у ЛПА на ЧАЭС соответствовала описанной картине в их образцах из области кожи голени. В кожно-мышечных биоптатах работников ИЯРТ выявлялся продуктивный васкулит сосудов МЦР различной степени выраженности.
Обсуждение
Результаты проведенного исследования показали, что патологическое действие малых доз ИИ у ЛПА на ЧАЭС и работников ИЯРТ состоит в генерализованной в различной степени выраженности повреждений МЦР: от васкулопатии до продуктивного васкулита, доказанного результатами исследования биоптатов кожно-мышечного лоскута из различных участков тела (голени, плеча), биопсией миокарда правого желудочка. Воспаление сосудов МЦР протекает латентно, в отсутствие внешних изменений кожи выявляется при гистологическом исследовании. Обоснована гипотеза, согласно которой генерализованное поражение сосудов МЦР, резвившееся при воздействии ИИ в диапазоне исследованных доз, приводит к нарушению гемопоэза индуцирующего микроокружения регуляции кроветворения с изменением в системе крови, как и в периферической нервной системе, вызывает повреждение глиального компонента вегетативного и центрального отделов нервной системы, обусловливая сопряженное развитие нервно-психических расстройств. Аналогичные изменения в сосудах МЦР приводят к клинико-функциональным особенностям заболеваний внутренних органов, развитию коморбидности [16–18].
Сопоставление клинических проявлений у ЛПА на ЧАЭС и работников ИЯРТ показывает, что причина в их различии может быть объяснена развитием у ликвидаторов преимущественно конечно воспалительных структурных изменений сосудов МЦР – склероза сосудистой стенки и периваскулярного пространства, их облитерацией, с распространенным вовлечением сосудов дермы и мышечного слоя. Более существенная степень повреждения МЦР у ликвидаторов, вероятно, связана с большей мощностью дозы внешнего облучения, возможно неучтенным облучением от инкорпорированных радионуклидов, наличием дополнительных факторов риска повреждения сосудов (табакокурение, употребление алкоголя и др.), потенцирующих (аддитивно или мультипликативно) действие ИИ, приводя к нарушению микроциркуляторных модулей (структурно-функциональных единиц) организма, снижению компенсаторно-приспособительных (адаптационных) регионарных резервов микроциркуляции.
Важным итогом научных исследований на сегодняшний день является стремительная эволюция доз ИИ для населения и принятие беспороговой линейной модели действия ИИ в индукции стохастических (прежде всего опухолевых) эффектов. Произошедшие после чернобыльской катастрофы аварии на радиохимическом заводе Сибирского химического комбината, АЭС Фукусима Дайчи свидетельствуют о несовершенстве технологий атомных станций, их уязвимости, возможности повторения ситуаций в будущем.
Это диктует необходимость продолжения изучения неопухолевых заболеваний у лиц, подвергшихся облучению в диапазоне «малых доз». Для первичной профилактики нарушений МЦР необходим поиск эффективных средств защиты и радиопротекции. Основное значение для вторичной профилактики микроциркуляторных нарушений имеют меры, направленные на устранение поведенческих факторов риска, исключение дополнительных профессиональных вредностей (воздействия вибрации, неионизирующих излучений), строго обоснованное применение лучевых методов диагностики в медицинских целях.


