Российская Федерация (РФ) занимает одно из лидирующих мест в мире по числу туристических поездок. Только за 9 месяцев 2015 г. зарегистрировано 27,5 млн выездных поездок граждан РФ [1]. Среди наиболее популярных заграничных направлений для россиян до последнего времени выделяли европейские страны (Финляндия, Греция и Испания), страны Азии (Турция, Израиль, Таиланд и Вьетнам; а также Африки (Египет, Тунис, Марокко) [1]. Значительная доля жителей России также совершают поездки в пределах своей страны. На фоне меняющейся экономической ситуации, а также повышения доступности и развития новых туристических направлений активными темпами растет число туристов, направляющихся в «экзотические» страны: регион Центральной и Южной Африки, Средней Азии и Южной Америки – территории высокого риска развития инфекционной патологии.
Еще одной сравнительно новой тенденцией является вынужденный отказ от дорогостоящих туристических путевок ради «экологического» и «активного» туризма, что также повышает вероятность инфицирования различными инфекционными агентами. Растет число семей, путешествующих с детьми, а также международных детских лагерей и программ по трудовому и культурному обмену среди старших школьников. По данным за 2014 г., из 1135 млн туристов не менее 10% составили дети [2]. При этом возможности оказания медицинской помощи приезжающим туристам, особенно детского возраста, во многих странах крайне ограничены.
Все это позволяет говорить о возрастающей актуальности изучения инфекционных заболеваний путешественников, в первую очередь диареи путешественников (ДП) как самой частой проблеме, встающей перед туристами детского возраста [3].
Диарея путешественников (Diarrheo turista), по определению Всемирной организации здравоохранения (ВОЗ), – полиэтиологический клинический синдром, характеризующийся 3-кратным или более частым появлением неоформленного стула в течение суток у людей, выезжающих за пределы своей страны или в другую климатогеографическую зону, в частности у туристов. Для детей диагностически значимым считается увеличение частоты дефекации в два раза по сравнению с возрастной нормой [4].
По данным ряда исследований, клиническая картина ДП развивается приблизительно у 25–30% путешественников в течение двух недель в зависимости от региона пребывания, соблюдения гигиенических норм и страны происхождения. Среди детского населения риск развития ДП выше и составляет около 41% [5]. Более того, дети значительно реже, чем взрослые, перед поездкой получают информацию о необходимых мерах профилактики и лечения диарейных заболеваний и как следствие – адекватную помощь при развитии ДП, а их состояние чаще требует лечения в условиях круглосуточного стационара.
Среди возбудителей ДП, по данным мировой литературы, доминируют (до 80%) бактериальные агенты [6]. При этом установлена связь между наиболее распространенными инфекционными агентами и регионом путешествия. Так, энтеротоксигенные Escherichia coli (ETEC – enterotoxigenic Escherichia coli) наиболее часто вызывают ДП у детей в Африке и Южной Америке, энтероагрегативные Escherichia coli (EAEC – еnteroaggregative Escherichia coli), кампилобактерии – в Азии, шигеллы и сальмонеллы – в Африке и Латинской Америке [7]. Паразитарные диареи, вызываемые Giardia lamblia и Entamoeba histolytica, наиболее часто встречаются в Азиатском регионе [7]. Данные возбудители ответственны за большинство случаев хронической диареи, развивающейся после путешествий. Представления о доле вирусных возбудителей в общей структуре этиологических факторов ДП пересматриваются. Так, по данным немецких авторов, при применении молекулярно-генетических методов диагностики доля ротавирусов и норовирусов в развитии ДП у детей, вернувшихся из тропических регионов, составляет 27 и 9% [8]. Нельзя исключить, что незначительное количество вирусных возбудителей, выявляемое в ряде предшествующих исследований, связано с трудностями диагностики вирусных инфекций, коротким периодом вирусовыделения и более легким течением инфекционного процесса у большинства больных.
В нашей стране имеются лишь отрывочные данные об эпидемиологии, клинических особенностях и эффективности применения различных схем лекарственной терапии у детей, прибывших или вернувшихся из другой климатической зоны.
Целью работы стало выявление нозологической структуры, особенностей клинического течения, эффективности применяемой терапии детей с ДП.
Материал и методы
Для проведения исследования ретроспективно было проанализировано 1147 историй болезней детей, проходивших лечение в период с мая 2015 по февраль 2016 г. в отделении кишечных инфекций НИИ детских инфекций ФМБА России (Санкт-Петербург).
В рассматриваемую группу были отобраны 86 пациентов, за 14 дней до момента госпитализации по поводу острого гастроэнтерита покидавших пределы Санкт-Петербурга и Ленинградской области (табл. 1).
Верификация диагноза всем пациентам производилась методом полимеразной цепной реакции с использованием праймеров производства «АмплиСенс® ОКИ скрин-FL», «АмплиСенс® Эшерихиозы-FL» и «АмплиСенс® Rotavirus/Norovirus/Astrovirus-FL» производства «Интерлабсервис» (Москва), а также методом бактериального посева. При необходимости для уточнения диагноза проводили серологическое исследование крови для исключения шигеллезов, сальмонеллезов, иерсинеозов.
Оценивались данные эпидемиологического анамнеза, клинического наблюдения за больными, а также результаты лабораторного обследования. Учитывались симптомы острого гастроэнтерита: рвоты, болей в животе, метеоризма, общих симптомов интоксикации (адинамия, снижение или отсутствие аппетита, сонливость), лихорадочной реакции, катаральных явлений со стороны верхних дыхательных путей и развития эксикоза (определение тургора кожных покровов, сухости слизистых оболочек, наличия жажды, олигурии) при поступлении и в динамике наблюдения, а также данные рутинного лабораторного обследования, клинического, биохимического анализа крови, копрограммы, общего анализа мочи.
Все пациенты получали комплексную патогенетическую терапию, включившую регидратацию (инфузионная терапия глюкозо-солевыми растворами и пероральная регидратация низкоосмолярными растворами), диетотерапию, применение ферментных и пробиотических препаратов. В ряде случаев (при наличии в кале патологических примесей – крови, слизи, гноя, тенезмов, стойкой фебрильной лихорадки, болей в животе схваткообразного характера, чаще внизу живота, данных лабораторного обследования) к терапии подключались кишечные антисептики – нифуроксазид (Энтерофурил®, АО «Босналек», Босния и Герцеговина). При необходимости (уточнение этиологии возбудителя, неэффективность терапии, наличие побочных эффектов от приема препарата) производилась замена лекарственного препарата.
Всем пациентам проведена оценка комплексной этиотропной и патогенетической терапии.
Статистическая обработка материала осуществлена с помощью программы Statistica for Windows, v. 10 (StatSoft, США) с использованием параметрических и непараметрических критериев.
Результаты исследования
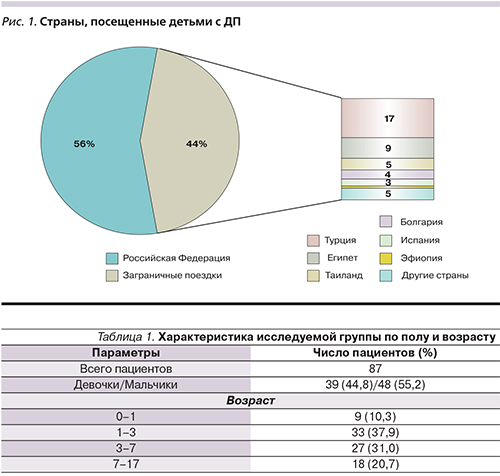
При анализе наиболее часто посещаемых детьми с ДП регионов отмечено доминирование поездок в пределах Российской Федерации (рис. 1). Наиболее часто дети посещали регионы Южного федерального округа (Краснодарский край, Ростовская область, Ставропольский край) и Республики Крым. Что касается заграничных поездок, то дети наиболее часто посещали Турцию, Египет, Таиланд и Болгарию. Наибольшее число пациентов с ДП отмечено в летние месяцы (июнь – n=10; 11,4%; июль – n=21; 24,1% , август – n=16; 18,3%), а также в январе (n=11, 12,6%).
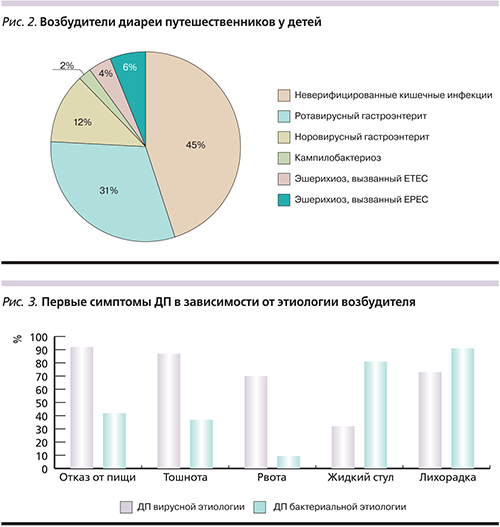
Идентифицировать этиологию возбудителя получилось у 48 (55,2%) пациентов, при этом прямой связи с эпидемиологическими данными выявить не удалось. Среди пациентов с верифицированными кишечными инфекциями (рис. 2) доминировали гастроэнтериты вирусной природы (n=37; 42,5%). Бактериальные инфекции составили 12,7% от всех возбудителей у заболевших детей: кампилобактериозы – 3 пациента, эшерихиозы, вызванные ETEC, – 3, энтеропатогенной E. coli (EPEC – еnteropathogenic Escherichia сoli), – 5.
Симптомы поражения органов пищеварения появлялись у детей на 5–7-е сутки пребывания на новом месте (5,9±1,2 суток). Первыми симптомами ДП (рис. 3), вызванной норо- и ротавирусами, являлись отказ от пищи (n=34; 92%), тошнота (n=32; 86,5%), рвота (n=26; 70,3%), жидкий стул (n=12; 32,4%).
Диарея наиболее часто присоединялась на 2–3-и сутки заболевания. Повышение температуры отмечалось у 27 (72,9%) пациентов, у 18 (55,2%) лихорадка находилась на субфебрильном уровне, у 9 (10,3%) достигала фебрильных значений. При ДП бактериальной этиологии в начале заболевания чаще наблюдали жидкий стул (n=9; 81,8%, p=0,02), в 2 случаях с примесью крови, фебрильная лихорадка (n=8; 72,7%, p=0,01), интенсивные абдоминальные боли (n=10; 90,9%).
Поступление в стационар вне зависимости от этиологии ДП осуществлялось не ранее 2–3-х суток заболевания, в среднем на 3,8±1,1 суток на фоне недостаточной эффективности проводимой терапии. Наиболее часто применялись симптоматические средства (сорбенты, нестероидные противовоспалительные средства), пероральная регидратация. Эмпирическая этиотропная терапия на догоспитальном этапе была начата в отношении 8 (9,2%) детей: 6 – нифуроксазидом, 1 – фуразолидоном, 1 – рифампицином. В 12 (13,8%) случаях дети также получали ферментные препараты, в 6 (6,9%) – пробиотические препараты.
При поступлении средний уровень лейкоцитов среди всех пациентов составил 9,3 ±2,6×103 клеток/мл.

У трети (n=30, 34,5%) больных отмечалось повышение общего числа лейкоцитов более 10×103 клеток/мл, преимущественно за счет относительного и абсолютного повышения уровня нейтрофилов. При этом среди пациентов с установленной этиологией ДП не было выявлено статистических различий между частотой повышения уровня лейкоцитов при вирусных и бактериальных кишечных инфекциях. У 46 (52,9%) пациентов было выявлено повышение СОЭ более 20 мм/ч. Повышение уровня гематокрита более 45% как одного из маркеров выраженности эксикоза имело место только у 6 (6,9%) пациентов.
В копрограмме у большинства (n=66, 75,8%) пациентов отмечались изменения, характерные для синдрома нарушения тонкокишечного пищеварения: измененные мышечные волокна, повышенное содержание крахмала, непереваренные клетчатка мыла и кристаллы жирных кислот.
В 21 (18,3%) случае в копрограмме определялись лейкоциты (до 20–30 в поле зрения), большое содержание слизи, у 3 (3,4%) пациентов в кале были выявлены эритроциты (до 10–12 клеток в поле зрения). Колитный характер копрограммы значимо чаще выявлялся у пациентов с ДП бактериальной этиологии. Обращало на себя внимание наличие подобных изменений в стуле и у значительного числа (n=10; 27%) пациентов c кишечной инфекцией вирусной этиологии, что, возможно, может быть частично объяснено сочетанным выявлением у этих пациентов избыточного роста условно-патогенной флоры (Klebsiella spp., Proteus spp., Pseudomonas aeruginosa, Citrobacter spp.). Так, у 7 (70%) из них было диагностировано превышение диагностического титра на 2–3 lg КОЕ/мл. Среди всех пациентов повышение уровня условно-патогенных микроорганизмов наблюдалось в трети (31%) случаев, что позволяет рассматривать данный фактор как одну из возможных причин негладкого течения ДП и возможную точку приложения медикаментозного воздействия (табл. 2).
Все пациенты получали базовую комплексную патогенетическую терапию, включившую регидратацию, диетотерапию, ферментные и пробиотические препараты. Помимо этого 19 пациентов получали лечение нифуроксазидом, из них у 5 была продолжена эмпирическая терапия, начатая до госпитализации. На фоне проводимой терапии у всех пациентов отмечалось клиническое улучшение состояния.
В 2 случаях препарат был заменен на азитромицин при установлении кампилобактерной этиологии заболевания.
Пациенты хорошо переносили проводимую терапию. Препарат не вызывал диспепсических проявлений: болей в эпигастральной области, тошноты, рвоты. Несмотря на необходимость частого приема препарата (3 раза в сутки), наличие лекарственной формы в виде суспензии с приятным вкусом благоприятно сказывалось на желании детей продолжать прием препарата.
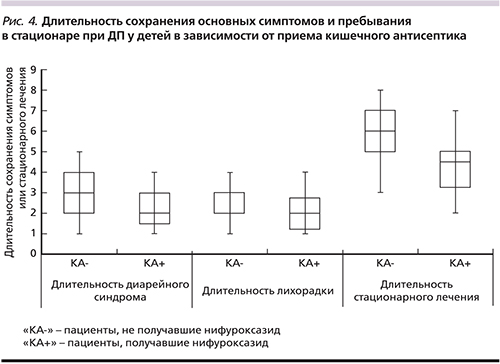
В среднем нифуроксазид применялся в течение 4,8±0,2 суток. Длительность сохранения диарейного синдрома на фоне приема препарата (рис. 4) составила 2,3±0,7 суток (у пациентов, не получавших препарат, – 3,2±1,1 суток; p=0,07).
Важно отметить, что среди пациентов, получавших нифуроксазид, не было выявлено ни одного случая значимого повышения титра условно-патогенной микрофлоры кишечника. Нормализация температуры на фоне приема нифуроксазида наступала на 2,1±0,5 суток (2,6±1,2 суток у пациентов, не получавших препарат; p=0,08). Средняя длительность госпитализации пациентов, получавших терапию, составила 5,4±1,1 суток (продолжительность стационарного лечения среди всех пациентов – 5,8±1,2 суток; p=0,17).
У части (n=24, 35,3%) пациентов, не получавших препарат, на момент выписки из круглосуточного стационара сохранялись жалобы на вздутие, урчание в животе, метеоризм, дискомфорт в околопупочной области, снижение аппетита, вялость, что требовало продолжения терапии в амбулаторных условиях. Среди пациентов, получавших нифуроксазид, подобные симптомы на момент выписки сохранились только в 3 случаях (n=3, 15,8%; p=0,17).
Обсуждение
Несмотря на то что проблема ДП у детей уже несколько десятилетий приковывает внимание инфекционистов и педиатров, представления об эпидемиологии, клинико-лабораторных особенностях течения и тактики догоспитального и стационарного лечения требуют дальнейшего уточнения.
В работе проведено клинико-лабораторное и эпидемиологическое исследование детей, перенесших ДП тяжелого и среднетяжелого течения, требующую стационарного лечения ребенка. На примере пациентов кишечного отделения НИИ детских инфекций показано, что в развитии ДП у детей при поездках как в пределах РФ, так и за рубежом, преимущественно в летние месяцы, важную роль играют как вирусные, так и бактериальные возбудители. Эти данные согласуются с современными результатами, полученными при расшифровке нозологической структуры ДП в работах американских и немецких групп исследователей [8–10].
В проведенном исследовании также уточняется характеристика клинической картины, приведены специфические лабораторные признаки ДП вирусной и бактериальной этиологии. В частности, было показано, что при вирусной этиологии ДП в клинической картине доминируют поражения верхних отделов кишечника, а при бактериальных острых кишечных инфекциях помимо этого отмечают выраженные симптомы интоксикации и поражение нижних отделов кишечника.
Среди факторов, приводящих к необходимости госпитализации ребенка по возвращении из путешествия в связи с ДП, одним из важных является недостаточная эффективность догоспитального лечения [11]. На основании этого можно констатировать необходимость посещения врача-педиатра или инфекциониста накануне поездки для получения соответствующих рекомендаций как для профилактики диареи, так и для оптимизации помощи ребенку при развитии ДП [12].
Ключевая роль в оказании помощи ребенку с ДП отводится восстановлению водного баланса за счет пероральной регидратации низкоосмолярными растворами [13]. Помимо этого одним из наиболее дискутабельных вопросов в отношении лекарственной терапии ДП является назначение антимикробных препаратов и кишечных антисептиков. В соответствии с рекомендациями ВОЗ назначение антимикробных препаратов при инфекционных диареях показано только при ограниченном количестве бактериальных кишечных инфекций: холере, брюшном тифе, шигеллезе и амебиазе [14].
Однако в последнее время появляется целый ряд сообщений об успешном применении эмпирической антибактериальной терапии при среднетяжелых формах инвазивных и водянистых диарей и отсутствии индивидуальной непереносимости препаратов пациентами, находящимися в путешествии [11]. Ряд исследователей даже высказывают предложения о назначении антибактериальной терапии не только для лечения диареи, но и с профилактической целью при выезде в регионы с низким санитарным уровнем и отсутствием квалифицированной помощи [15]. В то же время доказано, что применение антибиотиков при ДП далеко не всегда эффективно и безопасно и должно по возможности осуществляться после консультации врача и получения результатов лабораторного обследования фекалий. При невозможности выполнения данных условий преимущество должно отдаваться препаратам с максимально широким спектром действия, которые плохо всасываются из кишечника и обладают широким профилем безопасности в отношении как ребенка, так и симбиотической микрофлоры кишечника. К таким препаратам относятся производные оксихинолина и нитрофураны.
Результаты нашего исследования показывают, что эмпирическое применение нифуроксазида при ДП способствует более легкому течению заболевания: уменьшает длительность диарейного синдрома, лихорадки, а также снижает вероятность избыточного роста условно-патогенной микрофлоры кишечника.
Учитывая широкий спектр антибактериального действия, практически полное отсутствие влияния на нормальную микрофлору, высокий профиль безопасности и наличие суспензионной лекарственной формы, кишечный антисептик нифуроксазид можно рассматриваться как потенциальный препарат выбора при лечении ДП у детей.
Выводы
В развитии ДП у детей вне зависимости от географии путешествия значимую роль играют как вирусные (ротавирусы и норовирусы), так и бактериальные (кампилобактерии и энтеропатогенные и энтротоксигенные эшерихии) возбудители.
Избыточный рост условно-патогенных микроорганизмов при ДП наблюдается в трети случаев и может рассматриваться как один из значимых факторов, определяющих тяжесть течения заболевания у детей.
Кишечный антисептик нифуроксазид (Энтерофурил®, АО «Босналек», Босния и Герцеговина) способствует более легкому течению ДП, уменьшает длительность основных симптомов заболевания, пребывания в стационаре а также снижает вероятность избыточного роста условно-патогенной микрофлоры.



