Введение
Ювенильный идиопатический артрит (ЮИА) – хроническое воспалительное заболевание суставов неизвестной этиологии продолжительностью не менее 6 месяцев, начинающееся в возрасте до 16 лет [1]. ЮИА является чрезвычайно гетерогенной группой и представлен набором подтипов с разными патогенетическими механизмами, отличающимися некоторыми клиническими и эпидемиологическими характеристиками [2]. ЮИА – одно из наиболее распространенных ревматических заболеваний детского возраста [3]. Прорыв в терапии ЮИА произошел за последнее десятилетие и связан с широким внедрением в практику целого класса новых лекарственных соединений – генно-инженерных иммунобиологических препаратов (ГИБП), обладающих таргетным влиянием на ключевые молекулы иммунной системы. Наиболее изученным классом таких препаратов в детской ревматологии следует считать блокаторы фактора некроза опухолей-α (ФНО-α). Появление ГИБП открывает новые возможности в терапии, а следовательно, оказывает существенное влияние на прогноз заболевания. Однако, несмотря на серьезные успехи терапии ЮИА, при поздней диагностике и/или неоптимальной терапии заболевание приводит к снижению качества жизни и инвалидизации.
В настоящее время для лечения ЮИА без системных проявлений разрешены к применению несколько ГИБП с разными механизмами действия: блокаторы ФНО-α (этанерцепт и адалимумаб), блокатор интерлейкина-6 – ИЛ-6 (тоцилизумаб) и блокатор костимуляции Т-лимфоцитов (абатацепт). Все вышеперечисленные препараты разрешены к применению с 2-летнего возраста, за исключением абатацепта, который разрешен к применению детьми старше 6 лет. К одним из актуальных вопросов применения ГИБП относятся вопрос выбора терапии первой линии, а также вопросы переключения между препаратами при развитии первичной или вторичной неэффективности.
Исторически препаратами первой линии, исходя из Рекомендаций американской коллегии ревматологов ACR (American College of Rheumatology, 2011), стартовыми рассматриваются блокаторы ФНО-α, однако с момента публикации данных рекомендаций прошло более 5 лет [4]. За это время накопился опыт, вышедший за рамки рандомизированных контролируемых испытаний, изменились не только представления об эффективности препаратов, но и появились «новые» препараты, не получившие отражения в рекомендациях 2011 г. Кроме того, остаются открытыми вопросы разработки предикторов эффективности того или иного ГИБП, что позволило бы оптимизировать терапию пациентов с ЮИА и сделать терапию еще более «таргетной». В наиболее репрезентативном 12-летнем исследовании, выполненном в РФ и включившем опыт применения блокаторов ФНО-α 964 пациентами, сделаны попытки выделить группы пациентов, для которых терапия ГИБП может быть более эффективной. Так, например, показано, что детям с продолжительностью заболевания более 2 лет целесообразно применение адалимумаба по сравнению с этанерцептом. Также адалимумаб рекомендуется к применению при наличии сопутствующего увеита или при развитии увеита de-novo у пациентов, получавших терапию этанерцептом [5]. Несмотря на накопленный опыт, до настоящего момента не установлены маркеры, позволяющие с уверенностью предсказывать результаты лечения, его длительность и сроки отмены. Результаты рандомизированных исследований, как правило, ограничены временными рамками, в их задачи входят оценка первичной эффективности и безопасности, тогда как вопросы отдаленных результатов, возможности достижения безлекарственной ремиссии, как правило, остаются за рамками рандомизированных клинических испытаний (РКИ). Наибольшую информацию об отдаленных результатах дают ретроспективные исследования, однако они не столь тщательно спланированы, как РКИ. С другой стороны, в ретроспективные исследования включаются пациенты из реальной клинической практики, которые не совсем похожи на таковых из РКИ. Считают, что пациенты из РКИ лишь на 10% похожи на больных из реальной клинической практики; таким образом, несмотря на имеющиеся недостатки, ретроспективные исследования продолжают быть важным источником информации для практикующих врачей.
Целью нашего исследования было обобщить опыт лечения адалимумабом детей с ЮИА без системных проявлений, оценить сроки и возможность достижения неактивного заболевания, частоту обострений, а также их причины и побочные эффекты.
Материал и методы
В ретроспективное обсервационное исследование были включены 53 ребенка, страдавших ЮИА без системных проявлений, резистентных к предшествующей терапии небиологическими болезнь-модифицирующими противоревматическими препаратами (БМПП). Все пациенты на момент включения имели активный артрит. Часть пациентов на момент включения также имели увеит разной степени активности. Для проведения некоторых видов статистического анализа пациенты были сгруппированы в три основные группы: 1) пациенты с олигоартикулярным вариантом течения (не более 4 активных суставов) – в эту группу включены пациенты с персистирующим олгоартритом, а также пациенты с олигоартикулярным варинтом течения псориатического артрита; 2) пациенты с полиартикулярным вариантом течения ЮИА (5 и более активных суставов) – сюда включены пациенты с распространяющимся олигоартритом, полиартритом, позитивным и негативным по ревматоидному фактору полиартикулярным вариантом псориатического артрита, а также артритом, ассоциированным с воспалительным заболеванием кишечника (ВЗК) с 5 и более активными суставами; 3) энтезит-ассоциированный артрит (ЭАА) с любым числом активных суставов (ЧАС). Все подтипы ЮИА определены согласно классификационным подходам ILAR (International League Against Rheumatism) [2]. Резистентность к предшествующей терапии небиологическими БМПП определена как недостаточная эффективность и/или непереносимость метотрексата в виде парентеральных инъекций в дозе 15 мг/м2/нед либо сульфасалазина в терапевтических дозировках 30–50 мг/кг (для ЭАА), но не более 2000 мг/сут, а также комбинации метотрексата с другим небиологическим БМПП.
Такие клинические особенности, как увеит разной степени активности, наличие ВЗК, псориатический артрит, а также неэффективность предшествующей терапии другими ГИБП, были приоритетными при назначении адалимумаба.
Все пациенты получали терапию адалимумабом в дозе 40 мг подкожно каждые 2 недели. В отношении пациентов с тяжелым течением ЮИА допускалось сокращение промежутков между инъекциями до 7–10 дней в случаях развития вторичной неэффективности.
Дизайн исследования предполагал внесение в базу данных основных показателей активности артрита, таких как ЧАС, уровни гемоглобина, лейкоцитов, тромбоцитов периферической крови, измерение скорости оседания эритроцитов (СОЭ), измерение концентрации С-реактивного белка (СРБ), как до начала терапии адалимумабом, так и во время нее. Терапия адалимумабом всех пациентов была инициирована в педиатрическом отделении № 3 СПбГПМУ, иногородние пациенты продолжали терапию в регионах, приезжая на контрольные обследования в СПбГПМУ каждые 3–6 месяцев. Окончанием исследования считался последний известный эпизод введения адалимумаба. Данные обо всех побочных эффектах во время исследования собирались по возможности максимально рано относительно времени их появления. Для всех пациентов оценивалась возможность изменения сопутствующей иммуномодулирующей терапии, а также достижение статуса неактивного заболевания, определяемого как отсутствие активных суставов, отсутствие системных проявлений, имеющих отношение к ЮИА, неактивное течение увеита, нормальные значения показателей реактантов острой фазы, отсутствие активности заболевания, по мнению врача [6]. Осмотр офтальмолога с применением биомикроскопии осуществлен в сроки в соответствии с рекомендациями ACR в зависимости от возраста, наличия антинуклеарного фактора и активности сопутствующего увеита [7].
Отдельно произведено сравнение эффективности адалимумаба как первого (n=38), так и последующего ГИБП (n=15), когда адалимумаб использовался после других биологических ГИБП (блокаторы ФНО-α, абатацепт).
Первоочередной задачей данного исследования была оценка динамики суставного синдрома, а также клинико-лабораторных характеристик ЮИА. Подробная оценка динамики увеита не входила в задачи данного исследования и будет проанализирована отдельно в последующих исследованиях.
Статистический анализ был выполнен при помощи пакетов статистических программ Statistica 6.0, Biostat, MedCalc и Microsoft Excel. Использованы методы описательной статистики (определялись медиана и интерквартильный размах), χ2-критерий, точный критерий Фишера. Для сравнения двух зависимых групп использован парный тест Вилкоксона, для сравнения более двух зависимых групп – тест Фридмана. Для сравнения двух независимых групп использован тест Манна–Уитни. Применен анализ специфичности и сенситивности, ROC-анализ (определяли отрезные точки, сенситивность и специфичность, AUC – area under the curve – «площадь под кривой»), Log-Rank-анализ, регрессионные модели Cox, а также анализ выживаемости Каплана–Мейера.
Результаты исследования
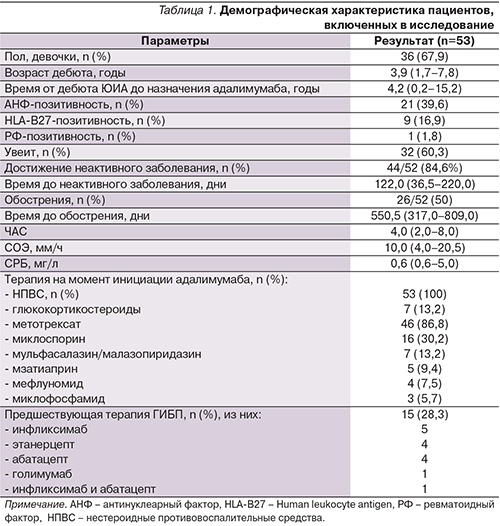
Подробная демографическая характеристика пациентов, включенных в исследование, представлена в табл. 1. Как видно из таблицы, бóльшая часть пациентов представлена девочками, преобладали дети до 5 лет с высокой частотой увеита (60,3%) и сравнительно невысокой лабораторной активностью.
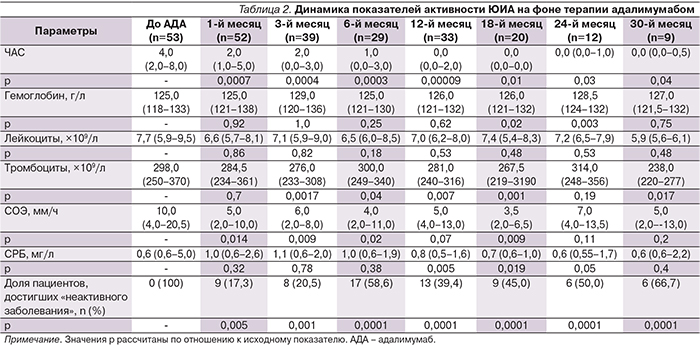
При динамическом наблюдении за пациентами, получавшими адалимумаб в сроки от момента включения до 30 месяцев, отмечено достоверное снижение ЧАС по сравнению с днем первого введения препарата. Медиана числа суставов, равная 0, была достигнута в исследуемой группе к 12-му месяцу наблюдения. Динамика числа лейкоцитов, тромбоцитов, уровней гемоглобина и СРБ была малосущественной в отличие от динамики снижения СОЭ. Доля пациентов, достигших в разные временные отрезки наблюдения статуса «неактивное заболевание», а также подробная динамика основных показателей активности ЮИА за период наблюдения представлены в табл. 2.
Следующим этапом исследования была оценка способности пациентов к достижению статуса «неактивное заболевание», а также поиск клинико-лабораторных предикторов, способствующих либо препятствующих этому. Пациенты были разделены на две группы: достигшие (n=44) и не достигшие (n=8) этого статуса хотя бы один раз за период наблюдения.
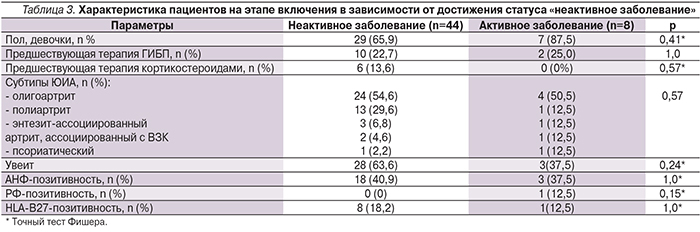
Особенности течения ЮИА на момент включения пациентов в исследование в зависимости от достижения ими статуса «неактивное заболевание» представлены в табл. 3. Мы не выявили статистически достоверных различий по основным характеристикам ЮИА на момент первого введения адалимумаба в зависимости от способности достижения статуса «неактивное заболевание».
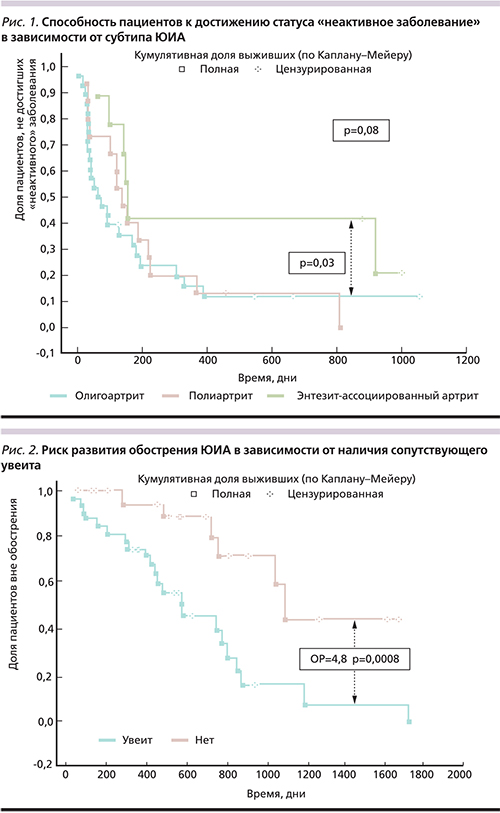
При использовании анализа выживаемости по методу Каплана–Мейера выявлено, что пациенты с олиго- и полиартикулярными субтипами ЮИА лучше и быстрее достигают статуса «неактивное заболевание», нежели пациенты с энтезит-ассоциированным артритом (рис. 1.)
Следующим этапом исследования было выявление предикторов обострения ЮИА на фоне терапии адалимумабом. Проведено изучение клинико-лабораторных особенностей течения ЮИА на момент первого введения адалимумаба, ассоциированных с развитием обострения. Пациенты были разделены на две группы в зависимости от развития хотя бы одного рецидива на фоне терапии адалимумабом. У пациентов с обострением отмечено достоверно меньшее ЧАС. Кроме того, в этой группе пациентов чаще встречался олигоартикулярный субтип ЮИА, несколько чаще в анамнезе были опыт применения ГИБП, отмена БМПП, однако выявленные различия статистически не достоверны. Такие факторы, как предшествующая терапия глюкокортикоидами (ГК), изменение режима дозировки адалимумаба при достижении ремиссии, не сопровождались риском развития обострения ЮИА (табл. 4).
Применение регрессионного анализа показало, что такие факторы, как продолжительность ЮИА не менее 4 лет, наличие увеита, отмена БМПП, были независимыми предикторами обострения ЮИА (оценивалось наличие первого клинически значимого обострения и время до его развития на фоне терапии адалимумабом пациентов, ранее достигших статуса «неактивное заболевание»). Вероятно, наличие увеита является индикатором тяжести течения ЮИА, что объясняет повышенный риск обострений артрита у пациентов с сопутствующим увеитом. Хорошо известная взаимосвязь увеита с меньшим ЧАС объясняет выявленную закономерность в виде меньшего ЧАС у пациентов с обострением (табл. 5, рис. 2).
При анализе выживаемости показано, что наибольшую вероятность развития рецидива имеют пациенты с олигоартикулярным субтипом ЮИА, для которых наличие увеита более типично, тогда как пациенты с энтезит-ассоцированным субтипом ЮИА чаще и дольше сохраняю статус «неактивное заболевание», несмотря на меньшую исходную вероятность достижения этого статуса (рис. 3)
Обсуждение
Известно, что в воспалительный ответ вовлечены разные цитокины, в т.ч. ФНО-α, ИЛ-1, ИЛ-2, ИЛ-6. Ведущая роль в регуляции процессов воспаления принадлежит ФНО-α, что делает его центральной терапевтической мишенью для ряда нозологий, таких как ЮИА, ревматоидный артрит взрослых, анкилозирующий спондилоартрит, псориаз, ВЗК. В настоящее время из 5 блокаторов ФНО-α только 2 препарата одобрены для лечения детей с полиартикулярным вариантом ЮИА на основании результатов двойных слепых плацебо-контролируемых РКИ [8–9].

Адалимумаб является полностью человеческим моноклональным антителом, специфичным к ФНО-α. Препарат одобрен в США в феврале 2008 г., в Европе – в сентябре 2008 г., в России зарегистрирован для лечения полиартикулярных форм ЮИА с 2 лет как в режиме монотерапии, так и в комбинации с метотрексатом.
В исследовании D. Lovell и соавт. сравнивались группы детей, получавших адалимумаб вместе с метотрексатом или без него. Уже к 1-й неделе 71% пациентов, получавших оба препарата, достигли ACR Pedi 70. С течением времени число детей с высоким уровнем ответа нарастало и через 1,5 года ACR Pedi 90 составило 40% [8]. По данным японских авторов [10], уровень ACR Pedi 90 увеличивается с максимального уровня в 20% к 16-й неделе до 50% к 60-й неделе. В нашем исследовании скорость достижения ремиссии была выше, медиана «активных» суставов, равная 0, была достигнута к 12-му месяцу. В недавно опубликованном канадском исследовании дети с различными вариантами ювенильного артрита имели возможность достижения ремиссии в 78% случаев, по крайней мере 1 раз в течение первых 2 лет болезни [12].
В нашем исследовании доля детей, достигших неактивного заболевания, была достаточно высокой (84,6%) при сравнительно коротком сроке, медиана времени достижения состави-ла 122 дня (36,5–220,0).
Интересным представляется выход в неактивную фазу детей с разными вариантами ЮИА. Канадские ревматологи провели исследование с включением 1104 пациентов из 16 центров за период с 2005 по 2010 г.
Все дети лечились современными препаратами с учетом национальных рекомендаций. Статус неактивного заболевания был достигнут 883 (89%) пациентов через 13 (7,7–21,7) месяцев после установления диагноза. Сроки и темпы достижения неактивного заболевания были различными для разных категорий ЮИА. По мнению авторов, наименьший процент выхода в ремиссию был в группе РФ-позитивного артрита и составил всего 48%, наилучший результат был в группе псориатического артрита – 91% за 2 года. Что касается группы ЭАА, то его результаты близки к группе недифференцированного артрита, составили около 65% и заняли третью позицию по скорости достижения неактивной фазы [11].
В нашем исследовании пациенты с энтезит-ассоциированным вариантом ЮИА достигали статуса «неактивное заболевание» медленнее и реже, чем пациенты с олигоартикулярным и полиартикулярным вариантами ЮИА. Пациентов с псориатическим артритом и РФ-позитивным артритом было крайне мало; таким образом, наличие РФ-позитивности существенно не влияло на усредненные результаты выхода в ремиссию пациентов с полиартикулярным вариантом ЮИА.

В исследовании R. Burgos-Vargas и соавт. по оценке эффективности применения адалимумаба при энтезит-ассоциированном варианте ЮИА показано статистически значимое улучшение в группе детей, получавших адалимумаб, уже к 12-й неделе.
В течение открытой фазы к 52-й неделе улучшения, по критериям ACR Pedi 70 и ACR Pedi 90, достигли 75 и 60% соответственно. Следует отметить, что к этому времени у 93,5% детей полностью купирована припухлость суставов [12].
Результаты нашего исследования показывают, что факт предшествующей терапии ГК, изменение режима дозирования адалимумаба у пациентов, уже достигших ремиссии, не сопровождались повышением риска развития обострения ЮИА.
В отношении ГК результаты исследования D.J. Lovell и соавт. совпадают с нашим наблюдением [8]. В то же время, по нашим данным, риск рецидива увеличивается при отмене базисного препарата, особенно это актуально для детей с олигоартритом и увеитом, которых в исследовании было более 60%.
Препарат был отменен всего у 2 детей по причине его недостаточной эффективности в отношении увеита у одного ребенка, увеита и артрита у второго. У второго ребенка отмечено развитие вторичной неэффективности и, несмотря на применение адалимумаба в достаточной дозе, у детей сохранялись признаки увеальной активности, даже сокращение сроков между введениями, равно как и повышение дозировок, не привело к стабилизации процесса. У нескольких детей также отмечено развитие вторичной неэффективности (т.н. ускользание эффекта), которое было устранено при повышении дозы и сокращении промежутков времени между введениями, а также при добавлении либо увеличении дозы метотрексата. Относительно безопасности препарата стоит отметить один случай развития серьезного побочного эффекта – развития диссеминированного туберкулеза легких у мальчика на 3-м году применения адалимумаба на фоне нераспознанного бытового контакта с больным туберкулезом. Препарат был незамедлительно отменен, ребенок получает специфическую противотуберкулезную терапию. За исключением этого случая профиль безопасности был приемлемым для такого класса лекарственных препаратов, не отмечено существенного прироста частоты и тяжести острых инфекционных заболеваний на фоне терапии адалимумабом.
Заключение
В нашем исследовании показана эффективность и безопасность применения адалимумаба детьми с ЮИА без системных проявлений, проведена попытка поиска предполагаемых предикторов эффективности, а также факторов риска обострения у детей на фоне терапии адалимумабом. Несмотря на сравнительно небольшую численность исследуемой группы, наше исследование отражает опыт врачей-ревматологов одного центра, а это означает достаточно близкие подходы к диагностике и решению терапевтических задач. Требуются последующие исследования в этой сфере для получения более точных результатов, позволяющих оптимизировать подходы к терапии ГИБП.


