Использование врачами-ревматологами генно-инженер-ных биологических препаратов (ГИБП) позволило достичь принципиально нового уровня клинической эффективности за счет таргетного воздействия на специфические компоненты патогенеза ревматоидного артрита (РА). В значительном количестве достоверных клинических исследований отчетливо продемонстрированы преимущества ГИБП по сравнению с традиционными базисными противовоспалительными препаратами (БПВП), включая метотрексат (МТ), который до настоящего времени остается «золотым» стандартом в лечении РА [1].
Согласно как международным, так и российским клиническим рекомендациям, ГИБП назначают в случаях недостаточной эффективности или непереносимости моно- или комбинированной терапии БПВП (включая МТ) в течение трех месяцев. Для увеличения эффективности терапии ГИБП целесообразно сочетать с применением МТ [2]. В то же время, по данным многочисленных регистров и исследований, до 30% пациентов с РА получающих ГИБП, в настоящее время используют их в режиме монотерапии, что в подавляющем большинстве случаев связано с непереносимостью МТ [3–6].
Первым исследованием, инициированным для проведения сравнительного анализа клинической эффективности ГИБП, одобренных для лечения РА в режиме монотерапии, стало исследование ADACTA (ADalimumab ACTemrA). В этом многоцентровом рандомизированном двойном слепом исследовании IV фазы оценивалось снижение объективных и субъективных признаков заболевания в ходе монотерапии препаратами тоцилизумаб (Актемра) и адалимумаб (Хумира) у взрослых пациентов с активным РА, непереносимостью либо нецелесо-образностью продолжения терапии МТ. Все пациенты ранее не получали ГИБП; 326 больных РА, включенных в исследование, были рандомизированы (в соотношении 1:1) для получения препарата тоцилизумаб в дозе 8 мг/кг внутривенно каждые 4 недели либо препарата адалимумаб в дозе 40 мг подкожно каждые 2 недели в течение 24 недель.
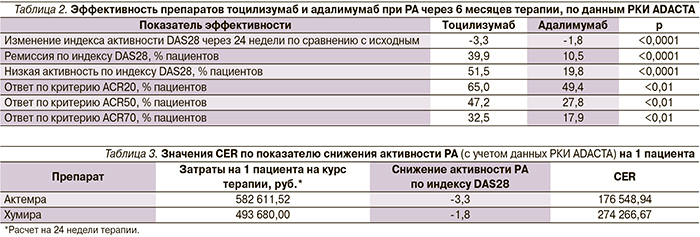
Результаты, полученные в исследовании ADACTA, продемонстрировали, что через 24 недели у пациентов с тяжелой формой активного РА и непереносимостью или неудовлетворительным ответом на МТ эффективность использования рассматриваемых ГИБП отличалась:
- среднее изменение активности заболевания (уменьшение индекса DAS28 – Disease Activity Score) составило 3,3 при лечении тоцилизумабом и 1,8 при лечении адалимумабом;
- частота ремиссии по индексу DAS28 составила 39,9% в группе тоцилизумаба и 10,5% в группе адалимумаба (DAS28<2,6);
- низкой активности заболевания по индексу DAS28 в группе тоцилизумаба достигли 51,5% пациентов, в группе адалимумаба 19,8%;
- ответ по критериям ACR (American College of Rheumatology) 20, 50 и 70 был достигнут 65, 47,2 и 32,5% пациентов группы тоцилизумаба по сравнению с 49,4, 27,8 и 17,9% в группе адалимумаба.
Различия по всем клиническим конечным точкам были статистически значимыми [7].
С учетом значительного количества больных, нуждающихся в монотерапии ГИБП, целью данного исследования стала сравнительная фармакоэкономическая оценка биологической терапии с использованием тоцилизумаба и адалимумаба у взрослых пациентов с активным РА и непереносимостью БПВП и/или нецелесообразностью дальнейшего применения этих препаратов.
Материал и методы
Исходя из поставленной нами цели, была построена клинико-экономическая модель применения тоцилизумаба и адалимумаба у взрослых пациентов с РА и непереносимостью МТ, либо нецелесообразностью его дальнейшего применения. В рамках моделирования определяли показатели затратной эффективности сравниваемых медицинских технологий. Учитывали различия в клинической эффективности тоцилизумаба и адалимумаба, которые определяли по данным многоцентрового рандомизированного двойного слепого сравнительного исследования ADACTA [7]. В соответствии с дизайном и результатами этого исследования принимали, что пациенты с РА (по 100 человек в каждой из групп) получают в течение 24 недель: 1-я группа – тоцилизумаб в дозе 8 мг/кг внутривенно каждые 4 недели, 2-я группа – адалимумаб в дозе 40 мг подкожно каждые 2 недели. Показателями эффективности считали снижение индекса активности заболевания DAS28 от исходного уровня к 24-й неделе, долю пациентов с ремиссией и низкой активностью заболевания по индексу DAS28, долю пациентов, ответивших на терапию по критериям ACR20/ACR50/АCR70 на 24-й неделе при монотерапии указанными препаратами.
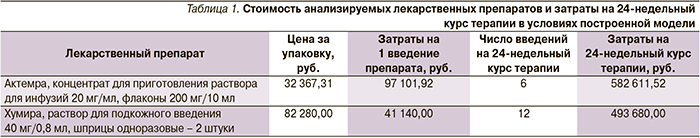
При сравнении рассматриваемых в фармакоэкономической модели стратегий учитывали максимальные оптовые цены с НДС (налог на добавленную стоимость) на лекарственные препараты Актемра (тоцилизумаб) и Хумира (адалимумаб), зарегистрированные в соответствии с распоряжением Правительства РФ № 2782-р от 30.12.2014 в Московском регионе на период 2 марта 2015 г., которые соответствовали 32 367,31 и 82 280 руб. соответственно (табл. 1).
Другие виды затрат, в т.ч. на лечение побочных эффектов и осложнений, не учтены, т.к. принимали их равными в каждой из групп или незначительными. В первую очередь это было обусловлено результатами исследования ADACTA, в котором абсолютное число и доли пациентов, у которых возникло хотя бы одно нежелательное явление, в т.ч. серьезное, в сравниваемых группах были сопоставимыми.
На основании полученных данных определяли показатель затратной эффективности CER (cost-effectiveness ratio), который рассчитывали по формуле:
CER=C/Ef,
где С ― прямые затраты на лекарственные препараты в группе пациентов (в руб.); Ef ― эффективность терапии в группе.
Коэффициент эффективности приращения затрат CERincr (инкрементальный коэффициент) рассчитан по формуле:
CERincr=(C1–C2)/(Ef1–Ef2),
где, С1 и С2 – общие прямые затраты в сравниваемых группах (в руб.); Ef1 и Ef2 – эффективность терапии в сравниваемых группах.
Анализировали чувствительность модели к изменению затратной эффективности в снижении активности РА по индексу DAS28 с учетом увеличения и снижения стоимости рассматриваемых в модели препаратов в диапазоне от -30% до +30%.
Результаты исследования
Расчет затрат на монотерапию препаратами тоцилизумаб и адалимумаб в группах пациентов с РА и непереносимостью или нецелесообразностью дальнейшего применения МТ обнаружил, что абсолютные затраты на фармакотерапию Актемрой составляют 582 611,52 руб., Хумирой – 493 680,00 руб. из расчета на одного пациента. По результатам исследования ADACTA, клиническая эффективность Актемры на основании изменения индекса активности заболевания DAS28 существенно превосходила таковую Хумиры: -3,3 и -1,8 соответственно (табл. 2). Исходя из этого показатели «затраты–эффективность» (CER) составили для группы Актемры 176 548,94, для группы Хумиры – 274 266,67 (табл. 3).
Аналогичным образом был проведен расчет CER по другим показателям: доле пациентов с ремиссией, показатель составил для тоцилизумаба и адалимумаба 1 460 179,24 и 4 701 714,29, и низкой активностью РА по индексу DAS28 – 1 131 284,50 и 2 493 333,33; соответственно. При рассмотрении затратной эффективности с учетом доли пациентов, ответивших на фармакотерапию по критериям ACR20/50/70, наблюдается схожая тенденция – показатели CER всегда более предпочтительны в группе применения тоцилизумаба (табл. 4).
Коэффициент приращения затрат (инкрементальный коэффициент) в изменении индекса активности заболевания по индексу DAS28 составил 59 287,68 руб./ЕД, что меньше затрат на одну вводимую дозу Актемры.
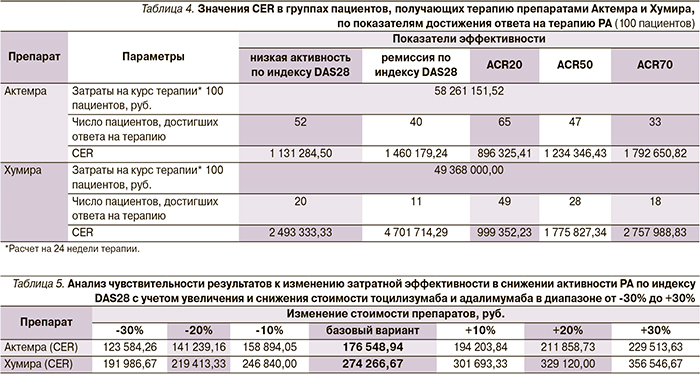
Анализ чувствительности результатов подтвердил полученные нами ранее данные. Изменение цены не влияет на результаты нашего исследования, применение тоцилизумаба всегда более предпочтительно клинико-экономически по сравнению с адалимумабом, что говорит об отсутствии чувствительности построенной модели к изменению стоимости рассматриваемых медицинских технологий (табл. 5).
Таким образом, применение Актемры у пациентов с РА фармакоэкономически эффективнее по сравнению с Хумирой до 3 раз (соотношение меняется в зависимости от показателя эффективности).
Обсуждение
Использование ГИБП позволило кардинально изменить прогноз для наиболее тяжелых пациентов с РА, ранее практически не поддававшихся лечению. Несмотря на то, что в ряде клинических рекомендаций отмечено, что ГИБП характеризуются сходными показателями в снижении активности РА и частотой объективного ответа, нельзя не отметить различий в клинической эффективности, выявляемых в рамках рандомизированных клинических исследований head-to-head. Одним из таких примеров может служить исследование ADACTA, в котором была выявлена значительно более высокая эффективность Актемры по сравнению с Хумирой в снижении активности РА у пациентов в режиме монотерапии. Следует считать важным, что если в ряде предшествующих клинических исследований было продемонстрировано преимущество тоцилизумаба для больных РА по сравнению с МТ и/или другими БПВП, то в исследовании ADACTA показано значимо большее снижение объективных и субъективных признаков заболевания при монотерапии препаратом тоцилизумаб по сравнению с адалимумабом у взрослых пациентов с тяжелым активным РА и невозможностью продолжения терапии МТ. Данные, полученные в вышеописанном исследовании и положенные в основу нашей фармакоэкономической модели, позволили выявить наиболее предпочтительные из альтернативных режимов биологической терапии для пациентов с тяжелой формой активного РА и непереносимостью МТ или нецелесообразностью его дальнейшего применения. Несмотря на несколько большие абсолютные затраты на фармакотерапию, наиболее целесообразна стратегия терапии тоцилизумабом, применение которого позволяет достигать клинического эффекта, принципиально большего по сравнению с адалимумабом, что отражается значительно более предпочтительными показателями затратной эффективности при использовании Актемры.
В рамках нашего исследования учитывались только прямые затраты на лекарственные средства. В то же время в соответствии с данными систематического обзора фармакоэкономических исследований по РА в зарубежных странах на фармакотерапию приходится не более 35% от всех совокупных затрат [8]. Значительные расходы бюджетов на различных уровнях могут быть обусловлены непрямыми, немедицинскими затратами, напрямую связанными с эффективностью (или неэффективностью) противоревматической терапии. В связи с вышесказанным выбор наиболее эффективного препарата имеет большое значение, т.к. даже небольшой прирост положительного результата терапии может дать значительное сокращение затрат на госпитализации, социальные выплаты и иные расходы, связанные с ведением пациентов с РА.



