Синдром поликистозных яичников (СПКЯ) остается одной из самых актуальных тем в акушерстве и гинекологии, что обусловлено как высокой распространенностью этого заболевания, так и большим количеством нерешенных вопросов, связанных с патогенезом, диагностикой и лечением этого симптомокомплекса. СПКЯ встречается у 5–10% пациенток с бесплодием и более чем в 80% является причиной ановуляторного бесплодия [1]. Это сложное многофакторное заболевание с мультигенным наследованием, формирующееся под влиянием эпигенетических факторов и факторов окружающей среды.
За последние 5 лет опубликовано более 3172 статей по проблеме СПКЯ [2], большая часть из них посвящена этиологии и патогенезу этого заболевания. В распространенности СПКЯ важную роль играет этническая принадлежность. Так, в США СПКЯ встречается у 8% афроамериканцев и у 4,8% европеоидов [3]. В Греции распространенность СПКЯ составляет 6,8% [4], в Испании – 6,5% [2]. Наиболее высокая частота выявления СПКЯ характерна для мексиканцев – 13% [5], что, возможно, связано с более высокой частотой инсулинорезистентности и сахарного диабета 2 типа среди населения Мексики. Считается, что нормы андрогенов должны быть определены индивидуально, с учетом этнических различий, характерных для каждой страны и региона.
Среди факторов окружающей среды, которые могут играть роль в развитии СПКЯ, выделяют низкий социально-экономический уровень (особенно в детстве) [6] и нездоровый образ жизни (курение, переедание, отсутствие физической нагрузки). Однако основная роль в этиопатогенезе СПКЯ отводится генетическим нарушениям. В настоящее время обнаружено множество возможных генов-кандидатов в биоптатах овариальной ткани, в т.ч. соединительной ткани яичников, жировой ткани сальника, образцах сыворотки, фолликулярной жидкости, Т-лимфоцитах крови. В своей публикации в 2009 г. Z.A. Mohamed-Hussein и H. Sarahani описали 1081 ген, кодирующий 1066 известных и 15 гипотетических белков, задействованных в развитии симптомокомплекса СПКЯ [7]. Из 468 генов в предложенной авторами сети молекулярного взаимодействия при СПКЯ 339 (72,4%) оказались вовлеченными в связывание с другими белками, такими как факторы транскрипции (34), идентификационные белки (37), белки димеризации (35), рецепторы (50), белковые комплексы (13), циклины (2), ферменты (24), факторы роста (13), фоллистатины (3) и субстраты рецептора инсулина (3). Описанные авторами находки свидетельствуют о том, что к развитию того или иного комплекса симптомов ПКЯ ведет нарушение экспрессии целого множества генов, а прогрессирование заболевания в свою очередь обусловливает дальнейшее изменение использования клетками генетической информации [8]. Описана наследственная предрасположенность СПКЯ со стороны не только матери и сестер, но и мужчин – родственников пациенток с СПКЯ, у которых могут наблюдаться более раннее облысение, низкая концентрация полового стероидсвязывающего глобулина и инсулинорезистентность [9].
Помимо классической центральной теории СПКЯ, а также теории о роли инсулинорезистностности в развитии гиперандрогении появляются новые версии об этиологии этого заболевания. Получены данные о нарушении фетального программирования метаболической/эндокринной оси у плода, особенно метаболизма углеводов и секреторной функции надпочечников [10]. Показано, что у девочек с низкой массой тела при рождении, что является косвенным показателем воздействия стрессовых внутриматочных условий, в подростковом периоде СПКЯ встречается чаще [11]. Девочки с преждевременным пубархе также имеют более высокий риск развития СПКЯ [12]. Данные наблюдения позволяют предположить, что действие неблагоприятных факторов во время внутриутробного и препубертатного периодов может значительно повлиять на метаболический, гормональный и репродуктивный фенотипы женщины [13].
Хорошо изучены гормональные и метаболические нарушения при СПКЯ. Активное развитие геномики, протеомики и метаболомики показало, что дополнительную роль в патогенезе СПКЯ могут играть оксидативный стресс, хронический воспалительный процесс, регуляция иммунного ответа, гиперкоагуляция, нарушения ангиогенеза, апоптоза и обмена железа. При СПКЯ повышается выработка гепсидина, который увеличивает абсорбцию железа в кишечнике и снижает высвобождение железа из макрофагов (рис. 1). Все это приводит к избыточному накоплению железа в организме. Гемохроматоз или переизбыток железа усугубляет инсулинорезистентность, нарушает толерантность к глюкозе и способствует формированию сахарного диабета 2 типа при СПКЯ [14].
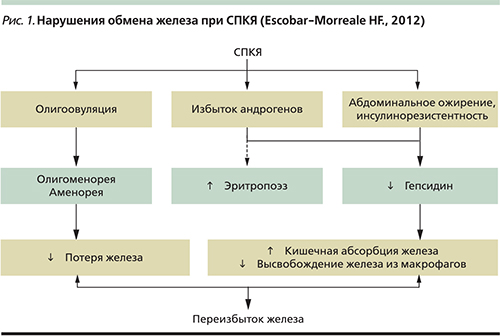
Продолжается обсуждение роли дефицита витамина Д в патогенезе СПКЯ. Этот витамин может влиять на генную транскрипцию и оказывать гормональный модулирующий эффект на обмен инсулина и регуляцию репродуктивной функции. Дефицит витамина D усиливает признаки инсулинорезистености, ожирения, гирсутизма, нарушения менструального цикла, снижает частоту наступления беременности у женщин с СПКЯ [15]. В 2015 г. была создана база данных PCOSKB [16], в которой представлена информация о 241 гене, 114 нуклеотидных полиморфизмах, 175 биохимических путях и 500 заболеваниях, связанных с СПКЯ. Тем не менее, несмотря на появление множества новых биомаркеров СПКЯ, их валидизация для использования в клинической практике требует большого количества исследований и времени, поэтому в настоящее время диагностические критерии СПКЯ остаются такими же, как и 13 лет назад, т.е. Роттердамские критерии [17], по мнению ведущих экспертов и руководств по СПКЯ, по сей день остаются актуальными. С использованием возможный комбинаций этих критериев в настоящее время определены 4 различных фенотипа СПКЯ:
- I – гиперандрогения (клиническая и биохимическая) и хроническая ановуляция;
- II – гиперандрогения и поликистоз яичников по данным УЗИ, но с овуляторными циклами;
- III – хроническая ановуляция и поликистоз яичников без гиперандрогении;
- IV – гиперандрогения, хроническая ановуляция и поликистоз яичников.
Тем не менее очевидно, что эти 4 фенотипа значимо отличаются друг от друга, и пока непонятно, являются ли они независимыми или один фенотип со временем может переходить в другой.
Активно обсуждается роль антимюллерового гормона (АМГ) как универсального маркера СПКЯ. В 2013 г. был проведен систематический обзор и мета-анализ, которые показали, что специфичность и чувствительность АМГ в диагностике СПКЯ у пациенток с симптомами составляет 79,4 и 82,8% соответственно при пороговом значении 4,7 нг/мл [18]. Однако методологические проблемы анализов сывороточного AMГ пока не позволяют использовать эти цифры в качестве единого диагностического порога и этот маркер не является патогномоничным маркером СПКЯ, а остается предиктором ответа яичников на стимуляцию. Согласно рекомендациям Эндокринного общества США, исключение могут составлять девочки-подростки, выполнение ультразвукового исследования которых может быть затруднено, четкие пороговые уровни нормы андрогенов в пубертатном периоде не установлены и показатели АМГ могут помочь в постановке диагноза. При этом даже при наличии ультразвуковых признаков ПКЯ сохраняются споры относительно того, что считать нормой, а что – патологией в подростковом периоде, т.к. инсулинорезистентность, гиперандрогения и увеличенные яичники с большим количеством мелких фолликулов могут представлять нормальный этап становления репродуктивной системы у девочки [19]. Пока, согласно Амстердамскому консенсусу, диагноз СПКЯ для подростков выставляется при наличии всех трех роттердамских критериев [19].
Согласно рекомендациям Эндок-ринного общества, при СПКЯ оправданно более раннее назначение комбинированных оральных контрацептивов (КОК) девочкам с преждевременным пубархе. При наличии клинических и биохимических признаков гиперандрогении и преждевременного полового созревания (например, стадия развития молочных желез ≥IV по шкале Таннера) лечение начинают еще до наступления менархе.
В репродуктивном периоде лечение зависит от симптомокомплекса нарушений, которые присутствуют у конкретной пациентки, и от ее репродуктивных планов [19]. Если пациентка не планирует беременность, то, согласно Амстердамскому консенсусу, пациентки с СПКЯ должны получать КОК, т.к. естественное течение СПКЯ может сопровождаться усугублением гиперандрогении и инсулинорезистентности, а современные КОК оказывают нейтральное или положительное влияние на углеводный обмен и позволяют хотя бы временно снижать выработку яичниковых и надпочечниковых андрогенов. КОК относится к терапии 1-й линии при гирсутизме/акне и нарушениях менструального цикла [20].
В рекомендациях Эндокринного общества приводится ряд доказательств в пользу пролонгированного режима использования гормональных контрацептивов (по сравнению с циклическим режимом), поскольку отмечается более выраженное гормональное ингибирование, противодействующее активации функции яичников во время безгормонального интервала [21].
Интересно, что, несмотря на наличие большого количество исследований, изучающих влияние гормональных контрацептивов на концентрацию андрогенов при СПКЯ, первый систематический обзор и мета-анализ этих данных были проведены только в 2014 г. [22]. Он подтвердил, что прием КОК сопровождается снижением общего тестостерона, увеличением выработки полового стероидсвязывающего глобулина и еще большим снижением концентрации свободного тестостерона.
При выборе контрацептива помимо его антиандрогенных свойств следует также учитывать профиль безопасности. Известно, что даже при нормальной массе тела СПКЯ может сопровождаться инсулинорезистентостью, поэтому важно учитывать влияние компонентов контрацептива на показатели углеводного обмена. В исследовании M. Guido и соавт. оценивали влияния приема контрацептива с хромадинона ацетатом (Белара) в течение 6 месяцев на показатели глюкозотолерантного теста и эугликемического-гиперинсулинемического клэмп-теста («золотого» стандарта в диагностике инсулинорезистентности) и не выявили негативного влияния на метаболизм глюкозы и инсулина [23]. В работе R. Uras и соавт. также не было выявлено негативного влияния контрацептива с хлормадинона ацетатом на показатели инсулина и глюкозы [24].
С учетом новых данных о роли хронического воспалительного процесса и эндотелиальной дисфункции в патогенезе СПКЯ и его осложнениях появляются работы о влиянии контрацептивов на эти показатели. В овуляторном цикле эстрадиол в фолликулярную фазу цикла стимулирует продукцию интерлейкина 6, а затем в лютеиновую фазу прогестерон подавляет выработку этого воспалительного цитокина [25]. При хронической ановуляции и СПКЯ низкая концентрация прогестерона может сопровождаться избыточной активностью иммунной системы и даже приводить к аутоиммунным нарушениям [26]. КОК содержат гестагены, которые при ежедневном поступлении снижают экспрессию провоспалительных цитокинов [27]. Также было показано, что применение дроспиренонсодержащего контрацептива (Мидиана) в комбинации с метформином в течение 6 месяцев сопровождается нейтральным и умеренно положительным эффектами на уровень С-реактивного белка, углеводный и жировой обмен и на эндотелиальную функцию [28], а КОК, содержащий этинилэстрадиол и хлормадинона ацетат (Белара), снижает концентрацию матриксной металлопротиназы-2 в крови, уменьшая риск сердечно-сосудистых осложнений.
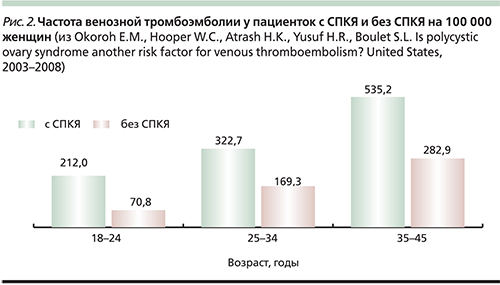
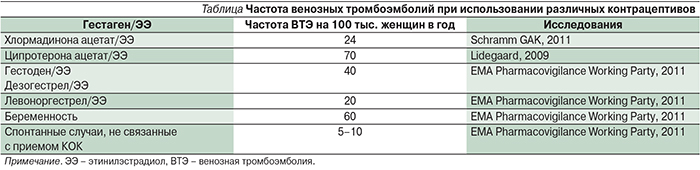
Дополнительным преимуществом является онкопротективный эффект контрацептивов. Хорошо известно, что СПКЯ сопровождается повышением риска рака эндометрия. Мета-анализ, проведенный в 2014 г., показал почти трехкратное повышение риска рака эндометрия у женщин с СПКЯ моложе 54 лет по сравнению с общей популяцией [29]. При использовании КОК в течение 1 года риск рака эндометрия снижается вдвое, а протективный эффект сохраняется в течение 20 лет [30]. Однако следует помнить, что риск венозных тромбоэмболий у пациенток с СПКЯ выше популяционного (рис. 2) [31], поэтому при выборе контрацептива предпочтение следует отдавать антиандрогенным препаратам с наименьшим риском тромботических осложнений (см. таблицу).
Крупное (62 тыс. женщин) европейское многоцентровое исследование показало, что при приеме контрацептива, содержащего хлормадинон ацетат (Белара), риск венозной тромбоэмболии минимален и сопоставим со спонтанным общепопуляционным риском у женщин, не принимающих гормональные контрацептивы [32].
Если пациентка планирует беременность, то контрацептивы отменяют и оценивают овуляторность цикла. По данным исследований, после отмены КОК у 42,4% пациенток с СПКЯ возобновляется регулярный менструальный цикл [30]. Если ребаунд-эффект после отмены отсутствует и сохраняется хроническая ановуляция, то планируют индукцию овуляции. При наличии ожирения у всех пациенток с СПКЯ оценивается индекс массы тела, артериальное давление и проводится глюкозотолерантный тест перед беременностью. При наличии инсулинорезистентности показана терапия метформином.
Согласно всем последним рекомендациям, терапией первой линии остается кломифена цитрат (КЦ) [33], хотя появляется все больше данных о более высокой эффективности летрозола в непрямой индукции овуляции и, возможно, после получения достаточного количества доказательств относительно безопасности в ближайшем времени он займет место КЦ в терапии первой линии при лечении бесплодия при СПКЯ. Так, частота овуляции при использовании летрозола составляет 61,7% (а при использовании КЦ – 48,3% (p<0,0001); частота родов живым плодом – 27,5% (при использовании КЦ – 19,2% [p=0,007]) и у пациенток с высоким индексом массы тела и длительным анамнезом бесплодия частота родов живым плодом на 44% выше [34].
Интересен подход некоторых исследователей к повторным циклам непрямой индукции овуляции в отсутствие ответа в первом цикле стимуляции. Они предлагают повторять стимуляцию в том же цикле, не дожидаясь менструальноподобной реакции, просто увеличив дозу КЦ [35]. По их данным, это сокращает продолжительность лечения и повышает его эффективность в 3 раза. Другие авторы предлагают начинать непрямую индукцию овуляции КЦ на фоне хронической ановуляции сразу же, не вызывая менструальноподобной реакции гестагенами. Частота родов живым плодом в расчете на овуляцию составила 5,4% при предварительном использовании гестагенов для обеспечения менструальноподобной реакции и 19,7% при начале стимуляции на фоне хронической ановуляции (p<0,001) [36].
Известно, что беременность при СПКЯ сопровождается повышенным риском потери плода, что связывают с неблагоприятным влиянием ожирения и инсулинорезистентности, исходно повышенной выработкой андрогенов, которая еще больше увеличивается на ранних сроках беременности, гипероагуляцией, снижением выработки АМФ-α-2 микроглобулина фертильности (гликоделина) в эндометрии, повышением индекса резистентности в маточных артериях [37]. Эти механизмы также ответственны и за нарушения фолликулогенеза и имплантации еще на этапе терапии бесплодия, поэтому подготовке к беременности при СПКЯ уделяется большое внимание. Очевидной является необходимость снижения массы тела и коррекции метаболических нарушений при сопутствующем ожирении, однако интересно, что рандомизированных исследований на эту тему до сих пор не так много и в 2015 г. ведущие эксперты в области СПКЯ продолжили работу по оценке влияния модификации образа жизни как этапа периконцепционной подготовки при СПКЯ с избыточной массой тела или ожирением (ИМТ – 27–42 кг/м2) [38]. Авторы разделили участниц исследования на 3 группы: в первой группе пациентки принимали только КОК, во второй была ограничена суточная калорийность пищи, повышена физическая активность, при необходимости добавлялись препараты для снижения массы тела (орлистат или сибутрамин), чтобы добиться снижения массы тела на 7%, а в третье группе комбинировали прием КОК с модификацией образа жизни. После такой подготовки в течение 16 недель проводилась стандартная индукция овуляции КЦ и программируемое зачатие в дни овуляции в течение четырех циклов подряд. Во второй и третьей группах наблюдалось значимое снижение массы тела. Кумулятивная частота овуляции в группе КОК составила 46%, в группе «Модификация образа жизни» – 60%, а в группе «КОК+модификация образа жизни» – 67% (р<0,05). Частота родов живым плодом составила 12, 26 и 24% соответственно (различия были незначимыми, р=0,13).
При неэффективности непрямой индукции овуляции переходят к стимуляции овуляции гонадотропинами, которые относят ко второй линии терапии бесплодия при СПКЯ. По данным S. Palomba и соавт. терапия оральными контрацептивами у пациенток с хронической ановуляцией и СПКЯ перед индукцией овуляции гонадотропинами повышает частоту моноовуляторных циклов и снижает продолжительность стимуляции, а также суммарную дозу гонадотропинов. Количество доминантных фолликулов и пиковая концентрация эстрадиола были ниже, что снижало частоту отмены цикла из-за множественного роста фолликулов и риска развития синдрома гиперстимуляции яичников. Влияния на частоту наступления беременности и родов живым плодом не наблюдалось [39].
В Кокрановском обзоре 2015 г. опубликованы данные по сравнению эффективности и безопасности гонадотропинов в индукции овуляции у кломифенрезистентных пациенток с СПКЯ. Средняя частота родов живым плодом при использовании мочевого фоликулостимулирующего гормона составила 16%, рекомбинантного фоликулостимулирующего гормона варьировалась от 13 до 26%, а при использовании человеческого менопаузального гонадотропина – 18%, различия были статистически незначимыми как по эффективности, так и по безопасности (риску развития синдрома гиперстимуляции яичников) [40].
Вопрос о применении метформина в схемах восстановления овуляторных менструальных циклов у женщин с синдромом хронической ановуляции остается дискутабельным [41].
В настоящее время применение метформина при хронической ановуляции у пациентки может быть использовано только при наличии у нее нарушений углеводного обмена (ESHRE/ARSM 2013) [19].
Лапароскопический дриллинг также относится к терапии второй линии при СПКЯ [33]. В Кокрановком обзоре 2012 г. сравнивали эффективность и безопасность лапароскопического дриллинга в индукции овуляции с лекарственными препаратами, используемыми с той же целью. Частота родов живым плодом в группе дриллинга составила 34%, при использовании других препаратов – 38% (различия были незначимыми). Единственным преимуществом было снижение частоты многоплодной беременности. Показано, что дриллинг более чем в 8 точках может сопровождаться повышенным риском образования спаек и снижением овариального резерва [42]. Однако экспертные оценки, проведенные по всей территории РФ, показали сравнительно меньший результат по восстановлению фертильности после выполнения лапароскопических операций на тканях яичника у женщин с СПКЯ по сравнению с методами вспомогательных репродуктивных технологий [43]. В литературе ведется постоянная дискуссия о сравнительных достоинствах оперативного лечения и индукции овуляции методами экстракорпорального оплодотворения (ЭКО) и переноса эмбриона (ПЭ) при СПКЯ, авторы сравнивают частоту наступления беременности, стоимость процедуры, оценивают психологический стресс [44].
Тем не менее лечение с применением методов ЭКО и ПЭ остается терапией третьей линии [33]. Согласно российскому законодательству, показанием к лечению методами вспомогательных репродуктивных технологий является бесплодие, не поддающееся лечению, в т.ч. с использованием методов эндоскопической и гормональной коррекции нарушений репродуктивной функции мужчины и женщины в течение 9–12 месяцев с момента установления диагноза и заболевания, при которых наступление беременности невозможно без использования ЭКО [44].
Считается, что перед проведением программы ЭКО при СПКЯ необходим предварительный этап подготовки, направленный на снижение массы тела, нормализацию толерантности к глюкозе, снижение концентрации тестостерона в плазме крови. Возможно назначение КОК для подавления лютеинезирующего гормона перед началом индукции суперовуляции, особенно при его исходно высоких показателях (более 20–25 МЕ/мл) [46]. Исследование, проведенное группой авторов в 2015 г. с участием 1065 пациенток, показало, что СПКЯ сопровождается более низкой частотой имплантации, частотой наступления беременности и более высоким риском невынашивания беременности. Использование контрацептивов в циклическом или непрерывном режиме перед началом индукции суперовуляции повышает частоту имплантации и частоту наступления беременности, что авторы связывают со снижением числа антральных фолликулов и коррекцией гиперандрогении перед началом стимуляции [47].
В более раннем исследовании по оценке влияния КОК на исходы ЭКО при СПКЯ было показано, что использование КОК снижает риск образования функциональных кист перед началом стимуляции (р<0,05), способствует синхронизации когорты фолликулов, повышает процент зрелых ооцитов, р<0,05, но не влияет на частоту клинической беременности и не снижает риск развития синдрома гиперстимуляции яичников [48].
Учитывая тот факт, что использование КОК перед индукцией суперовуляции в программе ЭКО может сопровождаться увеличением продолжительности стимуляции и большей суммарной дозой гонадотропинов, рекомендуется начинать стимуляцию через 5–6 дней после последней таблетки контрацептива [49]. Анализ 238 генов рецептивности эндометрия, полученного через 7 дней после введения триггера овуляции (человеческого хорионического гонадотропина), показал отсутствие негативного влияния КОК при приеме в течение 12–16 дней и началом стимуляции через 5 дней [50]. Доказано, что добавление метформина в программе ЭКО может снижать риск развития синдрома гиперстимуляции яичников и даже повышать частоту наступления беременности, однако, согласно данным последнего Кокрановского обзора 2014 г., его использование не повышает частоту родов живым плодом [51].
Основным методом снижения риска развития тяжелых форм СГЯ в стандартных программах ЭКО является использование низких доз гонадотропинов в протоколе с антагонистами гонадотропин-релизинг-гормона с использованием в качестве триггера овуляции его агониста и криоконсервацией всех эмбрионов, т.е. отменой переноса эмбрионов в свежем цикле. Дополнительное использование каберголина со дня введения триггера и назначение антагонистов гонадотропин-релизинг-гормона после пункции фолликулов также снижают риск развития синдрома гиперстимуляции яичников [52]. Использование такой технологии, как IVM (in vitro maturation), позволяет полностью избежать синдрома гиперстимуляции яичников [53], однако этот метод остается инновационным и используется пока не во всех клиниках. Опубликованы работы о том, что предварительная подготовка пациенток с СПКЯ к IVM с помощью КОК и метформина позволяет снижать частоту невынашивания и повышать частоту родов живым плодом до 37,7% [54].
Таким образом, постепенно меняются представления об этиологии и патогенезе СПКЯ, появляются новые подходы к диагностике и лечению и, возможно, в будущем на основании генетических исследований и определения биомаркеров можно будет проводить более точную диагностику СПКЯ у каждой конкретной пациентки, оценивать ее индивидуальные риски, прогнозировать ответ на лечение и подбирать персональную терапию.



