Тромболитическая терапия (ТЛТ) признана одним из 10 величайших достижений кардиологии XX в. [1]. Несмотря на внедрение первичной коронарной ангиопластики при остром инфаркте миокарда, тромболизис не теряет своего значения с учетом логистических особенностей нашей страны с большими расстояниями до специализированных инвазивных центров. Напротив, масса больных до сих пор остаются вообще без реперфузионных вмешательств, поэтому проблема внедрения тромболизиса продолжает оставаться актуальной для отечественного здравоохранения.
Некоторые исторические аспекты
В 1933 г. W. Tillet и соавт. обнаружили свойство стрептококковых культур лизировать кровяной сгусток. Это была группа А β-гемолитического стрептококка, продуцирующая некую «фибринолитическую» субстанцию, которую авторы назвали «стрептококковый фибринолизин» [2]. В 1945 г. L.R. Christensen показал, что в плазме крови человека находится фермент плазминоген, который под действием стрептококкового фибринолизина, названного им стрептокиназой (СК), превращается в активный фибринолитический фермент плазмин [3].
В 1948 г. S. Sherry и соавт. сообщили о первом опыте применения СК в клинике для лизиса гнойного плеврального экссудата, содержащего фибриновые пленки [4]. В 1958 г. A.P. Fletcher и соавт. опубликовали сообщение о первом внутривенном введении СК больным инфарктом миокарда [5]. Впервые было показано, что применение СК этими больными может снижать летальность, поэтому это является перспективным подходом к лечению больных острым инфарктом миокарда (ОИМ).
Параллельно были попытки использовать не активатор плазминогена, а уже активированный плазмин [6]. Отечественные ученые под руководством Г.В. Андреенко и Б.А. Кудряшова в 1961 г. создали аналогичный препарат под названием «Фибринолизин», который долго использовался в клинической практике [7]. Выше представлен «генеральный» путь развития тромболитической терапии. Естественно, были и «тупиковые» направления на этом пути. В частности, параллельно с исследованием СК в качестве тромболитика группой I. Innerfield активно изучался трипсин [8]. В исследованиях на животных (кроликах и собаках) была показана тромболитическая эффективность трипсина при внутривенном введении. При этом наблюдалось значительное уменьшение концентрации фибриногена в крови и увеличивалось протромбиновое время. Кроме тромболитического был обнаружен выраженный противовоспалительный эффект. После этого проведены клинические испытания на больных различными заболеваниями: тромбофлебиты, артриты, инсульты, коронарный тромбоз. Тромболизис трипсином был проведен 538 пациентам (!) [9]. В т.ч. были 7 больных с клиникой острого коронарного синдрома, 3 из них – с ОИМ. Среди этих больных один умер, у остальных отмечено значительное улучшение состояния, которое сопровождалось снижением частоты приступов стенокардии, положительными изменениями на ЭКГ и биохимических параметров. Таким образом, первое введение тромболитика больным ОИМ было проведено в 1952 г. группой I. Innerfield. С учетом большой частоты побочных эффектов, особенно при быстром введении, что требуется при ОИМ, трипсин проиграл в сравнении со СК и в настоящее время в качестве тромболитика не используется.
Классификация тромболитических агентов
По механизму действия все тромболитические средства можно разделить на 3 группы [10]:
Прямые фибринолитики, которые непосредственно разрушают молекулу фибрина. К ним относятся основной естественный фермент тромболитической системы человека плазмин, его лекарственная форма фибринолизин и некоторые грибковые протеазы.
Активаторы плазминогена: СК, стафилокиназа, тканевой активатор плазминогена и активатор плазминогена урокиназного типа.
Непрямые фибринолитики.
Вещества третьей группы не вызывают непосредственной активации плазминогена и не оказывают прямого лизирующего воздействия на фибрин. Они усиливают фибринолиз относительно мягко – путем следующих механизмов:
- повышения биосинтеза плазминогена или его активаторов (анаболические стероиды, никотиновая кислота);
- усиления высвобождения активаторов плазминогена из тканей (гистамин, брадикинин, гепарин, простагландины);
- инактивации естественных ингибиторов фибринолиза;
- специфических антител, солей тяжелых металлов;
- изменения структуры фибриногена или фибрина (Арвин или Анкрод, дефибраза, фибринспецифические антитела).
Из препаратов первой группы в клинической практике использовался только фибринолизин. Выдающимся достижением отечественной кардиологии стало внутрикоронарное введение фибринолизина при ОИМ, которое впервые в мире 5 июня 1975 г. выполнили кардиологи под руководством Е.И. Чазова [11]. В настоящее время в результате появления новых более эффективных препаратов фибринолизин утратил свое значение.
Непрямые фибринолитики активируют фибринолиз достаточно слабо и поэтому в качестве тромболитиков, тем более при остром тромбозе, не используются. Широко применяется только гепарин, но не как активатор фибринолиза, а как антикоагулянт. Для проведения лекарственного тромболизиса при инфаркте миокарда в настоящее время используются только активаторы плазминогена.
Активаторы плазминогена в свою очередь делятся на тромболитики:
- 1-го поколения (фибриннеспецифичные: СК и УК);
- 2-го поколения (фибринспецифичные: алтеплаза, проурокиназа, рекомбинантная стафилокиназа);
- 3-го поколения (генномодифицированные: тенектеплаза, Пуролаза, Фортелизин).
СК: начало многоцентровых клинических исследований
Первым из этих препаратов считается СК. СК образует комплекс с плазмином, молекула которого при этом изменяется и обнажается его активный центр. Комплекс СК–плазминоген играет роль фермента в дальнейшем превращении плазминогена в плазмин, причем он активирует как связанные с фибрином, так и свободно циркулирующие молекулы плазминогена. Как следствие – плазмин лизирует не только фибрин, но и фибриноген, циркулирующий в крови, чем и объясняется снижение фибриногена на фоне тромболизиса. СК антигенна, поэтому титры антистрептокиназных антител быстро нарастают в течение нескольких дней после введения препарата, делая неэффективным и небезопасным его повторное применение.
Самым частым побочным эффектом/осложнением СК является гипотония: снижение систолического артериального давления до 80 мм рт.ст. и ниже наблюдается у 30–40% пациентов [12]. Эта гипотония не является проявлением аллергической реакции, тем более анафилаксии, как это иногда объясняется. СК – это неспецифический тромболитик. Параллельно с превращением плазминогена в плазмин происходит активация калликреин-кининовой системы, превращение брадикининогена в брадикинин, который и снижает АД [13, 14]. Брадикинин полностью исчезает при однократном прохождении через легочное русло, поэтому этот гипотензивный эффект кратковременный и не представляет опасности для жизни пациента. Для его купирования вводят небольшие дозы мезатона или «почечные» дозы допамина в виде инфузии.
Напротив, существует мнение, будто снижение АД является маркером эффективности ТЛТ. Чем более эффективна ТЛТ, тем больше образуется не только плазмина, но и брадикинина, тем сильнее должно снижаться АД, хотя статистически это не подтверждено.
В 1960–1970‑х гг. проведены исследования по подбору оптимальных доз и режимов введения СК. Наиболее распространенный, «классический», метод введения СК был предложен в 1981 г. R. Schroder и соавт. и заключается во внутривенной инфузии 1,5 млн ЕД СК за 60 минут [15]. Именно так проводился тромболизис в большинстве исследований. В начале 1980‑х гг.
было проведено первое многоцентровое исследование эффективности тромболизиса при ОИМ, известное как GISSI-1 [16]. В это итальянское исследование были включены 11 806 больных ОИМ, половине из которых в течение первых 12 часов заболевания было введено 1,5 млн ЕД СК в течение часа. Конечной точкой исследования стала летальность.
Впервые было показано, что:
Применение тромболизиса снижает летальность при ОИМ.
Эффективность тромболизиса зависит от промежутка времени между началом заболевания и введением СК. При начале терапии в первый час заболевания, в первые 2–3 и 3–6 часов летальность составила соответственно 8,2, 9,2 и 11,7% против 14,1% в контрольной группе без ТЛТ. Выходит, чем раньше начинается ТЛТ, тем выше ее эффективность.
Эти выводы принципиально были подтверждены в исследовании ISIS-2 [17]. Более 17 тыс. больных были рандомизированы в 4 группы: СК, аспирина, СК+аспирин и контрольную. Оказалось, что 5-недельная летальность в группе СК снизилась на 25%, в группе аспирина – на 23%, в группе СК+аспирин – на 42%. Т.е. дополнительно к подтверждению эффективности СК была продемонстрирована высокая эффективность аспирина. Результаты вышеперечисленных исследований стали доказательной основой современной стратегии лечения ОИМ: как можно раньше назначать ТЛТ, аспирин и гепарин.
Проведенный мета-анализ результатов исследований с ангиографическим контролем показал, что при введении СК частота реперфузии коронарной артерии (КА) составляет на 60 минут лечения в среднем 44%, на 90 – 48%, через 3 часа – 72%, а от 24 часов до 21 суток – от 75 до 85%, что статистически значимо выше, чем в контрольной группе без тромболизиса [18].
СК или алтеплаза?
Тканевой активатор плазминогена (ТАП), выделенный в начале 1980 гг., – это белок, который синтезируется эндотелиальными клетками сосудов. В отличие от СК, активирующая плазменный плазмингоген, вызывая системное литическое состояние, ТАП переводит тканевой плазминоген в активный тромбин только в присутствии фибрина. Таким образом, он является фибриноспецифичным и не обладает выраженным системным действием, хотя при увеличении дозы препарата эта фибриноспецифичность исчезает. Во время тромболизиса ТАП происходит активная выработка тромбина, что определяет обязательную необходимость комбинировать ТАП с внутривенным введением гепарина. ДНК-рекомбинантным методом был создан промышленный продукт – алтеплаза. В отличие от СК он имеет короткий период инактивации. Период его полураспада составляет 4–8 минут, что требует продолжительного введения для поддержания терапевтической концентрации в крови. При первых испытаниях алтеплазы для лечения ОИМ ее назначали в общей дозе 150 мг в течение 3 часов, затем схему поменяли на 100 мг за 90 минут.
В 1980‑1990-х гг. проводились сравнительные исследования СК и алтеплазы. В нескольких исследованиях с ангиографическим контролем было показано, что 3-часовая инфузия алтеплазы достоверно чаще вызывает реперфузию КА на 60 и 90 минут тромболизиса по сравнению с СК [19]. С учетом важного значения скорости реперфузии КА логично было ожидать снижения летальности в группах с алтеплазой, но в исследованиях TIMI-1 (290 больных), GISSI-2 (10372 пациента), ISSIS-3 (41 299 больных) не было обнаружено достоверного различия в летальности между группами СК и алтеплазы. И только в исследовании GUSTO-I, в которое включен 41 021 больной, показано, что ускоренный режим введения алтеплазы (100 мг за 90 минут) позволил уменьшить 30-дневную летальность по сравнению с СК: 6,3 против 7,2% соответственно (р=0,001), т.е. на 0,9% [20]. Казалось бы, преимущество алтеплазы доказано.
Но такая однозначная оценка результатов ограничена следующими обстоятельствами:
Достоверное различие в смертности наблюдалось только среди больных, которые лечились в США. В других странах такого различия не было [21].
В группе алтеплазы развилось больше инвалидизирующих инсультов: 0,72 против 0,54% (р=0,03). При этом комбинированная конечная точка (смерть+инсульт) в группе алтеплазы все-таки осталась ниже: 6,9 против 7,8% (р=0,006). Повышение частоты геморрагических инсультов при применении фибриноспецифических препаратов ТАП по сравнению с СК отмечено также в более позднем мета-анализе [22].
В рамках исследования GUSTO-I проведено подисследование: 2431 больным выполнялась ангиография. Оказалось, что эффективный кровоток (по ТIMI 2–3) в КА к 90 минам от начала ТЛТ в группе алтеплазы был достигнут в 81% случаев, а в группе СК – только в 60%. Но через 3 часа различия по этому показателю уже не определялось: 74 и 76% соответственно [23]. Таким образом, СК и алтеплаза одинаково часто открывают КА, но алтеплаза делает это чуть быстрее.
В исследовании GUSTO-I изучалось соотношение стоимость/эффективность тромболизиса алтеплазой по сравнению с СК. Один год спасенной жизни больного в результате проведения тромболизиса не СК, а алтеплазой «стоит» 32,678 долл. США [24]. Это соотношение более эффективно/выгодно при передних инфарктах миокарда и менее эффективно при нижних.
Таким образом, к недостаткам алтеплазы по сравнению с СК относятся высокий риск кровоизлияния в мозг, обязательная необходимость параллельной инфузии гепарина и высокая стоимость. Поэтому при выборе алтеплазы для тромболитической терапии необходимо учитывать не только ее достоинства, но и недостатки.
Тенектеплаза – препарат для болюсного введения
Для улучшения фибринолитических характеристик препарата методом генной инженерии были созданы модификации молекулы ТАП: ретеплаза (рекомбинантный активатор плазминогена, r-PA), ланотеплаза (n-PA) и тенектеплаза (TNK-tPA). Наиболее удачный из них – препарат тенектеплаза (Метализе). Это молекула с более продолжительным плазменным периодом полувыведения, повышенной специфичностью к фибрину и большей устойчивостью к ингибитору первого типа активатора плазминогена (PAI-1) по сравнению с естественным ТАП, поэтому несомненным преимуществом тенектеплазы является возможность ее однократного болюсного введения. В исследовании ASSENT-1 была определена наиболее оптимальная доза этого препарата: 30–50 мг в зависимости от веса пациента [25].
С использованием этой дозы в исследовании ASSENT-2 проведено сравнение алтеплазы и тенектеплазы. Хотя частота нецеребральных кровоизлияний и необходимости гемотрансфузий была несколько меньше в группе тенектеплазы, чем алтеплазы, – 26,4 против 28,9% (p=0,0003) и 4,2 против 5,5% (p=0,0002) соответственно, смертность в течение 30 суток в обеих группах не различалась: 6,18 и 6,15% в группе тенектеплазы и алтеплазы соответственно. Частота геморрагических инсультов также не различалась и составила соответственно 1,78 и 1,66%. Был сделан вывод об одинаковой терапевтической эфективности обоих препаратов, но отмечена более простая методика применения нового тромболитика [26].
Таким образом, преимуществом тромболитиков 3-го поколения группы ТАП (тенектеплаза) является не более высокая клиническая эффективность и безопасность, а удобство, простота в применении. Поэтому именно этот препарат позиционируется как единственный специальный тромболитик для догоспитального этапа.
Многоцентровых сравнительных исследований стрептокиназы и тенектеплазы не было. Мы провели одноцентровое сравнительное исследование этих препаратов при их введении на догоспитальном этапе [27]. Частота реперфузии через 90 минут по ЭКГ-признакам оказалась выше в группе тенектеплазы: 64 против 48% (р<0,05). Исходя из результатов субисследования GUSTO-1 с ангиографическим контролем, можно предполагать, что через 3 часа частота реперфузии была бы одинаковой, но, согласно рекомендациям, при неэффективном тромболизисе через 90 минут в обеих группах проведено спасительное чрескожное коронарное вмешательство. Поэтому летальность между группами не различалась.
Урокиназа, проурокиназа и отечественная Пуролаза
Как следует из названия препарата, урокиназа (УК) вырабатывается клетками почечной ткани. Ее выделяют или из мочи здоровых молодых людей, из клеточной культуры почки человека, или методом генной инженерии. УК, как и СК, является фибринонеспецифичным тромболитиком, т.е. активирует плазминоген, как адсорбированный на фибрине, так и циркулирующий в кровотоке, в результате расщепляется не только фибрин, но и фибриноген, что обусловливает развитие системного литического состояния. В отличие от СК УК непосредственно превращает плазминоген крови в плазмин. Период полураспада УК составляет 9–16 минут. Большим преимуществом УК перед СК является отсутствие к ней антител, т.е. ее неаллергенность. Урокиназа представляет собой смесь двух форм препарата: высокомолекулярной (54 тыс. дальтон) и низкомолекулярной (33 тыс. дальтон). Высокомолекулярная форма состоит из двух цепей: тяжелой и легкой; активный центр протеиназы расположен в тяжелой цепи. Низкомолекулярная УК, являясь продуктом расщепления высокомолекулярной, состоит преимущественно из тяжелой цепи. Несмотря на эти различия, их фармакологические (тромболитические) эффекты примерно равнозначны [10].
В 1979 г. была выделена еще одна форма УК. Она имеет молекулярную массу, аналогичную высокомолекулярной УК, но отличается от нее следующими свойствами: 1) имеет одноцепочечную структуру; 2) проявляет сродство к фибрину. Эта форма УК была названа проурокиназой. Большинство клинических работ с УК посвящено ее применению при тромбоэмболиях легочной артерии и периферических тромбозах. В настоящее время для лечения инфаркта миокарда она практически не используется, вероятно, в результате того, что она не имеет реальных преимуществ перед СК, кроме отсутствия антигенности, а стоимость ее на порядок выше, чем у СК.
В отличие от УК проурокиназа шире исследовалась и используется для лечения инфаркта миокарда. За рубежом наиболее известна была проурокиназа под торговым названием «Саруплаза» (scu‑PA), но при ее сравнении с СК (исследования PRIMI и COMPASS) Саруплаза при сопоставимой эффективности увеличила частоту внутричерепных геморрагий. Также Саруплаза не показала преимуществ при сравнении с алтеплазой (исследование SESAM). Поэтому в настоящее время этот препарат не используется в клинической практике.
В лаборатории генной инженерии Российского кардиологического научно-производственного комплекса Минздрава России была получена модифицированная молекула нативной проурокиназы Пуролаза. Результатом изменения аминокислотной последовательности стало удлинение периода полувыведения препарата в 3 раза: с 9 до 30 минут. Проведено российское многоцентровое исследование Пуролазы при ОИМ [28]. В исследование были включены 237 больных ОИМ в первые 6 часов заболевания. Через 3 часа от начала терапии коронарная реперфузия по косвенным признакам была достигнута у 176 (74%) больных. Частота геморрагического инсульта составила 0,4%, летальность на 30-й день – 7%. Рандомизированной группы контроля с другим тромболитиком в этом исследовании не было.
Несмотря на то что Пуролаза обладает фибриноспецифичностью, при ее введении отмечаются признаки системного фибринолиза: достоверное снижение уровня фибриногена (у 28% больных <1,0 г/л) и α2-антиплазмина. По-видимому, эти явления связаны с образованием двухцепочечной формы молекулы, лишенной фибриноспецифичности.

Стафилокиназа и отечественный Фортелизин
Стафилокиназа – белок, секретируемый некоторыми штаммами Staphylococcus aureus, который, как и СК, является непрямым активатором плазминогена. В настоящее время стафилокиназу получают ДНК-рекомбинантным методом, что определяет ее высокую стоимость по сравнению с СК. В 1990 гг. было проведено несколько небольших исследований по сравнительной эффективности разных доз стафилокиназы (от 10 до 30 г) и алтеплазы. Частота реперфузии КА в группе стафилокиназы составила от 50 до 74% при разных дозах и режимах введения, что оказалось не хуже, чем в группах алтеплазы. При этом было обнаружено, что стафилокиназа является более фибринспецифичным тромболитиком, т.к. в отличие от алтеплазы, после введения которой уровень фибриногена все-таки снижался, после введения стафилокиназы такого снижения не было [29–31].
Недостатком стафилокиназы по сравнению с алтеплазой является ее аллергенность. Поэтому сразу встал вопрос о преодолении этого недостатка. Последняя разработка в этом направлении – это создание отечественными учеными генномодифицированной неимуногенной стафилокиназы под названием «Фортелизин». Было проведено небольшое рандомизированное исследование по сравнению Фортелизина 15 мг, вводимого в течение 30 минут (или двумя болюсами или болюс+инфузия), и алтеплазы. Частота реперфузии КА по косвенным признакам на 90-й минуте от начала тромболизиса была абсолютно одинаковой в группах Фортелизина и алтеплазы: 85% [32]. Это исследование справедливо критикуется за очень небольшое число больных: в группе Фортелизина обследован всего 41 больной.
В настоящее время Фортелизин зарегистрирован как лекарственный препарат для медицинского применения и даже вошел в список жизненно важных лекарств. Для мониторинга эффективности и безопасности препарата был организован регистр для сбора этой информации. К осени 2014 г. тромболизис Фортелизином получили 675 больных ОИМ, частота реперфузии КА по ЭКГ-критериям в виде снижения сегмента ST≥50% составила 74%, летальность в течение 30 дней – 4,4%, геморрагический инсульт развился у 3 пациентов, что составило 0,44% [33]. При этом не представлена методика сбора этой информации и клинико-анамнестическая характеристика больных.
Проблема выбора препарата
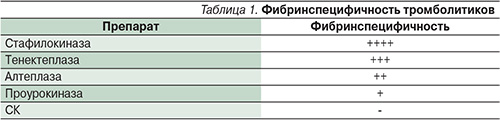
Таким образом, на отечественном рынке присутствует 5 тромболитиков для лечения инфаркта миокарда: СК, алтеплаза, тенектеплаза, Пуролаза (генномодифицированная проурокиназа) и Фортелизин (генномодифицированная неимунногенная стафилокиназа). В отличие от остальных препаратов СК является фибриннеспецифичным тромболитиком. Обычно фибриннеспецифичность рассматривается как недостаток препарата. Целью тромболизиса является растворение тромба, а не снижение уровня фибриногена. Логично было бы ожидать, что сохраняющие уровень фибриногена фибринспецифичные тромболитики должны уменьшать частоту геморрагических осложнений, но, напротив, препараты ТАП – алтеплаза и тенектеплаза – по сравнению с СК увеличивают частоту самого тяжелого осложнения – интракраниального кровотечения [20, 22]. Кроме этого снижение уровня фибриногена как самого крупного белка плазмы улучшает реологические свойства крови на несколько часов обеспечивает развитие «системного литического состояния», что, возможно, и приводит к незначительному уменьшению частоты рецидивов заболевания. Поэтому однозначно оценить пользу фибринспецифичности тромболитиков – препаратов ТАП – не представляется возможным. Как показано в табл. 1, наиболее фибринспецифичным препаратом является стафилокиназа [34], но, как это реализуется в клиническую эффективность, пока не понятно.
Исходя из того что алтеплаза является более эффективным, чем СК, тромболитиком, быстрее открывает КА, но при этом чаще вызывает интракраниальные кровотечения, в литературе предложен дифференцированный подход к назначению этих препаратов [35]. Согласно ему, алтеплаза более показана молодым пациентам в первые часы большого, особенно переднего, ОИМ: у этих пациентов низкий риск геморрагического инсульта и наибольшая польза от быстрой реперфузии. СК показана пациентам старческого возраста с гипертонической болезнью, нарушением мозгового кровообращения в анамнезе, особенно спустя несколько часов от начала небольшого нижнего инфаркта миокарда: у этих пациентов повышен риск геморрагического инсульта, а польза от быстрой реперфузии уже не столь значима, а может быть и сомнительной. В такой ситуации риск тромболизиса может превышать пользу, поэтому предпочтительно использовать более безопасный тромболитик. Еще больше снизить риск геморрагических осложнений можно путем снижения дозы СК до 750 тыс. ЕД. По нашим данным, введение этой дозы СК за 5–10 минут не снижает частоты реперфузии, а только ускоряет ее [12].
Основные показатели эффективности и безопасности тромболитиков из вышеперечисленных литературных источников, а также текущие округленные оптовые цены представлены в табл. 2.
Поскольку эти данные взяты из разных исследований и регистров с разными критериями включения пациентов и критериями реперфузии, прямое сравнение их некорректно. Особенно это относится к Пуролазе и Фортелизину, которые не имеют большой доказательной базы, сопоставимой с другими тромболитиками, поэтому приведенные данные по их эффективности и безопасности надо рассматривать как предварительные, которые требуют дальнейшего уточнения и подтверждения. Несмотря на это, частота интракраниальных кровотечений на фоне Пуролазы и Фортелизина выглядит очень обнадеживающе: она значительно ниже по сравнению с препаратами ТАП и даже ниже, чем в группе СК. Если это подтвердится при дальнейшем наборе материала, можно будет утверждать, что это самые безопасные тромболитики. Кроме этого можно констатировать, что по влиянию на летальность представленные препараты отличаются между собой незначительно (кроме летальности на Фортелизине, которая вызывает сомнения). Для того чтобы доказать различие по этому показателю, требуется набор в несколько десятков тысяч пациентов (как в исследовании GUSTO-1 при сравнении СК и алтеплазы). Фибриннеспецифичная СК в настоящее время используется реже, работать с ней сложнее из-за частого развития гипотонии, но она сохраняет свое место в клинических рекомендациях [36]. С учетом ее преимуществ в отношении риска развития геморрагических инсультов нет оснований полностью отказываться от этого препарата, особенно пациентам с повышенным риском такого тяжелого осложнения.
Для проведения тромболизиса на догоспитальном этапе требуется препарат, назначаемый в виде одного болюса. Этому требованию пока удовлетворяет только тенектеплаза.
В настоящее время проводится многоцентровое исследование по изучению эффективности введения полной дозы Фортелизина 15 мг в виде одного болюса [37]. Препаратом сравнения служит тенектеплаза в дозе, рассчитанной в соответствии с массой тела, согласно инструкции. При положительном для Фортелизина результате исследования в клинической практике может появиться еще один препарат для догоспитального тромболизиса, который значительно выигрывает в цене.
В федеральный список жизненно важных препаратов на данный момент входят алтеплаза, проурокиназа (в России – Пуролаза) и рекомбинантный белок, содержащий аминокислотную последовательность стафилокиназы (т.е. Фортелизин, т.к. у него отсутствует международное название), поэтому отпускная цена на них ограничена [38]. Как представлено в табл. 2, цены на тромболитические препараты отличаются на порядок. Значительно дешевле всех СК. Несмотря на ее недостатки по сравнению с другими тромболитиками, представляется, что СК не настолько хуже других препаратов, насколько она дешевле с учетом минимальной разницы СК с ТАП по влиянию на летальность.
Таким образом, отечественная кардиология имеет возможность выбора тромболитика для использования в клинической практике при ОИМ. Этот выбор зависит от предполагаемого способа введения, риска геморрагического инсульта и стоимости препарата. Но самое главное, что должны помнить дежурные доктора и организаторы здравоохранения: сам факт проведения тромболизиса любым тромболитиком значительно более важен для исходов заболевания, чем выбор тромболитического препарата!
Конфликт интересов не заявляется.


