Одним из путей решения существующей в последние десятилетия проблемы борьбы с распространением антибиотикорезистентных возбудителей инфекционно-септических процессов в стационарах и во внебольничной среде является разработка и внедрение высокоактивных антимикробных препаратов, способных преодолевать разнообразные механизмы резистентности у различных видов микроорганизмов [5].
К таким препаратам относятся карбапенемные антибиотики, которые наряду с пенициллинами и цефалоспоринами входят в группу β-лактамных антибиотиков, но по сравнению с ними имеют более широкий спектр действия и более устойчивы к гидролизующему действию бактериальных β-лактамаз, в т.ч. β-лактамаз расширенного спектра (БЛРС) [5].
Все карбапенемные антибиотики обладают широким спектром действия, включающим грамположительные и грамотрицательные аэробные и анаэробные бактерии, которые являются основными возбудителями современных нозокомиальных инфекций (НКИ).
Первым карбапенемом, используемым в клинической практике с 1985 г., стал имипенем, который в связи с его расщеплением дигидропептизазой-1 (ДГП-1), вырабатываемой в проксимальных почечных канальцах человека, применяется в комбинации с циластатином – ингибитором ДГП-1. Вторым карбапенемом, нашедшим применение в клинической практике, стал меропенем. Он устойчив к ДГП-1 и поэтому используется без ингибитора этого фермента. По сравнению с имипенемом меропенем несколько более активен в отношении Pseudomonas aeruginosa и других неферментирующих грамотрицательных бактерий (НФГБ), но менее активен в отношении грамположительных кокковых микроорганизмов [7]. С 2002 г. в клинической практике используется эртапенем, имеющий схожую с меропенемом структуру и также устойчив к ДГП-1 [11], Эртапенем характеризуется широким спектром активности, включающим аэробы и анаэробы, устойчив к действию большинства β-лактамаз, однако не обладает клинически значимой активностью в отношении энтерококков, P. aeruginosa и Acinetobacter spp. Эти особенности эртапенема определяют его избирательное назначение при внебольничных и нозокомиальных инфекциях, при которых воздействие на НФГБ, включая Pseudomonas spp., обычно не требуется, т.е. без риска наличия у больного инфекции, вызванной P. aeruginosa или Acinetobacter spp. [13, 28].
В 2005 г. в медицинскую практику Японии был внедрен дорипенем – карбапенемный антибиотик, разработанный японской компанией Shionogi & Co. Ltd. В 2007 г. он был разрешен к клиническому применению в США, а в России был зарегистрирован и разрешен к применению в 2008 г. По спектру антимикробной активности и ряду характеристик дорипенем близок к меропенему и имипенему, при этом обладает несколько более высокой in vitro активностью в отношении ряда грамотрицательных бактерий, включая P. aeruginosa [30].
Карбапенемы принято подразделять на две группы. К первой группе относится эртапенем, ограниченная активность которого в отношении P. aeruginosa позволяет минимизировать вероятность селекции панрезистентных штаммов и вытекающего из нее «параллельного экологического ущерба» [28]. Во вторую группу входят имипенем, меропенем и дорипенем, активные в отношении НФГБ и применяемые при НКИ, обусловленных панрезистентными микроорганизмами.
В основном они продолжают оставаться в ряду наиболее предпочтительных для отделений реанимации препаратов с преимущественным использованием против возбудителей – продуцентов БЛРС и НФГБ, в первую очередь P. aeruginosa и Acinetobacter baumannii.
До недавнего времени карбапенемы практически не имели конкурентов с точки зрения широты антимикробного спектра действия и клинической эффективности, относясь к группе «жизнеспасающих». Однако отмечаемое во всем мире, в т.ч. и в нашей стране, отчетливое снижение эффективности карбапенемов может представлять реальную угрозу жизни пациентов. Определенную роль в распространении этого явления сыграло появление в России генерических препаратов имипенема, особенно меропенема. Настораживает достоверное повышение доли карбапенеморезистентных штаммов Acinetobacter spp. как отражение недостаточной эффективности генериков по сравнению с оригинальными препарами [3].
Дорипенем как последний из разрешенных к применению в клинической практике карбапенемов второй группы и с учетом опыта его 5-летнего использования в России нуждается в более подробном рассмотрении с целью определения места данного антибиотика в современной рациональной антибиотикотерапии.
Общая характеристика дорипенема
Строение молекулы
Уникальное свойство карбапенемов – их природная устойчивость к большинству β-лактамаз, включая БЛРС, обеспечивается за счет наличия в их молекуле атома углерода в положении 1 и транс-α1-гидроксиэтилзамещающей группы в позиции 6. Наличие сульфамоиламинометил-пирролидилтиогруппы в положении С2 молекулы дорипенема обусловливает его высокую активность в отношении НФГБ [29, 38]. Кроме того, в молекуле дорипенема (как и в молекулах меропенема и эртапенема) имеется 1-β-метильная боковая цепь, предотвращающая гидролиз дорипенема под действием почечной ДГП-1.
Механизм действия. Механизм действия дорипенема состоит в нарушении синтеза клеточной стенки бактерий за счет связывания и нарушения функции пенициллинсвязывающих белков (ПСБ), представляющих собой транспептидазы, отвечающие за синтез бактериальной клеточной стенки. Дорипенем отличается высоким аффинитетом к специфическим ПСБ: ПСБ-3 у P. aeruginosa, ПСБ-1, ПСБ-2 и ПСБ-4 – у Staphylococcus aureus и ПСБ-2 – у Escherichia coli [29].
Дорипенем, как и другие карбапенемы, способен быстро проникать через наружную мембрану грамотрицательных бактерий и оказывать в отношении них выраженный постантибиотический эффект (в отличие от β-лактамных антибиотиков других групп).
Спектр активности
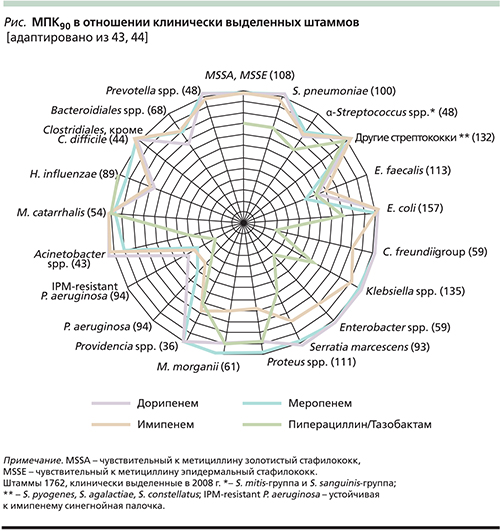
В спектр активности дорипенема in vitro входят метициллиночувствительные стафилококки S. aureus (MSSA) и S. epidermidis (MSSE), стрептококки, в т.ч. пенициллинорезистентные, микроорганизмы семейства Enterobacteriaceae, включая E. coli, Klebsiella spp., Proteus spp., НФГБ, в т.ч. P. aeruginosa и Acinetobacter spp., а также Haemophilus influenzae, Moraxella catarrhalis, Bordetella spp. Спектр активности дорипенема включает также анаэробные бактерии: грамположительные (Clostridium spp.) и грамотрицательные (Bacteroides spp.; табл.1, см. рисунок). Дорипенем, как и другие представители карбапенемов (имипенем и меропенем), не активен в отношении метициллинорезистентных стафилококков (MRSA и MSSE), Enterococcus faecium, Stenotrophomonas maltophila, «атипичных» микроорганизмов и коринебактерий [42].
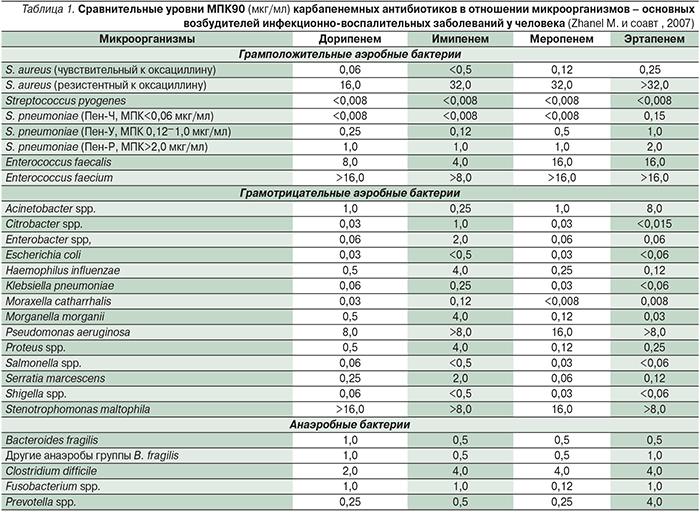
Диапазон минимальных подавляющих концентраций (МПК) дорипенема в отношении большинства чувствительных к нему штаммов варьируется в пределах 0,008–8,0 мкг/мл, МПК90 обычно не превышает 1,0 мкг/мл (табл. 2). Особый интерес представляет активность дорипенема в отношении полирезистентных грамотрицательных бактерий, продуцирующих β-лактамазы: для 100% чувствительных к нему штаммов МПК90 составляет 0,03–0,5 мкг/мл, а для 20,8–29,4% карбапенемоустойчивых МПК90 превышала 32 мкг/мл [30].
Дорипенем является наиболее активным среди всех карбапенемов против пенициллинорезистентных стрептококков, а также высокоактивен in vitro в отношении грамотрицательных бактерий, образующих БЛРС и ряд β-лактамаз класса AmpC.
В табл. 1 представлена активность дорипенема в отношении различных видов микроорганизмов по сравнению с другими карбапенемами [45].
В целом считается, что активность дорипенема in vitro в отношении грамположительных бактерий примерно равна активности имипенема и превосходит таковую меропенема, а по активности в отношении грамотрицательных бактерий дорипенем близок меропенему и превосходит имипенем и эртапенем [6, 45].
Механизмы резистентности
Как известно, вторая группа карбапенемов отличается от других β-лактамов устойчивостью к гидролизу различными β-лактамазами, в т.ч. пенициллиназами, цефалоспориназами и БЛРС. Однако в последние годы наблюдается быстрое распространение возбудителей НКИ, резистентных к карбапенемам.
Особенно быстро растет резистентность среди штаммов P. aeruginosa, Klebsiella spp. и других представителей энтеробактерий (Proteus spp., Enterobacter cloacae, Morganella morganii, Serratia marcenses). Наибольшую опасность представляет бурный рост устойчивости Acinetobacter baumannii – микроорганизма, получившего в последнее десятилетие почти эпидемическое распространение во многих регионах мира. Устойчивость обусловлена продукцией специфических ферментов карбапенемаз, гены которых локализованы на различных подвижных генетических элементах, что определяет их способность к быстрому внутри- и межвидовому распространению.
Механизмы резистентности к дорипенему хорошо изучены. В большинстве своем они характерны также для имипенема и меропенема. Резистентность к ним развивается в основном с помощью трех механизмов:
- во-первых, происходит разрушение молекулы дорипенема карбапенемазами, образуемыми отдельными видами бактерий (в частности, металло-β-лактамазами, продуцируемыми Stenotrophomonas maltophilia, P. aeruginosa и Aeromonas spp.);
- во-вторых, происходит модификация мишени действия антибиотика, т.е. изменяется структура ПСБ у грамположительных микроорганизмов, в частности у MRSA;
- в-третьих, нарушается проницаемость наружной клеточной стенки бактерий за счет утраты или дефицита поринового белка OprD, происходит активный выброс (эффлюкс) антибиотика из микробной клетки (встречается у P. aeruginosa). Утрата поринового белка OprD приводит к повышению уровня МПК дорипенема и в отношении P. aeruginosa, однако для возникновения клинически значимой резистентности у таких мутантов необходимо одновременное присутствие и других механизмов резистентности [31].
Набор карбапенемаз, обеспечивающих быстрый гидролиз молекул карбапенемов, все время расширяется. Первоначально карбапенемазы выявляли преимущественно среди штаммов P. aeruginosa, но в настоящее время они быстро распространяются среди других грамотрицательных бактерий, прежде всего среди представителей семейства Enterobacteriaceae.
Металло-бета-лактамазы и сериновые карбапенемазы КРС и SME обеспечивают гидролиз всех карбапенемов, однако скорость гидролиза дорипенема этими ферментами в 5–100 раз ниже, чем скорость гидролиза имипенема [25].
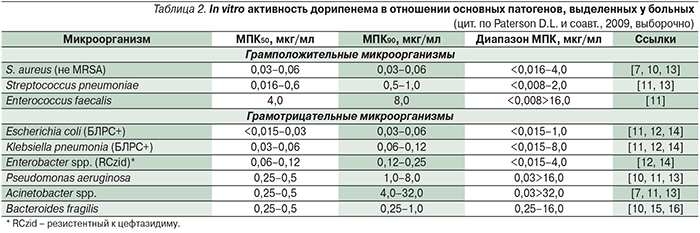
Между географическими регионами отмечаются различия в распространении отдельных карбапенемаз, среди которых наибольшее значение имеют следующие: КРС-тип (молекулярный класс А), группа ферментов OXA-типа (молекулярный класс D) и обширная группа ферментов молекулярного класса В (IMP-тип, VIM-тип, SPM-тип, GIM-тип, SIM-тип, AIM-тип). К классу В относится также получившая широкое и быстрое распространение эволюционирующая группа ферментов NDM-типа [41]. Эти ферменты инактивируют имипенем, меропенем и дорипенем путем гидролиза β-лактамного кольца молекулы. Исключение составляет эртапенем, который не инактивируется этими ферментами.
Уровень и спектр ассоциированной резистентности у продуцентов различных карбапенемаз могут довольно существенно различаться. Так, среди бактерий-продуцентов, выделенных в Санкт-Петербурге, наибольшей устойчивостью характеризовались K. pneumoniae, продуцирующие металло-β-лактамазы NDM-1 (табл. 3 [1]). Они проявляли высокий уровень устойчивости ко всем антибиотикам, кроме полимиксина и тигециклина. При этом отмечен высокий уровень устойчивости к карбапенемам (МПК>16,0 мкг/мл), что не позволяет рассчитывать на эффективность этих антибиотиков даже при применении в максимальных дозах. Некоторая часть изолятов сохраняла чувствительность к азтреонаму. У других продуцентов карбапенемаз был несколько более широк спектр чувствительности к антибиотикам. Так, у 1 штамма Acinetobacter spр. помимо сохранения чувствительности к аминогликозидам и ко-тримоксазолу отмечался невысокий уровень устойчивости к ципрофлоксацину. Продуценты металло-β-лактамаз VIM-4 имели невысокий уровень устойчивости к карбапенемам (МПК>8,0 мкг/мл), что позволяет рассчитывать на определенную эффективность этих антибиотиков [1].
L.S. Tzouvelekis и соавт. (2012) показали, что карбапенемы могут сохранять клиническую эффективность при МПК, равной 8,0 мкг/мл и выше. Это значение совпадает с критериями EUCAST (устойчивыми к имипенему и меропенему считаются изоляты при МПК>8 мкг/мл), но выше критерия CLSI (устойчивыми к имипенему, меропенему и дорипенему считаются изоляты при МПК>4 мкг/мл). Для лучшей ориентации в проблеме устойчивости изолятов к карбапенемам в последнее время подчеркивается необходимость обязательного упоминания применяемых критериев оценки чувствительности, спользованных в работе.
Фармакодинамические особенности
Эффективность дорипенема, обладающего бактерицидными свойствами, зависит от времени поддержания его концентрации (t) в очаге инфекции выше МПК в отношении выделенного возбудителя (t>МПК). Максимальный антимикробный эффект обеспечивается при поддержании t>МПК в течение не менее 40% интервала дозирования.
Обычно дорипенем назначается в виде внутривенной инфузии в дозе 500 мг в течение часа, но при определенных показаниях доза может быть увеличена вдвое, как и время инфузии препарата (до 4 часов). Пролонгация инфузии дорипенема целесообразна при лечении полирезистентных НКИ для поддержания в крови уровня концентраций, превышающих его МПК для возбудителей со сниженной чувствительностью к препарату [8].
В этом плане несомненный интерес представляют результаты исследования, проведенного в рамках программы COMPACT II по изучению фармакодинамического эффекта карбапенемов против преобладающих возбудителей НКИ в Тихоокеанско-Азиатском регионе [19]. С применением метода Monte Carlo была проведена оценка фармакодинамических профилей дорипенема и меропенема в отношении E. coli, K. pneumoniae, P. aeruginosa и A. baumannii. Карбапенемы применялись в режиме создания экспозиций, оптимальных для достижения кумулятивного антимикробного эффекта (cumulative fraction of response – CFR) на уровне >90% в отношении E. coli и K. pneumoniae. Показатель CFR в отношении P. aeruginosa для дорипенема составлял 71,9–91,3% при 4-часовой инфузии 1000 мг каждые 6 часов и при 1- или 4-часовой инфузии 2000 мг. Для меропенема оптимальные уровни CFR достигались при 3-часовой инфузии 2000 мг.
Фармакодинамические особенности карбапенемов изучались и в работах, проведенных с применением динамических систем in vitro, в которых сравнивалась эффективность дорипенема и имипенема в отношении трех полирезистентных штаммов P. aeruginosa в условиях, имитирующих разные схемы и дозы их введения. Для оценки использовались такие показатели, как AUC24//МПК [12]. Очевидно, что проведение таких исследований позволяет сопоставить фармакокинетические и фармакодинамические особенности близких по структуре препаратов.
Вопросы суточной дозировки и длительности применения дорипенема, особенно при лечении вентилятор-ассоциированной пневмонии, вызванной полирезистентными грамотрицательными бактериями, особенно актуальны, поскольку не существует однозначного мнения относительно возможности его использования при этом осложнении [19, 32].
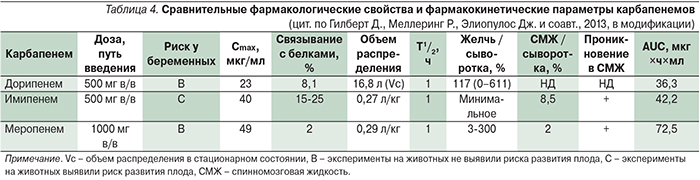
Сравнительные фармакологические свойства и фармакокинетические параметры карбапенемов представлены в табл. 4. В целом фармакокинетический профиль дорипенема сходен с таковым у имипенема и меропенема: периоды полувыведения (Т1/2) названных антибиотиков у пациентов с нормальной функцией почек составляют около часа. Около 8% дорипенема в плазме крови находится в связанном с белками состоянии; аналогичный показатель для имипенема составляет 15–25%, для меропенема – 2% [2]. С учетом низкой степени связывания дорипенема с белками плазмы концентрации белка в крови пациента не оказывают значимого влияния на антимикробную активность препарата.
Объем распределения дорипенема – 16,8 л, примерно соответствует объему внеклеточной жидкости в организме человека. Дорипенем проникает в различные ткани и жидкости организма, включая очаги инфекций. Концентрации дорипенема в перитонеальном экссудате и ретроперитонеальной жидкости превышает МПК препарата для большинства возбудителей осложненных интраабдоминальных инфекций.
Выведение дорипенема, как и других карбапенемов, из организма происходит преимущественно почками в неизмененном виде путем клубочковой фильтрации и активной канальцевой секреции. Менее 1% выводится через кишечник. У пациентов с почечной недостаточностью клиренс дорипенема снижен, что увеличивает период полувыведения.
Завершая этот раздел обзора, можно сформулировать определенное мнение относительно места дорипенема в современной антибиотикотерапии бактериальных инфекций, вызванных полирезистентной микрофлорой.
С учетом опыта применения дорипенема в Японии (с 2005 г.), в США (с 2007 г.) и в России (с 2008 г.), которому посвящено более сотни публикаций в различных медицинских журналах, можно говорить о том, что в ряду карбапенемов дорипенем занял определенное место как препарат с сверхшироким спектром действия, во многом идентичным спектру имипенема и меропенема. Кроме того, у него выявляются определенные преимущества (в количественном выражении) по сравнению с эртапенемом в отношении Acinetobacter spp. и P. aeruginosa по сравнению с меропенемом и эртапенемом – в отношении E. faecalis, E. faecium и MSSE и некоторые преимущества по сравнению с эртапенемом в отношении пенициллинрезистентных штаммов Streptococcus pneumoniae.
Клинические аспекты применения дорипенема при НКИ
Карбапенемы как антибиотики широкого спектра действия, включающего значительный круг грамположительной и грамотрицательной бактериальной микрофлоры, в т.ч. резистентной к другим антибиотикам, назначаются в случаях:
- осложненного течения инфекции брюшной полости;
- инфекции мочевыделительной системы, включая пиелонефрит с осложнениями или без таковых;
- внутрибольничной (нозокомиальной) пневмонии, включая пневмонию, обусловленную проведением искусственной вентиляции легких (ИВЛ).
- тяжелой инфекции (сепсис).
В настоящее время в ряде стран накоплено существенное количество результатов клинического применения дорипенема (Дорипрекс, Takeda Pharma, Япония), значимая часть которых представлена в данном обзоре.
Эффективность при осложненных инфекциях брюшной полости
В исследовании K. Ikawa и соавт. (2007) было показано, что после внутривенной инфузии дорипенема в дозе 500 мг больным, оперированным на органах брюшной полости, антибиотик легко и быстро проникал в брюшную полость и определялся в экссудате в концентрациях, превышающих или соответствующих таковым, определяемым в плазме крови.
Исследования О. Malafaia и соавт. (2006); С. Lucastiи соавт. (2008) по применению дорипенема в отношении больных осложненным течением состояний после абдоминальных операций подтвердили его клиническую эффективность. С. Lucasti и соавт. (2008) представили результаты проспективного многоцентрового двойного слепого исследования по сравнительной клинической эффективности и безопасности применения дорипенема, 500 мг 3 раза в сутки внутривенно (n=237) и меропенема, 1000 мг 3 раза в сутки внутривенно (n=239) пациентами с абдоминальной инфекцией. Показано, что эффективность дорипенема не уступала таковой при лечении меропенемом. В группах больных, применявших дорипенем или меропенем, клиническая эффективность составила 85,9 и 85,3% соответственно.
В другом проспективном рандомизированном многоцентровом двойном слепом исследовании (n=486) сравнивали клиническую и микробиологическую эффективность внутривенного введения дорипенема, 500 мг каждые 8 часов и меропенема, 1000 мг 3 раза в сутки при лечении инфекции брюшной полости [23]. Результаты исследования демонстрируют, что дорипенем не уступает меропенему как с точки зрения клинического выздоровления, так и по микробиологическому ответу на 7–14-дневный курс терапии.
S. Tazuma и соавт. (2014) в многоцентровом рандомизированном контролируемом исследовании сравнивали эффективность дорипенема (500 мг) и имипенема/циластатина (500 мг) в виде внутривенных инфузий каждые 8 часов у пациентов с острой инфекцией желчевыводящих путей. При умеренной или тяжелой инфекции желчных протоков, требующей дренирования, клиническая эффективность дорипенема оказалась сопоставимой с таковой имипенема/циластатина, составив 93,1 против 93,8%. Исследователями не зарегистрированы серьезные нежелательные явления.
В целом нежелательные эффекты дорипенема и имипенема/циластатина отмечены у 3,3 и 3,1% больных соответственно. Авторы делают заключение, что дорипенем следует рассматривать в качестве варианта эффективной терапии при умеренной или тяжелой инфекции желчных протоков.
Эффективность при осложненных инфекциях мочевыделительной системы
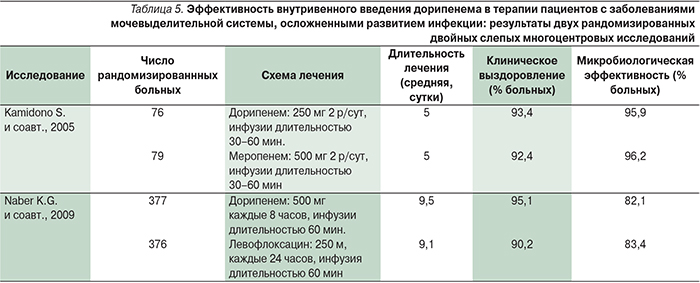
В мета-анализе K.P. Singh и соавт. (2013; гипотеза, что исследуемый препарат не уступает контрольному, дизайн исследования «non-inferiority») проводилась оценка эффективности дорипенема в терапии тяжелых осложненных инфекций мочевыделительной системы путем сравнения трех активных препаратов. Авторы рассмотрели 9 исследований эффективности терапии дорипенемом, левофлоксацином и имипенемом/циластатином. Первичной конечной точкой в мета-анализе стала эрадикация инфекции после окончания лечения (test-of-cure). Согласно результатам исследований, частота эрадикации и соответствующие 95% доверительные интервалы (ДИ) составляли для дорипенема 81% (от 77,7 до 84,2%), для левофлоксацина и имипенема/циластатина – 79% (от 75,9 до 82,2%) и 80,5% (от 71,9 до 89,1%) соответственно. Таким образом, эффективность дорипенема, по данным мета-анализа, не уступала таковой при лечении осложненных инфекций мочевыделительной системы левофлоксацином или имипенемом/циластатином. Данные некоторых исследований, включенных в мета-анализ, представлены ниже.
В проспективном многоцентровом рандомизированном двойном слепом исследовании (753 больных) проводилось сравнение клинической и микробиологической эффективности дорипенема и левофлоксацина в терапии заболеваний мочевыделительной системы, сопровождавшихся развитием инфекционных осложнений [27]. Внутривенное введение дорипенема (500 мг 3 раза в сутки) или левофлоксацина (250 мг/сут) осуществлялось в виде 1-часовой инфузии (табл. 5).
Авторы сделали заключение, согласно которому микробиологическая и клиническая эффективность дорипенема не уступает таковой при лечении левофлоксацином [27]. Близкие результаты были получены другой группой авторов, которые пришли к следующему заключению: эффективность дорипенема не ниже таковой при лечении меропенемом как по клиническому, так и по микробиологическому ответу [18]. Таким образом, дорипенем оказался эффективным антимикробным препаратом при инфекциях мочевыделительной системы, вызванных основными возбудителями: E. coli, Proteus mirabilis и K. pneumoniae.
Эффективность при нозокомиальной пневмонии, включая пневмонию, обусловленную проведением ИВЛ
Широко обсуждается вопрос применения дорипенема пациентами с внутрибольничной (нозокомиальной) пневмонией, включая пневмонию, обусловленную проведением ИВЛ. В странах ЕС и Азиатско-Тихоокеанского региона, в т.ч. в Японии, а также в РФ препарат разрешен к применению больными с нозокомиальной пневмонией. Продолжительность курса лечения составляет 7–14 дней и зависит от тяжести заболевания, локализации инфекции, наличия осложнений (дыхательная недостаточность, легочно-сердечная недостаточность) и динамики клинического состояния больного на фоне лечения. По данным исследования III фазы, не удалось доказать, что 7-дневный курс терапии дорипенемом (1 г в виде 4-часовых инфузий 3 раза в сутки) не уступает по эффективности 10-дневному курсу имипенема/циластатина (по 1 г в виде 1-часовых инфузий каждые 8 часов) при лечении пациентов с пневмонией, связанной с ИВЛ. На основании результатов данного исследования рекомендовано, чтобы длительность терапии пациентов с пневмонией, обусловленной проведением ИВЛ, составляла более 7 дней.
Результаты трех крупных рандомизированных исследований, в которых сравнивали эффективность дорипенема и других антибактериальных препаратов в лечении внутрибольничной пневмонии, в т.ч. у больных, находившихся на ИВЛ, представлены в работах J. Chastre и соавт.. (2008); A. Rea-Neto и соавт. (2008); M.H. Kollef и соавт., (2012). Некоторые результаты этих исследований представлены в отечественных обзорных статьях [4, 5].
В целом выводы об эффективности дорипенема основываются на результатах двух проспективных рандомизированных клинических исследований. Их авторы делают заключение, согласно которому дорипенем является эффективным антибактериальным препаратом для лечения больных нозокомиальной пневмонией, включая пневмонию, обусловленную ИВЛ. Эффективность протокола лечения дорипенемом оказалась не ниже по сравнению с другими стандартными схемами лечения нозокомиальной легочной инфекции (имипенемом или пиперациллином/тазобактамом) и характеризовалась клиническим выздоровлением и микробиологической эрадикацией патогенных штаммов. Важно подчеркнуть, что эффективность дорипенема в равной степени проявлялась и у больных высокого риска развития бактериальной инфекции (пожилой возраст, высокие значения шкалы тяжести клинического состояния APACHE II, позднее развитие пневмонии, обусловленной ИВЛ). Кроме того, имеются данные, свидетельствующие, что эффективность дорипенема в отношении P. aeruginosa может превосходить таковую сравниваемых препаратов в лечении больных пневмонией, обусловленной ИВЛ. Обобщенные результаты исследования эффективности дорипенема в отношении P. aeruginosa при осложненной абдоминальной инфекции и инфекции мочевыделительной системы подтверждают эти наблюдения.
В мета-анализе S.G. Jenkins и соавт. (2009) на основе ретроспективной оценки проведенных ранее четырех рандомизированных многоцентровых клинических исследований попытались оценить эффективность дорипенема и сравниваемых с ним антибактериальных препаратов в лечении НКИ (осложненная инфекция брюшной полости, пневмониоя, в т.ч. обусловленная ИВЛ), вызванной P. aeruginosa. Положительный клинический эффект при лечении с применением дорипенема осложненной абдоминальной инфекции и нозокомиальной пневмонии, вызванной P. aeruginosa, был достигнут у 78,7% (37/47) и 59,6% (31/52) пациентов соответственно. В группах сравнения эти показатели составили 74,3 (26/35) и 32,8% (19/58) соответственно (р <0,05). Показатели микробиологической эрадикации свидетельствовали в пользу эффективности дорипенема, но значимых различий с группами сравнения не определено. Также различия между группами отсутствовали по показателю летальности и частоте нежелательных явлений при проведении антибактериальной терапии. Авторы считают, что у пациентов с осложненной абдоминальной инфекцией и нозокомиальной пневмонией, вызванной P. aeruginosa, статистически значимые различия в клинических показателях эффективности лечения свидетельствуют в пользу дорипенема по сравнению со сравниваемыми антибактериальными препаратами.
В недавней публикации C.-E. Luyt и соавт. (2014) представлены результаты терапии пациентов с пневмонией на фоне проведения ИВЛ и выявленным ростом P. aeruginosa. МПК оказались ниже в группе больных, которым проводилась терапия дорипенемом, по сравнению с таковыми, определяемыми в случаях применения имипенема и меропенема, – МПК50 0,25, 2 и 0,38 мкг/мл соответственно (<0,0001). Несмотря на то что карбапенемы оказались сравнимыми по частоте развития резистентных штаммов, в случаях рецидива некоторые имипенемоустойчивые штаммы оставались чувствительными к меропенему и/или дорипенему. В группах независимо от применявшегося карбапенема длительность пребывания в ОРИТ и летальность достоверно не различались [22].
Данные другого проспективного многоцентрового исследования PROUD (PROspective study on the Usage patterns of Doripenem in the Asia-Pacific region) представлены в публикации M. Mustafa и соавт. (2014). Авторы демонстрируют результаты клинического применения дорипенема (500 мг внутривенно в виде инфузии в течение 1 или 4 часов, 3 раза в сутки в течение 5–14 дней) у 216 больных, в т.ч. у 24,5% нозокомиальной пневмонией и у 35,6% пневмонией, обусловленной ИВЛ [26]. В остальных случаях имели место осложненные инфекции брюшной полости и мочевыделительной системы – 31 и 8,8% больных соответственно. Значения МПК90 дорипенема в отношении P. aeruginosa, A. baumannii, E. coli и K. pneumoniae составили 32, 32, 0,094 и 0,64 мкг/мл соответственно. Дорипенем назначали в качестве монотерапии и как препарат 2-й линии у 86,6 и 62,0% больных соответственно. Длительность ИВЛ составила 10 суток. Клиническое выздоровление по окончании терапии отмечено у 86,7% больных. Общий уровень клинического излечения составил 66,2%, летальность в группе составила 22,7% (49/216). Средняя продолжительность пребывания больных в стационаре и отделении интенсивной терапии составила 20 и 12 дней соответственно. Наиболее типичными, связанными с лечением нежелательными явлениями оказались диарея (1,4%) и рвота (1,4%). Авторы приходят к заключению, что дорипенем следует рассматривать в качестве эффективного препарата для лечения больных нозокомиальной пневмонией, включая пневмонию, обусловленную ИВЛ, а также пациентов с осложненной абдоминальной инфекцией и осложненными инфекциями мочевыделительной системы.
Схемы внутривенного введения дорипенема
Исследования, посвященные клиническому применению дорипенема, как правило, предлагают две схемы его введения. Наиболее часто рекомендуется монотерапия дорипенемом по 500 мг 3 раза в сутки в виде 1-часовой внутривенной инфузии. В отдельных случаях (пневмония у больных, находящихся на ИВЛ) длительность внутривенной инфузии может составлять 4 часа, а максимальная разовая доза – 1000 мг. Кратность введения не изменяется. Длительность лечения варьируется в зависимости от заболевания и характера инфекционного осложнения, возраста больного, тяжести клинического состояния и его динамики в ответ на проводимую антибактериальную терапию, в наиболее тяжелых случаях она может достигать 14 суток.
В основе разработки схем, различающихся по длительности инфузий, лежат исследования, цель которых – оптимизация эффективности антибактериальных препаратов. Это, в частности, достижение наиболее длительного промежутка времени (T) между введениями антибиотика, в течение которого его содержание в крови оставалось бы выше МПК. В исследованиях in vitro показано, что антибактериальная активность карбапенемов может быть оптимизирована путем поддержания T>МПК не менее 35–40% от интервала дозирования [24]. Согласно модели Байеса, увеличение длительности инфузии дорипенема с 1 до 4 часов повысит вероятность того, что концентрация препарата в течение 35% T между введениями будет достигать МПК 4 мг/л [35]. Более того, S.A. Van Wart и соавт. (2009) провели фармакокинетическое моделирование, демонстрируя, что инфузии в течение 4 часов в высоких дозах (1000 мг) 3 раза в сутки были предиктором эффективной терапии при грамотрицательной инфекции, когда показатель МПК составлял 8 мкг/мл. L. Hsaiky и соавт. (2013) провели ретроспективное исследование (n=200) по изучению клинической эффективности стандартной (1-часовой) и пролонгированной (4-часовой) инфузии дорипенема при лечении осложнений, вызванных грамотрицательной бактериальной микрофлорой. Авторами выявлено, что продолжительность инфузии существенно не влияет на результаты лечения всей группы больных. Однако 4-часовая инфузия дорипенема сопровождалась достоверным улучшением результатов лечения больных, находившихся в отделениях интенсивной терапии и реанимации (ОИТР). Авторы указывают на то, что в данной подгруппе больных можно выделить 3 фактора (пневмония, длительность инфекции и бактериемия), выявление которых сопровождалось повышенной летальностью на 90-е сутки пребывания в ОИТР (p=0,008). Таким образом, делается заключение о целесообразности увеличения длительности инфузии дорипенема до 4 часов для больных, находящихся ОИТР.
Безопасность применения дорипенема в клинике
Группа карбапенемов занимает ведущее место в арсенале антибактериальных препаратов для эмпирической терапии больных осложненной внутрибольничной инфекцией. Безопасность и переносимость терапии дорипенемом подробно рассмотрены в статье R. Redman, T.M. File (2009), в которой представлены данные 7 клинических исследований (II и III фазы испытаний препарата), включившие результаты обследования больных, которые получали терапию дорипенемом (n=1815) или одним из четырех препаратов сравнения (n=1325). Согласно данным авторов, внутривенное введение дорипенема характеризовалось относительно безопасным профилем и хорошо переносилось больными. Согласно данным исследования O. Malafaia и соавт. (2006), уровень безопасности для дорипенема оказался близким к таковому при введении меропенема. В исследовании не было ни одного случая летальности, обусловленной применением любого из сравниваемых карбапенемов. Наиболее частыми побочными явлениями, связанными с введением дорипенема, были тошнота, рвота, диарея и анемия. По сути, результаты исследования O. Malafaia и соавт. (2006) были аналогичными данным, полученным в исследовании C. Lucasti и соавт. (2008) в отношении не только эффективности, но и безопасности введения дорипенема.
В исследовании S. Kamidono и соавт. (2005) сравнение безопасности применения дорипенема и меропенема показало, что частота нежелательных явлений составила для первого 4,3%, для второго – 4%, что свидетельствует о благоприятном профиле безопасности обоих карбопенемов.
Несмотря на хорошую переносимость и относительно надежный профиль безопасности, ранее исследователями отмечены случаи развития судорог у больных, находившхся в ОРИТ, во время терапии карбапенемами [14]. Данные различных исследований, включая доклинические, показывают, что дорипенем обладает меньшим по сравнению с другими представителями этой группы потенциалом развития нежелательных явлений (судороги и др.). Судорожные реакции отмечены у 0,3% больных, получавших дорипенем. В случае применения препаратов сравнения (левофлоксацин, меропенем, пиперациллин/тазобактам, имипенем) общая частота развития этого нежелательного явления в группе составила 1,3%. В экспериментальных исследованиях в группе животных, которым в желудочки мозга вводился дорипенем, частота возникновения судорог была ниже, чем при введении других карбапенемов. Дорипенем in vitro демонстрирует более низкое сродство к GABA-рецепторам по сравнению с другими β-лактамами. В одном из мета-анализов, посвященных безопасности применения карбапенемов в клинике, J.P. Cannon и соавт. (2014) делают заключение, что абсолютный риск возникновения судорог при введении карбапенемов является низким. Тем не менее этот риск выше, чем при применении антибактериальных препаратов, относящихся к другим группам. Относительные риски развития судорог при применении имипенема, меропенема, эртапенема и дорипенема по сравнению с другими антибиотиками оказались следующими: 3,50 (95% ДИ – 2,23, 5,49), 1,04 (95% ДИ – 0,61, 1,77), 1,32 (95% ДИ – 0,22, 7,74) и 0,44 (95% ДИ – 0,13, 1,53) соответственно. Хотя имипенем обладал более высокой эпилептогенной активностью по сравнению с некарбапенемами, не было получено статистически значимых различий по этому параметру при сравнении имипенема и меропенема. Таким образом, доклинические и клинические исследования демонстрируют наличие у дорипенема незначительную способность вызывать судорожную активность, что позволяет применять его в высоких дозах в случаях тяжелой и осложненной инфекции.
В целом профиль безопасности дорипенема сравним с таковым других антибактериальных препаратов, включая другие карбапенемы. Данные клинических испытаний свидетельствуют, что вероятность отмены препарата в связи с развитием тяжелых нежелательных реакций невысока. Наиболее частыми нежелательными реакциями, по данным R. Redman, T.M. File (2009), являются головная боль (10,1%), диарея (9%), в т.ч. обусловленная Clostridium difficile (0,5%), тошнота (7,8%) и флебит (5,7%).
L. Hsaiky и соавт. (2013) изучали эффективность, безопасность и переносимость дорипенема в зависимости от скорости его введения (внутривенные инфузии в течение 1 или 4 часов). Авторы пришли к заключению, что препарат характеризовался хорошей сравнимой с другими препаратами безопасностью и переносимостью.
Заключение
В зарубежных публикациях представлены убедительные данные, доказывающие клиническую и микробиологическую эффективность дорипенема у больных нозокомиальной пневмонией, включая пневмонию, возникшую при проведении ИВЛ. Данные сравнительных исследований демонстрируют, что дорипенем является не менее эффективным препаратом, чем другие представители группы карбапенемов, фторхинолоны и ингибиторозащищенные пенициллины у больных с осложненным течением абдоминальной инфекции, с инфекциями мочевыделительной системы. В отдельных исследованиях выявлены определенные преимущества дорипенема по сравнению с другими карбапенемами по показателям антимикробной активности в отношении P. aeruginosa.


