Введение
Распространенность хронического генерализованного пародонтита среди взрослого населения остается на высоком уровне и выступает серьезной медико-социальной проблемой [14]. Установлено, что развитие пародонтита является результатом дисбаланса между микрофлорой полости рта и иммунной защитой организма [4, 11]. Наиболее постоянные обитатели слизистой оболочки представлены разнообразными аэробами и анаэробами – это кокковые формы, непатогенные коринебактерии, бифидобактерии, бактероиды, лактобактерии и другие [1].
В результате воздействия патогенных факторов происходит формирование зубной бляшки, которая провоцирует воспаление в тканях пародонта [10]. С целью ликвидации воспаления применяются различные средства (антисептики, антибиотики, глюкокортикоиды, анальгетики, фитопрепараты), при длительном применении которых может формироваться резистентность [12]. Считается, что одним из возможных путей коррекции микробиоценоза при воспалительных заболеваниях пародонта является бактериотерапия с помощью пробиотических микроорганизмов [7]. Известно [13], что лактобактерии продуцируют антибактериальные вещества, такие как перекись водорода, лактоцидин, лактолин, и, кроме того, стимулируют лимфоидный аппарат, способствуя синтезу иммуноглобулинов и выработке лизоцима. В связи с этим использование микробных биопрепаратов, действующим началом которых является нормальная микрофлора с высокими антагонистическими и ферментативными свойствами, является перспективным направлением в лечении и профилактике заболеваний пародонта [3]. Однако такие исследования есть пока в единичном количестве [5, 6] и механизм действия пробиотиков до конца не изучен. Поэтому целью нашей работы явилось изучение микробного пейзажа биотопа придесневой области десны у пациентов с хроническим генерализованым пародонтитом в ходе использования пробиотиков при лечении пародонтита.
Материал и методы исследования
Всего обследованы 93 человека трудоспособного возраста (20–60 лет) с диагностированным клиническими и рентгенологическими методами хроническим генерализованным пародонтитом легкой и средней степени тяжести. В зависимости от выбранного лечения пациенты были разделены на две условные группы. Основную группу составили 49 человек, которым в комплексное лечение пародонтита включали пробиотики в виде пародонтальных инстилилляций. В качестве пробиотика использовали пробиотик, включавший концентрат живых лактобактерий Lactobacillus acidophilus и Lactobacillus plantarum не менее 108–1010 КОЕ. Данным препаратом проводили инстилляции пародонтальных карманов из шприца с мягкой насадкой. Инстилляции проводили после снятия зубных отложений (с помощью ультразвуковых скейлеров и механических инструментов), кюретажа и обработки пародонтальных карманов антисептиками (0,05%-ным раствором хлоргексидина).
В группу сравнения вошли 44 пациента, которым проведен такой же объем местного лечения по показаниям, но инстилляции с пробиотиками не проводились. Курс лечения в амбулаторных условиях поликлинники этих пациентов составил 3–5 процедур в зависимости от степени тяжести хронического пародонтита (при легкой степени тяжести – 3 процедуры, при средней – 5 процедур). В домашних условиях были даны рекомендации по соблюдению гигиены полости рта и правильной чистке зубов. Оценка состояния пародонта у всех обследуемых пациентов проводилась по индексам Silness-Loe (1963); Podshadley, Haley (1968); Green, Vermillion (1964); Mihlemann и Son (1971); РМА (1960); CPITN (1980). Диагноз пародонтита верифицировался рентгенологическим методом.
Микробиологическая оценка биотопа придесневой области у пациентов с воспалительными заболеваниями пародонта проводилась в лаборатории БУЗ РФ «Республиканский кожно-венерологический диспансер» МЗ РФ. Для анализа содержимое пародонтальных карманов и придесневой области забирали стерильным стоматологическим зондом, после чего материал переносился на транспортную среду СОРАN и передавали в лабораторию в течение 48 часов. В лаборатории доставленный материал ресуспендировали 5 мл изотонического раствора, таким путем получали разведение 1:10, далее делали разведения 1:100 и 1:1000. Из разведения 1:10 высев производили в количестве 0,1 мл на дифференциально-диагностические среды: стафилококковый агар, среда Сабуро, среда Эндо; высев из разведения 1:100 проводили на 5%-ный колумбийский агар, лактоагар; из разведения 1:1000 – на 5%-ный кровяной агар. Для выделения лактобактерий использовали лактобак-агар, для энтеробактерий – среду Эндо, дрожжеподобные грибы культивировали на среде Сабуро, выделение стрептококков проводили на 5%-ном кровяном агаре, стафилококки выращивали на стафилококкоагаре, анаэробы – на 5 %-ном колумбийском агаре. Для создания линий в питательной среде, начиная от образца, была использована стерильная петля. Эти полосы были повторены 3 раза с целью создания 5 областей роста бактерий (область источника бактерий плюс 4 области полос). Это обеспечивало стандартизацию культивирования. Посевы аэробов инкубировали в термостате при 37°С в течение 24–48 часов, посевы анаэробов культивировали при 37°С в термостате Don Whitley Anaerobic Workstation с использованием сухих газогенерирующих пакетов «Анаэрогаз» в атмосфере, содержащей 105 водорода, 10% углекислого газа и 80% азота. Использование палладиевого катализатора обеспечивало уровень кислорода менее 1% в течение 20 минут и менее 0,55% в течение 3 часов. По окончании инкубации производили подсчет колоний, выросших на чашках. Идентификацию выросших микроорганизмов проводили согласно приказу № 535 от 22.04.1985 «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений», для идентификации анаэробных микробов использовали АНАЭРО- тесты-23 (Pliva Lachema).
Степень обсемененности оценивалась в баллах по методу Бонсор и соавт. (2007) [2]. Так, если рост бактерий происходил в области источника и во второй области, то образец получал оценку в 2 балла, в трех обастях – 3 балла и т.д., максимум до 5 баллов.
Для характеристики частоты встречаемости отдельных видов и биоценоза в целом использовали показатель постоянства С (Э.Е. Романенко, 2003). Клиническую и микробиологическую оценку состояния полости рта у обследованных пациентов проводили до назначения лечебных мероприятий, спустя неделю и спустя 3 месяца после их проведения. Все цифровые показатели подвергали статистической обработке с помощью стандартного пакета прикладных программ MS Office 2003 при помощи методов параметрической и непараметрической статистики. Сравнение средних значений двух выборок производили с помощью t-критерия Стьюдента. Различия между сравниваемыми показателями считались достоверными при р<0,05.
Результаты исследования
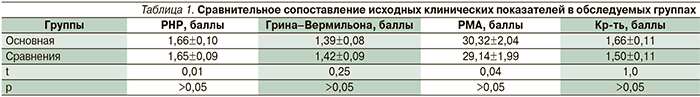
Результаты клинического обследования показали, что степень тяжести воспаления и уровень гигиенического состояния полости рта у пациентов обследованных групп до начала проведения лечения были схожими (табл. 1).
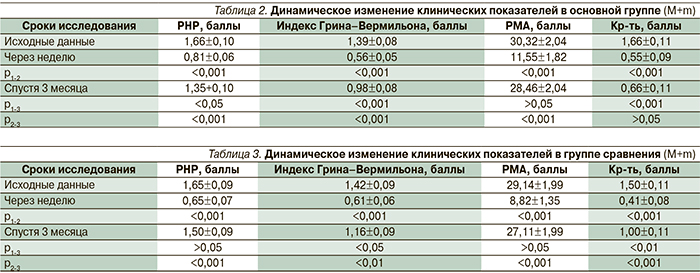
Динамика изменения клинических показателей внутри групп представлена в табл. 2 и 3. Из этих таблиц видно, что сразу после проведения лечения в обеих группах значительно улучшилось состояние пародонта, не только снизились индексы гигиены, но и уменьшились индексы воспаления (РМА и кровоточивости).
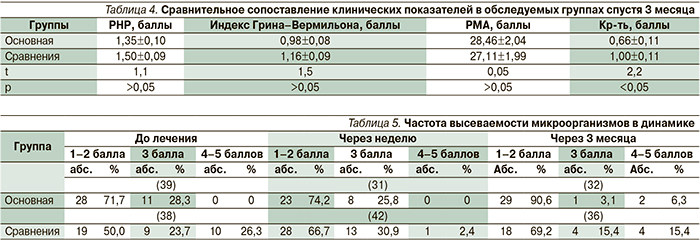
Спустя три месяца после проведенного лечения гигиеническое состояние полости рта в обеих группах ухудшилось: показатели индексов РНР и Грина–Вермильона возросли, появились воспалительные признаки в тканях пародонта. Однако степень воспаления в пародонте оказалась менее выраженной в основной группе, а именно, индекс кровоточивости остался на том же уровне, что был после проведенного курса лечения, в то время как в группе сравнения он значительно возрос (р<0,001). Сравнительные сопоставления клинических показателей между основной группой и группой сравнения спустя три месяца представлены в табл. 4, из которой видно, что признаки воспаления в основной группе по показателю кровоточивости десен существенно ниже р (<0,05), чем в группе сравнения.
Результат микробиологических методов исследования по частоте высеваемости различных видов микроорганизмов из биотопа придесневой области в динамике наблюдения представлен в табл. 5. Из которой видно, что сразу после лечения высокая степень микробной обсемененности в придесневой области пациентов основной группы не выявлялась ни в одном проценте случаев, в то время как в группе сравнения отмечалась в 2,4%.
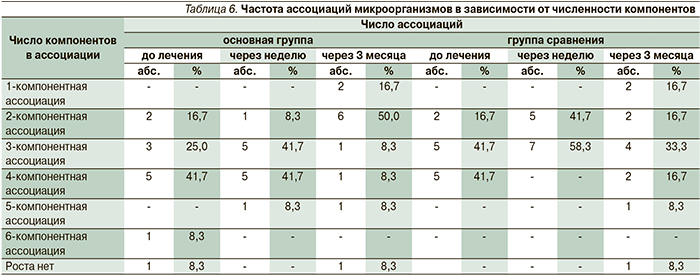
Спустя три месяца в основной группе степень обсеменнености в придесневой области в 1–2 балла имела место в 90,6% случаев, в то время как в группе сравнения – в 69,2%. Кроме того, в основной группе почти в 2,5 раза была ниже выявлена микробная высеваемость в 4–5 баллов, чем в группе сравнения (6,3 и 15,4%). При анализе числа ассоциаций микроорганизмов в биотопе придесневой области (табл. 6) установлено, что до проведения лечения в основной группе и в группе сравнения преобладали 4-компонентные ассоциации микроорганизмов (в 41,7%). После проведенного лечения в той и другой группах имели место как 2-, так и 4-компонентные ассоциации. А спустя три месяца в основной группе в 50% случаев в биотопе придесневой области в основном преобладали 2-компонентные ассоциации микроорганизмов, в то время как в группе сравнения в 58,3% случаев присутствовали 3-компонентные ассоциации и более [9].
Таким образом, нами установлено, что включение пробиотиков в объем комплексного лечения пациентов с хроническим генерализованным пародонтитом способствует снижению степени микробной обсемененности биотопа придесневой области и позволяет получать на протяжении трех месяцев после курса лечения стойкий противовоспалительный эффект, сопровождающийся снижением кровоточивости десен.


