Последнее десятилетие характеризуется массой эпидемиологических, клинических и экспериментальных исследований, позволивших получить принципиально новые представления о структуре и частоте встречаемости хронических заболеваний вен (ХЗВ) нижних конечностей человека.
Хронические заболевания вен включают различные патологические состояния, характеризующиеся нарушением оттока венозной крови из нижних конечностей и проявляющиеся многообразными симптомами и синдромами, среди которых наиболее наглядны варикозные вены и трофические язвы. Наряду с ними могут быть обнаружены и другие признаки, свидетельствующие о хроническом нарушении венозного оттока: отек, венозная экзема, гиперпигментация кожи в области лодыжек, белая атрофия кожи, липодерматосклероз и фиброз подкожно-жировой клетчатки. В возникновении и прогрессировании ХЗВ участвуют различные патогенетические механизмы, важнейшее место среди которых занимает воспаление [1, 2].
На основании клинических, этиологических, анатомических и патофизиологических критериев все ХЗВ объединяют в международную классификацию СЕАР, которая в настоящее время служит фундаментом проведения международных эпидемиологических исследований и разработки стандартов лечения. Различают семь клинических классов C0 ‒ C6. При этом внешние проявления венозной патологии, определяющие клинический класс, могут сопровождаться различными жалобами (S) или протекать без симптомов (А). Симптомы, связанные с ХЗВ, обычно включают зуд, чувство тяжести, ощущение отека, раздражение кожи и др. (табл. 1).
Нозологическая форма «хронические заболевания вен» включает все клинические классы (от С0s до С6), сопровождающиеся субъективными и объективными признаками поражения венозного русла. В то же время под хронической венозной недостаточностью (ХВН) обычно понимают более тяжелые формы ХЗВ, укладывающиеся в классы С3‒С6. То есть варикозное расширение или другая форма заболевания глубоких и поверхностных вен в отсутствие хронического венозного отека и трофических нарушений кожи не должны быть интерпретированы как ХВН [3].
Хронические заболевания вен широко распространены среди населения индустриально развитых стран. Одно из последних международных эпидемиологических исследований, получившее название VEIN CONSULT, продемонстрировало, что признаки ХЗВ отсутствуют лишь у 16,4% людей со средним возрастом 50,6±16,9 года. При этом начальные формы ХЗВ (С0s–C2) обнаруживают у 58%, ХВН ‒ у 23% пациентов. Распределение пациентов, включенных в исследование VEIN CONSULT по географическим регионам и клиническим классам ХЗВ, представлено на рис. 1 [4]. Факторы риска ХЗВ, выявленные в ходе исследования VEIN CONSULT, включают возраст, избыточную массу тела (ИМТ ≥25 кг/м2), семейный анамнез, перенесенный тромбоз глубоких вен и курение.
Специфическими факторами риска для женщин оказались менопауза, увеличение числа родов и низкая физическая активность. В силу массового характера ХЗВ самым серьезным образом влияют как на состояние отдельных индивидуумов, так и на здоровье общества в целом. Наибольшие последствия для социума связаны с ХВН и ее осложнениями. Так, исследование, проведенное в Великобритании, показало, что среднее время существования открытой венозной язвы составляет 9 месяцев. При этом 20% язв не заживают в течение 2 лет, а 66% больных отмечают регулярные рецидивы трофической язвы на протяжении 5 лет и более. Венозные язвы приводят к потере 2 млн рабочих дней, а их лечение стоит примерно 3 млрд долл. США ежегодно. Интересно, что модернизация лечебно-профилактических мероприятий не привела к снижению числа больных венозными трофическими язвами, кото-рое на протяжении последних 20 лет составляет 2–3% от общей популяции жителей европейских стран. Более того, эксперты предсказывают многократное возрастание частоты венозных трофических язв, связанное с увеличением продолжительности жизни. Не менее важен экономический факт, согласно которому на лечение ХЗВ в странах с развитой системой медицинской помощи тратится от 1 до 3% от общего бюджета здравоохранения [2].
Симптомы, традиционно описываемые пациентами с ХЗВ, включают ноющую боль, чувство тяжести, ощущение отека, судороги, зуд кожи, покалывание и повышенную усталость нижних конечностей. Выраженность симптомов и их частота возрастают по мере увеличения клинического класса по СЕАР. Ряд международных исследований подтверждает строгую корреляцию общего счета тяжести заболевания (совокупность различных клинических проявлений, выраженных в баллах) с клиническим классом СЕАР. Доказано, что ХЗВ приводят к существенному снижению качества жизни. Это связано прежде всего с болевым синдромом и ограничением физической активности. Кроме того, симптомы заболевания вызывают депрессивное состояние различной степени выраженности у больного и приводят к его социальной изоляции. Венозные язвы – наиболее тяжелое проявление ХВН. Они болезненны и резко снижают качество жизни. Масштабное исследование пациентов с использованием вопросника SF-36 выявило значительное снижение их качества жизни, обусловленное тяжелыми формами ХЗВ. Прямая корреляция между клиническими классами СЕАР и качеством жизни была обнаружена и посредством болезнь-специфического вопросника. Интересно, что качество жизни пациентов с классами С5–6 ХЗВ по СЕАР оказалось схожим с таковым жизни больных, страдавших сердечной недостаточностью [1, 2, 5].

Все многообразные симптомы и синдромы, встречающиеся у больных ХЗВ, в той или иной мере связаны с повышением венозного давления. Как правило, венозная гипертензия обусловлена рефлюксом крови через недостаточные клапаны. Реже она может оказаться следствием окклюзии вен или нарушения нормальной работы мышечно-венозной помпы, например, в результате ожирения, иммобилизации или блока голеностопного сустава. Рефлюкс крови обнаруживают в поверхностных и глубоких венах раздельно или в обеих венозных системах одновременно. При ультразвуковом исследовании конечностей с венозными язвами в 45% был обнаружен поверхностный рефлюкс крови, в 12% – глубокий и в 43% – поверхностный и глубокий. Таким образом, при венозных язвах в подавляющем большинстве случаев присутствует клапанная недостаточность поверхностных вен. Очевидно, что именно она и играет ключевую роль в патогенезе трофических нарушений кожи. В 70–80% случаев ХЗВ выявляют первичную недостаточность клапанов. У 18–25% пациентов причиной нарушения функции клапанов становится тромбоз глубоких вен или травма. В 1–3% наблюдений находят врожденные аномалии развития клапанного аппарата. Величина венозного давления в нижних конечностях зависит от гидро-статического компонента, обусловленного высотой столба крови до правого предсердия, и гидродинамической составляющей, связанной с сокращением скелетных мышц и давлением в капиллярном ложе. Состояние венозных клапанов влияет как на гидростатическое, так и на гидродинамическое давление. В неподвижном ортостазе в отсутствие активных сокращений икроножных мышц давление в венах нижних конечностей, определяемое гидростатическим компонентом и капиллярным крово-током, колеблется от 80 до 90 мм рт.ст.
Сокращение икроножных мышц во время ходьбы приводит к повышению давления в глубоких венах. В результате кровь проталкивается в центростремительном направлении, а нормально функционирующие клапаны препятствуют ее возврату. Глубокие и подкожные вены запустевают, и давление в них снижается до 30 мм рт.ст. и менее. Мышечно-венозная помпа нижних конечностей организована таким образом, что даже минимальные движения в голеностопном суставе приводят к выкачиванию крови и снижению венозного давления. В случае клапанной недостаточности появляется рефлюкс крови и давление в венах при ходьбе снижается незначительно или, напротив, возрастает. Если развивается недостаточность клапанов в перфорантных венах, высокое давление, генерируемое в мышечных синусах и глубокой венозной системе, передается на поверхностные вены и микроциркуляторное русло кожи. Таким образом, основной гемодинамической характеристикой ХЗВ служит динамическая флебогипертензия – высокий уровень венозного давления при ходьбе, которое сохраняется длительное время [6, 7].
Недостаточность венозных клапанов служит ключевым механизмом формирования венозной гипертензии, лежащей в основе большинства, а может быть и всех проявлений ХЗВ. Патоморфологические изменения клапанов вен, изученные с помощью витальной фиброангиоскопии, многообразны. Они включают растяжение, расщепление, надрывы, истончение и слипание клапанных створок. Кроме того, у пациентов с ХВН отмечено уменьшение количества клапанов на единицу длины подкожных вен. Одним из важных открытий, объясняющим механизм повреждения венозных клапанов, стало обнаружение клеточных группировок моноцитов и макрофагов, инфильтрирующих как венозную стенку, так и створки клапанов. Данный феномен наблюдается у всех больных ХЗВ и отсутствует у здоровых людей. Не менее интересным оказался и тот факт, что клеточные инфильтраты формируются на участках венозной стенки, эндотелиоциты которой продуцируют молекулы клеточной адгезии 1-го типа (ICAM-1) [8].
При гистологических и ультраструктурных исследованиях больных ХЗВ обнаруживают гипертрофию стенки варикозных вен с увеличением количества коллагена, а также одновременным нарушением архитектоники гладкомышечных клеток и эластиновых волокон. В культуре гладкомышечных клеток, полученных из стенки варикозной вены, отмечено нарушение синтеза коллагена с увеличением волокон I типа и уменьшением волокон III типа. Коллаген I типа обусловливает повышенную ригидность соединительной ткани с явлением остаточной деформации. Коллаген III типа, напротив, повышает ее эластичность с сохранением исходной формы. Таким образом, возникающая при ХЗВ дисрегуляция синтеза коллагена снижает эластичность стенки вены и создает условия для ее пространственной деформации. Отличительной особенностью варикозных вен служит чередование сегментов сосуда с гипертрофированной стенкой и атрофированных участков, включающих небольшое число гладкомышечных волокон и незначительное количество межклеточного вещества. Деградация протеинов, формирующих внеклеточный матрикс, происходит в результате воздействия протеолитических ферментов, синтезируемых эндотелиоцитами и макрофагами. Это сериновые протеиназы и матриксные металлопротеиназы (MMPs), которые первоначально выделяются в неактивной форме. Их активация происходит в результате взаимодействия с другими энзимами, которые в свою очередь синтезируют тучные клетки – мастоциты. Активность MMPs регулируется их специфическими ингибиторами – TIMPs. Интересно, что в стенке варикозных вен отношение TIMP-1 к MMP-2 и TIMP-2 к MMP-2 cоставляет 3,6 и 2,1 соответственно. Такое соотношение создает условия для увеличения количества внеклеточного матрикса в варикозных венах. Кроме этого в стенке варикозных вен обнаруживают увеличение уровня цитокинов, в частности трансформирующего фактора роста β1 (TGF-β1) и фактора роста фибробластов (FGF-β – основной фактор роста фибробластов). TGF-β1 стимулирует синтез коллагена, эластина и TIMPs. TGF-β в свою очередь активирует хемотаксис и митотическую активность гладкомышечных клеток. Описанные взаимодействия протеолитических энзимов, их ингибиторов и цитокинов позволяют понять механизм изменений в стенке варикозных вен, где обнаруживают массу мастоцитов, ферменты которых активируют MMPs, разрушающие внеклеточный матрикс. Со временем разнонаправленные процессы синтеза и деградации приводят к появлению гипертрофированных и атрофированных сегментов вены [9, 10].
Воздействие гипертензии на стенку вены хорошо изучено на экспериментальных животных моделях. Так, создание артериовенозной фистулы между бедренными сосудами приводит к быстрому увеличению давления в бедренной вене до 90 мм рт.ст. Сразу же фиксируют растяжение венозных клапанов, которые, тем не менее, в течение 2 суток сохраняют свою запирательную функцию. Позже возникает рефлюкс, выраженность которого со временем возрастает. Через 3 недели в створках клапанов, находящихся под воздействием повышенного венозного давления, отмечают повышение количества гранулоцитов, моноцитов, макрофагов и лимфоцитов. Наряду с этим возрастают уровни MMP-2 и -9. Створки клапанов достаточно быстро претерпевают патоморфологическую трансформацию: уменьшается их длина и толщина. Кроме этого некоторые клапаны попросту исчезают. Данное исследование подтверждает тот факт, что венозные клапаны в течение короткого промежутка времени могут противостоять даже значительному повышению венозного давления. В то же время хроническая венозная гипертензия индуцирует воспалительные реакции, приводящие к патоморфологической перестройке и недостаточности клапанного аппарата с формированием устойчивого рефлюкса крови [11].
При моделировании острого флеботромбоза оказалось, что адгезия лейкоцитов к эндотелию и их экстравазация происходят в сегменте вены с повышенным давлением, т.е. дистальнее окклюзии. Более того, в этой зоне были обнаружены микрогеморрагии и гибель клеток паравазальной паренхимы. Указанные явления отсутствовали на участке вены с нулевым давлением, дистальнее окклюзии.
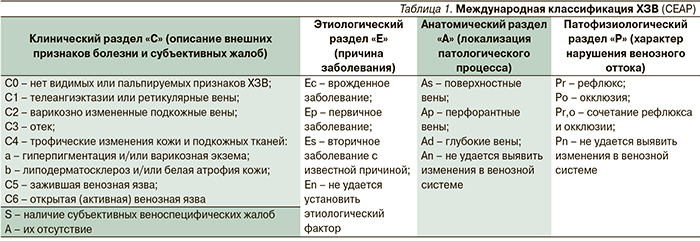
Разнообразные клеточные и молекулярные реакции, развивающиеся в стенке вены, в значительной мере зависят от т.н. силы сдвига или тангенциального напряжения. Исследования с использованием B-flow ультрасонографии позволили детально изучить венозный кровоток. В вертикальном положении человека поток крови по интактной вене носит пульсирующий характер. При этом венозные клапаны открываются и закрываются примерно 20 раз течение минуты. Даже когда клапанные створки полностью открыты, они никогда не соприкасаются со стенкой вены. Непосредственно между створками венозного клапана просвет вены всегда более узкий по сравнению с сегментами сосуда вне клапана. Створки открытого венозного клапана можно рассматривать в качестве своеобразной дюзы реактивного двигателя. В таких условиях между створками венозного клапана поток крови делится на аксиальный (центростремительный), проходящий по оси сосуда, и вихревой, который загибается в клапанные синусы. Вихревой поток крови предупреждает стаз крови в синусах клапана и создает относительно постоянное тангенциальное напряжение на стенку вены и створки клапана. Клапан закрывается тогда, когда давление, создаваемое вихревым потоком, превышает давление в просвете вены (рис. 2). Интересно, что движения в голеностопном суставе (при ходьбе) увеличивают скорость аксиального потока крови и снижают давление в просвете вены, что, соответственно, приводит к закрытию створок клапана. Возникающий на этапе закрытия створок клапана кратковременный (физиологический) рефлюкс не оказывает какого-либо негативного воздействия на венозную стенку [12].
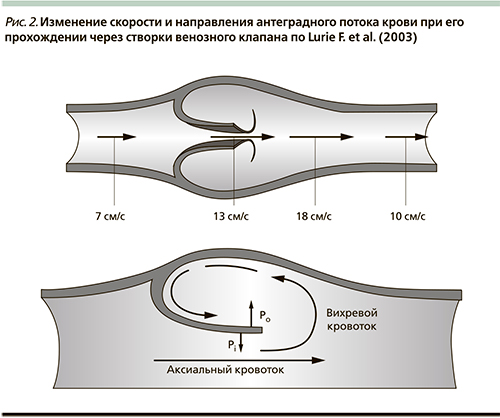
Изменение силы сдвига вызывает разнообразные реакции со стороны эндотелия. В частности, регулирует экспрессию различных генов. Низкий уровень молекул воспаления и свободных радикалов отмечен при нормальных значениях силы сдвига. Ее снижение в результате возникновения турбулентного, в особенности ретроградного, потока крови может спровоцировать появление воспалительных и тромбогенных фенотипов эндотелиоцитов, приобретающих способность фиксировать на своей поверхности как форменные элементы крови (лейкоциты, тромбоциты), так и белковые молекулы (рис. 3). Схожий процесс наблюдается в артериях, когда формирование атеросклеротических бляшек происходит на участке сосуда со сниженным тангенциальным напряжением. Нормализация силы сдвига приводит к быстрому восстановлению формы активированных лейкоцитов. Они втягивают псевдоподии и сбрасывают со своей поверхности молекулы клеточной адгезии CD18. Нейтрофилы, фиксированные к поверхности эндотелия, под воздействием силы сдвига отлипают и возвращаются в кровоток. Тангенциальное напряжение снижает уровень медиаторов воспаления и увеличивает синтез оксида азота в венозной стенке. На уровень силы сдвига огромное влияние оказывает гликокаликс, покрывающий эндотелий. Гликокаликс выступает в качестве трансдуктора, модулирующего и передающего все механические воздействия со стороны просвета вены на эндотелий. Гликокаликс может нейтрализовать молекулы клеточной адгезии и предотвращать фиксацию лейкоцитов. Нарушение его свойств в результате воспалительной реакции или механической травмы изменяет характер тангенциального напряжения и инициирует лейкоцитарную адгезию. В настоящее время точно не известны все механизмы, вызывающие воспаление в венозной стенке и клапанах. Но очевидно, что изменение силы сдвига в этих условиях играет важную роль. Длительный застой венозной крови приводит к растяжению стенки сосуда и деформации створок клапанов. Возникающий ретроградный кровоток снижает тангенциальное напряжение. Вот почему даже в отсутствие рефлюкса венозный стаз вызывает формирование на поверхности эндотелия зон с низкой или нулевой силой сдвига, что в свою очередь приводит к структурным изменениям венозной стенки. Все эти события инициируют воспалительные реакции с участием лейкоцитов и эндотелиоцитов с последующими патологическими изменениями в венозной стенке и клапанах [11].

Венозная гипертензия служит основной причиной нарушения трофики кожи у больных ХЗВ. При исследовании нижних конечностей пациентов с различными формами ХЗВ была обнаружена прямая связь между выраженностью трофических нарушений кожи и величиной постнагрузочного венозного давления. Кроме того, в группах пациентов, ранжированных по увеличению венозного давления, отмечено возрастание частоты венозных трофических язв. Так, при постнагрузочном давлении менее 30 мм рт.ст. открытых венозных язв не было ни в одном случае. При флебогипертензии 90 мм рт.ст. активные трофические язвы отмечены в 100% наблюдений.
Ранее считалось, что динамическая венозная гипертензия приводит к увеличению фильтрации фибриногена, который полимеризуется и формирует вокруг капилляров т.н. фибриновую манжетку, нарушающую диффузию кислорода и приводящую к дегенеративным изменениям в коже. В настоящее время чисто гипоксический механизм трофических нарушений кожи не находит своего подтверждения, а является лишь одной из составляющих воспалительной реакции.
Уже через 40–60 минут после пребывания пациента в положении сидя количество лейкоцитов в крови, оттекающей из дистальных отделов конечностей, снижается. Этот феномен, названный лейкоцитарной ловушкой, наиболее ярко выражен у больных ХВН. Оказалось, что под воздействием венозной гипертензии лейкоциты в посткапиллярных венулах активируются, фиксируются к эндотелиоцитам и выходят в паравазальное пространство. Активацию лейкоцитов косвенно подтверждает увеличение уровня активатора плазминогена в плазме.
Активное участие лейкоцитов в развитии трофических нарушений подтверждают иммунохимические и ультраструктурные исследования. Так, в биоптатах кожи с пораженных нижних конечностей отмечают увеличение количества макрофагов, Т-лимфоцитов и тучных клеток. В эксперименте отмечено достоверное возрастание числа лейкоцитов в лапках крыс при создании острой и хронической венозной гипертензии [24].
Свободно циркулирующие лейкоциты и эндотелиальные клетки экспрессируют различные мембранные молекулы клеточной адгезии. Кратковременная связь между L-селектином поверхности лейкоцитов и Е-селектином эндотелиальных клетках лежит в основе перекатывания (роллинга) лейкоцитов по поверхности эндотелия. Активация лейкоцитов сопровождается сбросом L-селектинов в плазму и синтезом интегринов, включающих CD11b, который соединяется с ICAM-1 эндотелиоцитов. Интегриновая связь обеспечивает прочную фиксацию лейкоцитов к эндотелию. Результат – создание зоны миграции для макрофагов из сосудистого русла с их последующей дегрануляцией и выбросом протеолитических ферментов. При инициации венозной гипертензии путем 30-минутного пребывания пациента с ХЗВ в неподвижном ортостазе уровень L-селектинов и интегрина CD11b на циркулирующих нейтрофилах и моноцитах снижается, что свидетельствует об их перераспределении в микроциркуляторном русле. Одновременно в плазме возрастает уровень растворимого L-селектина вследствие сбрасывания его с поверхности лейкоцитов во время лейкоцитарно-эндотелиальной адгезии. В отличие от здоровых людей у пациентов с ХЗВ уровень адгезивных молекул (ICAM-1, молекулы эндотелиально-лейкоцитарной адгезии 1 и молекулы сосудисто-клеточной адгезии 1) в плазме венозной крови нижних конечностей выше и по мере нарастания флебогипертензии имеет тенденцию к дальнейшему росту. Интересно, что у больных ХЗВ наряду с регионарной, обусловленной флебогипертензией, отмечено системное повышение лейкоцитарной адгезии. Так, плазма пациентов, страдающих ХЗВ, обладает большим активационным потенциалом, вызывая у отмытых нативных лейкоцитов образование псевдоподий с продукцией свободных радикалов. Плазменный фактор, непосредственно отвечающий за этот эффект, пока не известен.
Не вызывает сомнений, что трофические нарушения кожи у больных ХВН связаны с воспалительной реакцией. В частности, при липодерматосклерозе и венозных язвах отмечено увеличение синтеза и активности MMP (в особенности MMP-2). Высокий уровень MMP обнаружен и в экссудате из активных язв. Концентрация TIMP-2 при липодерматосклерозе и венозных язвах, напротив, ниже. Очевидно, что неконтролируемая активность ММР приводит к разрушению внеклеточного матрикса и образованию венозных язв, а также препятствует их заживлению.
При липодерматосклерозе капилляры кожи расширяются, извиваются и благодаря пролиферации эндотелия приобретают вид клубочков. Сосудистый эндотелиальный фактор роста (VEGF), активно участвующий в этих изменениях, способствует увеличению проницаемости капилляров. Уже после 30-минутного пребывания в ортостазе уровень VEGF в плазме венозной крови нижних конечностей больных ХЗВ становится значительно выше, чем у здоровых волонтеров из контрольной группы. Уровень VEGF в плазме прямо пропорционален тяжести ХЗВ и достигает максимума у больных с трофическими нарушениями кожи. Другая частая форма поражения кожи, связанная с ХЗВ, – фиброз мягких тканей. Этот процесс инициирует и регулирует цитокин TGF-β1, который выделяется лейкоцитами и фибробластами. При ХЗВ уровень активного TGF-β1 в измененной коже значительно выше, чем в интактной. Можно предположить, что активированные лейкоциты мигрируют в паравазальное пространство, где и выделяют TGF-β1, который в свою очередь стимулирует выработку коллагена фибробластами дермы. Результатом этого процесса служит фиброз. Нарушение синтеза коллагена фибробластами дермы было обнаружено в визуально здоровой коже пациентов с ХЗВ. Гиперпигментацию при липодерматосклерозе нельзя объяснить лишь повышением проницаемости капилляров. Экстравазация эритроцитов приводит к увеличению уровня ферритина и трехвалентного железа в пораженной коже. Это в свою очередь инициирует окислительный стресс и активацию MMP с накоплением тканевых метаболитов, усугубляющих повреждение тканей и препятствующих регенерации. Подтверждением этой гипотезы служит гемохроматоз, связанный с мутацией C282Y (наиболее частый дефект метаболизма железа) и протекающий с высокой частотой образования венозных трофических язв.
Многочисленные события, происходящие в процессе формирования и манифестации ХЗВ, можно разделить на две большие группы: изменение венозного оттока и хроническое воспаление. Традиционная лечебная программа ставит своей основной задачей снижение венозной гипертензии путем уменьшения или прекращения патологического рефлюкса крови. Для этого могут быть использованы средства компрессионной терапии (бандажи, трикотаж) или различные варианты хирургического вмешательства. Компрессия улучшает венозный и лимфатический отток, снижает отек паравазальных тканей, уменьшает выраженность трофических нарушений, в частности гиперпигментацию и липодерматосклероз, способствует заживлению венозных язв, а также достоверно улучшает качество жизни больных ХЗВ. Хирургическое вмешательство направлено на устранение патологических рефлюксов крови, а также ликвидацию варикозных вен, выступающих в качестве резервуаров «балластной» крови, перегружающей работу мышечно-венозной помпы. Оперативное лечение с использованием современных минимально инвазивных технологий позволяет значительно улучшать венозный отток и в короткие сроки закрывать трофические язвы.
Как было показано выше, важную роль в патогенезе ХЗВ играет лейкоцитарно-эндотелиальная реакция с последующим воспалением венозной стенки. В связи с этим большой интерес представляют фармакологические препараты, нормализующие функцию эндотелия. Ранее ряд исследований in vitro и in vivo продемонстрировал возможность подавления лейкоцитарно-эндотелиальной адгезии и других компонентов веноспецифического воспаления с помощью ряда лекарственных препаратов (гепарин, аспирин, биофлавоноиды и др.). Очевидно, что раннее начало фармакотерапии до запуска процесса патоморфологической перестройки стенки вены и ее клапанов позволит снизить число пациентов с тяжелыми формами ХЗВ. Кроме того, имеются убедительные данные, свидетельствующие о том, что фармакотерапия позволяет улучшать результаты лечения больных ХВН и венозными язвами [13].
Для фармакотерапии ХЗВ используют различные препараты. Наиболее часто это флебопротекторы (син.: венотоники), производные пентоксифиллина и сулодексид. Последний в контексте борьбы с эндотелиальной дисфункций представляет особый интерес. По своему химическому составу (80% высокоподвижной гепариновой фракции, молекулярная масса – 7000 дальтон, и 20% дерматан сульфата, молекулярная масса – 25 тыс. дальтон) и фармакологическим свойствам сулодексид (Вессел Дуэ Ф, «Альфа Вассерманн») занимает промежуточное положение между нефракционированным и низкомолекулярным гепарином. Благодаря своим компонентам сулодексид обеспечивает бинарный эффект (одновременное воздействие на систему свертывания крови и эндотелипротекция), актуальный для патогенетических механизмов ХЗВ. Антитромботический эффект сулодексида реализуется через активацию антитромбина и ко-фактора гепарина II. Кроме того, сулодексид повышает фибринолитическую активность плазмы, снижает агрегацию и адгезию тромбоцитов. Эндотелиопротективный механизм сулодексида обусловлен дерматан сульфатом – одним из компонентов гликокаликса (мукополисахаридный комплекс на поверхности эндотелия), выступающего в качестве ретранслятора всех гемодинамических и химических изменений в просвете сосуда. Считается, что именно гликокаликс создает отрицательный заряд, препятствующий адгезии форменных элементов крови, прежде всего лейкоцитов к эндотелию. Вот почему восстановление гликокаликса рассматривают в качестве важнейшего компонента профилактики и лечения различной сосудистой патологии, включая и ХЗВ [14].
Доказано, что сулодексид воздействует на различные компоненты вено-специфической воспалительной реакции: снижает активность металопротеиназ 2-го и 9-го типов, ингибирует синтез интерлейкинов и интерферонов, подавляет фактор некроза опухоли (TNF) и гранулоцит-макрофаг колоний стимулирующий фактор (G и GM-CSF).
В клинической практике сулодексид демонстрирует высокую эффективность, превосходя флеботропные лекарственные препараты при устранении таких проявлений ХЗВ, как боль, отек и цианоз. Благодаря плейотропному механизму действия (антикоагуляция, эндотелиопротекция и др.) сулодексид имеет серьезные преимущества при лечении последствий острого венозного тромбоза (табл. 2) [15–17].
Таким образом, в основе формирования ХЗВ лежит веноспецифическая воспалительная реакция, индуцированная различными гемодинамическими факторами. Фармакотерапия, направленная на восстановление нормальной функции эндотелия, позволяет останавливать или замедлять прогрессирование ХЗВ и их осложнений.


