Эпидемиологические исследования последних лет свидетельствуют о чрезвычайно высокой и постоянно растущей частоте хронических заболеваний вен (ХЗВ), достигающей 80 % у людей трудоспособного возраста. Столь устрашающие цифры, с одной стороны, связаны с улучшением качества диагностики, с другой – обусловлены появлением ряда новых нозологических форм (гормоноиндуцированные и гиподинамические флебопатии; вторичные нарушения венозного оттока, связанные с ожирением или патологией опорно-двигательного аппарата и др.), не учитываемых ранее [1, 2].
Причинами ХЗВ служат первичные и вторичные (посттромботические) патологические процессы, приводящие к повреждению стенки вен и их клапанного аппарата.
В результате формируются патологические рефлюксы крови, варикозная трансформация подкожных вен; нарастают макрогемодинамические и микроциркуляторные нарушения. В отсутствие адекватного лечения болезнь прогрессирует, что проявляется в виде хронического отека нижних конечностей, трофических нарушений кожи с образованием язв [3].
Первичные формы составляют три четверти всех ХЗВ. Их развитие связывают с солидарным воздействием предрасполагающих (наследственность) и многочисленных производящих (гиподинамия, избыточная масса тела, гормональные сдвиги, прием препаратов половых гормонов, беременность и роды, курение, особенности питания и одежды и др.) факторов, которые вызывают гипоксию эндотелия и запускают специфическую каскадную реакцию с участием лейкоцитов, эндотелиоцитов и тучных клеток. В процессе лейкоцитарно-эндотелиальной реакции синтезируются молекулы клеточной адгезии (VCAM-1 – vascular cell adhesionmolecule-1, ICAM-1 – intercellular adhesion molecule-1), различные медиаторы воспаления (брадикинин, гистамин, интерлейкины), факторы роста (TGF-b1 – transforming growth factor-b1, FGF-b1 – fibroblast growth factor beta, VEGF – vascular endothelial growth factor), а также протеолитические энзимы, включая матриксные металлопротеиназы (MMPs). Первоначально веноспецифическая воспалительная реакция локализуется на уровне эндотелиального слоя. Клинически она проявляется различными субъективными жалобами (чувство распирания, боль, ощущение жжения и др.), связанными со временем суток, температурой окружающей среды и изменениями гормонального фона у женщин. Предположительно на этом этапе патологический процесс носит обратимый характер.
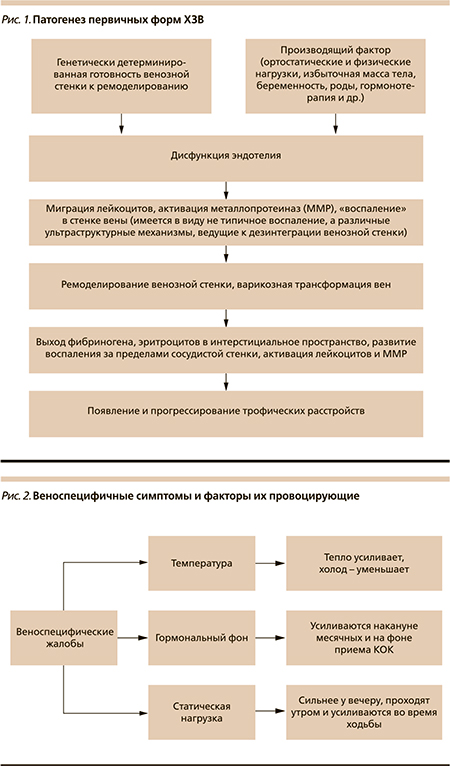
В дальнейшем происходит экстравазация веноспецифического воспаления. В этом активно участвуют VEGF и NO-синтаза (NOS), инициирующие сокращение актина и миозина венозной стенки, в результате чего между эндотелиоцитами формируются фенестры, через которые в паравазальное пространство выходят протеины плазмы (макроглобулины, фибриноген и др.), а также клетки крови (лейкоциты и эритроциты). На этой фазе уже появляются объективные симптомы, прежде всего отек голени. В дальнейшем на фоне воспаления кожи и подкожной клетчатки появляются и нарастают трофические нарушения (рис. 1) [3–6].
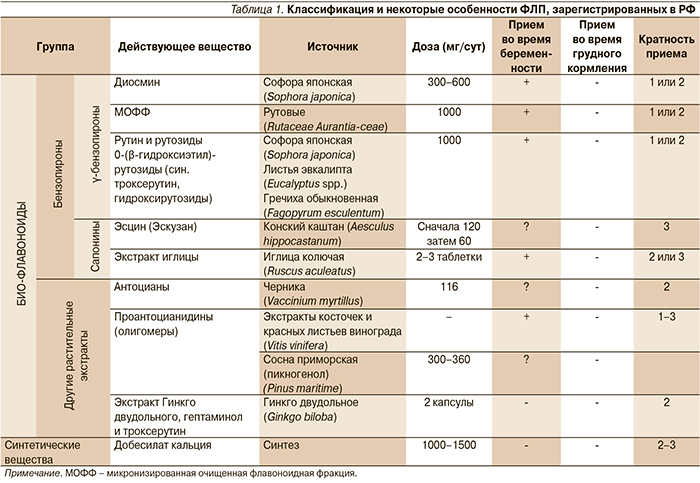
Описанный выше патогенез первичных форм ХЗВ доказывает необходимость проведения активного лечения до того, как произошла экстравазация веноспецифического воспаления, т.е. с момента появления первых веноспецифических симптомов (рис. 2).
Отсутствие выраженных патоморфологических изменений венозного русла более чем у половины больных ХЗВ на фоне доминирования специфических, ухудшающих качество жизни жалоб повышает роль консервативной терапии, одной из важных составляющих которой служат флеботропные лекарственные препараты.
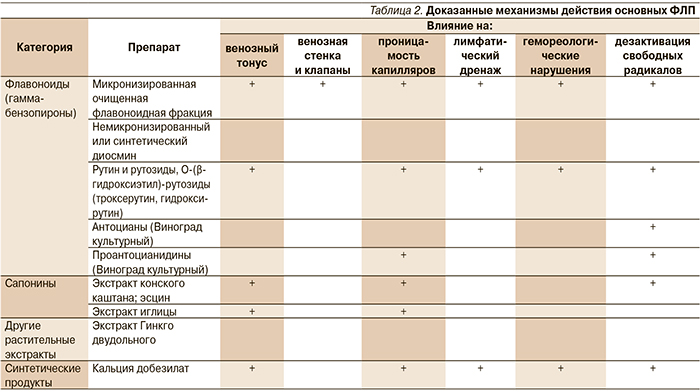
Флеботропные лекарственные препараты (ФЛП; синонимы − веноактивные препараты, флебопротекторы, венотоники) представляют собой гетерогенную группу биологически активных веществ, получаемых путем переработки растительного сырья или химического синтеза, объединенных способностью повышать венозный тонус, а также уменьшать выраженность веноспецифичных симптомов и синдромов. Флебопротекторы, разрешенные к применению в Российской Федерации, могут быть классифицированы в четыре основные группы: бензопироны, сапонины, растительные экстракты и синтетические препараты (табл. 1) [5].
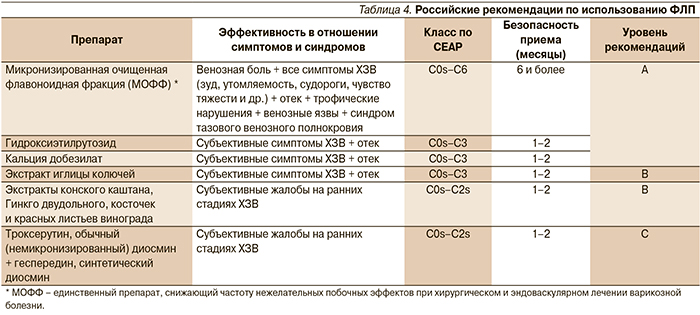
ФЛП повышают тонус периферических вен и лимфатических сосудов за счет влияния на норадреналин-зависимый механизм, а также благодаря некоторым препарат-специфическим эффектам (табл. 2) [4, 5].
Показаниями к применению ФЛП служат веноспецифические симптомы (боль, тяжесть в ногах, дискомфорт, зуд, чувство жжения), хронический венозный отек (ХВО), а также трофические нарушения кожи, включая венозные язвы. ФЛП хорошо переносят подавляющее большинство пациентов. Диспепсические (боли в животе, диарея, рвота и др.) и вегетативные (бессонница, головокружение и др.) явления отмечают не более 5 % больных. Некоторые ФЛП разрешены к приему во II и III триместрах беременности. Вместе с тем назначение ФЛП при беременности оправданно, лишь когда польза от их применения превосходит потенциальные негативные реакции. На период грудного вскармливания назначать ФЛП не рекомендуется [5–7].

Выбор конкретного ФЛП зависит от ряда факторов, среди которых ключевую роль играет объективно подтвержденная в ходе рандомизированных клинических исследований эффективность. При этом следует учитывать, что ХЗВ, согласно международной классификации СЕАР (С – clinic, Е – etiology, А – anatomy, Р – pathophysiology), имеют шесть клинических классов (табл. 3), для каждого из которых должно быть доказано терапевтическое действие того или иного флебопротектора [4, 5].
В табл. 4 и 5 представлены российские и европейские рекомендации по использованию ФЛП, основанные на критериях доказательной медицины [4, 5].
Вместе с тем, несмотря на жесткость формулировок, действующие рекомендации не следует рассматривать в качестве догмы. Дело в том, что при планировании программы терапии приходится учитывать ряд факторов, в т.ч. и такие немаловажные, как материальные возможности пациента и доступность препаратов в аптечной сети. Кроме того, следует отметить, что на ранних стадиях ХЗВ хороший терапевтический эффект демонстрируют все известные венотоники, некоторые из которых могут конкурировать с компрессионной терапией.
В 1996 г. в Lancet – одном из старейших и самом уважаемом медицинском журнале Великобритании были опубликованы результаты рандомизированного слепого плацебо-контролируемого исследования, в котором было проведено сравнение результатов 12-недельного применения экстракта конского каштана – аналога Эскузана – аэсцина (альфа-эсцина 50 мг 2 раза в сутки) и компрессионных чулок класса 2 при ХВО. В исследование были отобраны 240 пациентов, которые были распределены в три группы. Через 12 недель наблюдения оказалось, что у 95 больных, получавших экстракт конского каштана, и у 99, использовавших компрессионную терапию, отек снизился на 43,8 и 46,7 мл соответственно. В то же время в группе плацебо (n = 46) отек увеличился на 9,8 мл. При статистической обработке было зафиксировано значимое уменьшение отека как при приеме экстракта конского каштана (p = 0,005), так и при использовании компрессии (p = 0,002) по сравнению с плацебо. Вместе с тем значимых различий между медикаментозным и компрессионным лечением зафиксировано не было (p = 0.001). Авторы сделали следующий вывод: применение экстракта конского каштана может быть альтернативой компрессионному лечению ХВО. Следует подчеркнуть, что до сегодняшнего дня это единственное исследование, в котором проведено сравнение ФЛП и компрессионной терапии [8, 9].
Кроме того, изучению флеботропного эффекта экстракта конского каштана (Эскузана) посвящено 17 рандомизированных контролируемых исследований [10].
Противопоказания к приему ФЛП возникают только при их непереносимости или прогнозируемом высоком риске нежелательных побочных эффектов. В силу отсутствия доказательной базы не следует назначать флебопротекторы в отсутствие веноспецифических симптомов, а также с целью профилактики развития ХЗВ. Вместе с тем некоторые ФЛП позволяют уменьшать нежелательные побочные эффекты хирургического и флебосклерозирующего лечения варикозной болезни. Кроме того, следует учитывать, что в силу механизмов действия, особенностей фармакодинамики и фармакокинетики ФЛП нельзя использовать для профилактики и лечения острых венозных тромбозов и варикотромбофлебита в качестве монотерапии. Этой категории пациентов ФЛП можно назначать дополнительно к антикоагулянтам (например, для ускорения редукции отека).

Необходимо назначать адекватные, рекомендуемые производителями дозы ФЛП, а также придерживаться стандартных схем и продолжительности лечения. Превышение стандартных суточных доз не всегда повышает клинический эффект, но увеличивает частоту развития нежелательных побочных эффектов, срывающих начатый курс фармакотерапии. Вместе с тем результаты ряда исследований свидетельствуют о том, что в отдельных клинических ситуациях с увеличением дозы ФЛП может повышаться его терапевтическая эффективность. В связи с этим в ситуациях, когда польза превышает потенциальный риск, доза ФЛП после документального обоснования и получения информированного согласия от пациента может быть увеличена.
ФЛП назначают курсами, продолжительность которых подбирают эмпирически на основании динамики симптомов и синдромов, продолжительности достигнутой ремиссии, а также возникновения нежелательных побочных эффектов. Для пациентов с начальными стадиями ХЗВ длительность стандартного курса варьируется от 1,5 до 3,0 месяцев (в среднем составляет 2,5−3,0 месяца). При ХВО, трофических нарушениях кожи и особенно открытых язвах ФЛП могут быть назначены на 6 и более месяцев.
Начало курсового приема ФЛП целесообразно совмещать с периодом ожидаемого обострения заболевания или вероятного нарушения компрессионного режима. Так, применение средств компрессионной терапии затруднено в жаркое время года, при работе в условиях повышенной температуры и влажности, а также при необходимости соблюдения дресс-кода. Негативный фон, часто приводящий к обострению ХЗВ, создают длительное вынужденное пребывание в положении сидя или стоя (многочасовые авиационные перелеты, переезды в автобусе, автомобиле и др.), увеличение рабочей (подъем тяжестей и др.) или бытовой (работа по дому или на приусадебном участке, уход за лежачими больными и др.) физической нагрузки.
При тяжелых формах хронической венозной недостаточности, особенно у пациентов, страдающих ожирением и испытывающих непреодолимые трудности с ношением компрессионных бандажей или медицинского трикотажа, а также когда компрессионная терапия невозможна, ФЛП назначают для постоянного приема.
Больным тяжелыми формами хронической венозной недостаточности, особенно в стадии трофических нарушений и активных венозных язв, целесообразно использование антитромбоцитарных и гемореологически активных препаратов на основе ацетилсалициловой кислоты или пентоксифиллина.
Таким образом, ФЛП служат неотъемлемой частью консервативного, патогенетически обоснованного лечения больных первичными ХЗВ. Своевременное и грамотное использование венотоников позволяет успешно устранять веноспецифические симптомы и синдромы.



