Дизиммунные полиневропатии (ДП) – обширная группа аутоиммунных заболеваний периферической нервной системы, различающихся клиническими проявлениями, типом течения и эффективностью оказываемого лечения. К наиболее распространенным ДП относится хроническая воспалительная демиелинизирующая полирадикулоневропатия (ХВДП), которая в классической форме характеризуется хронической прогрессирующей или рецидивирующей проксимальной и дистальной слабостью и нарушениями чувствительности, снижением или отсутствием проприорефлексов во всех четырех конечностях, а иногда поражением черепных нервов, развивающимся на протяжении не менее 2 месяцев [1].
Расстройства чувствительности при ХВДП отличаются своим клиническим многообразием и зачастую представляют собой первое клиническое проявление в дебюте, в некоторых случаях ХВДП доминируют в течение всей болезни. В развернутой форме заболевания развиваются нарушения поверхностной (болевой, температурной) и глубокой чувствительности (вибрационной, мышечно-суставной) в конечностях по полиневритическому типу. Субъективно больных беспокоят как позитивные (чувство жжения, парастезии и болевой невропатический синдром), так и негативные сенсорные расстройства (чувство онемения, снижение болевой, температурной или вибрационной чувствительности). При выпадении глубокой чувствительности в конечностях у больных появляется выраженная сенситивная атаксия, которая в сочетании с парезами конечностей обусловливает значительную инвалидизацию больных и ограничение их повседневной активности [2].
Базисное лечение ХВДП комплексное и включает препараты, действие которых направлено на снижение активности дизиммунного процесса. К первой линии лечения относят глюкокортикоиды (метилпреднизолон), иммуноглобулин человека нормальный для внутривенного введения и плазмаферез. При недостаточной эффективности прибегают к комбинации препаратов первой линии либо используют терапию второй линии (метотрексат, ритуксимаб и др.) [3].
Немаловажную роль в лечении ХВДП играет симптоматическая терапия, направленная на уменьшение выраженности двигательных нарушений, купирование позитивных и негативных сенсорных нарушений, включая невропатические боли, купирование астении, патологической утомляемости, коморбидных аффективных расстройств.
В аспекте симптоматической коррекции чувствительных нарушений при ХВДП весьма перспективным представляется использование тиоктовой кислоты (альфа-липоевая кислота, Эспа-Липон; Эспарма ГмбХ, Германия). Согласно современным данным, механизмы действия тиоктовой кислоты сводятся к нормализации энергетического обмена нейронов, восстановлению аксонального транспорта, стабилизации клеточных мембран, инактивации свободных радикалов и подавлению их образования. Классически препарат применяют в лечении диабетической и алкогольной полиневропатии, тем не менее терапевтический потенциал препарата этими нозологиями не ограничивается. Например, мы ранее опубликовали результаты достаточно успешного использования препарата для коррекции сенсорных нарушений у больных рассеянным склерозом (РС), что подтверждает возможность применения тиоктовой кислоты при аутоиммунных воспалительных заболеваниях нервной системы [4]. Позднее тиоктовая кислота была включена в Стандарт первичной медико-санитарной помощи при РС в стадии ремиссии (Приложение к приказу Министерства здравоохранения России № 1542Н от 24.12.2012), который наряду с аннотацией к препарату предоставляет врачу юридические основания использовать данный препарат в рутинной практике лечения больных РС. Соответственно, вполне логично предположить целесообразность и потенциальную эффективность использования тиоктовой кислоты в лечении сенсорных нарушений у больных ХВДП, близкой в клиническом плане к диабетической полиневропатии, а в патогенетическом – к РС [5–7].
Целью исследования стало изучение влияния препарата тиоктовой кислоты Эспа-Липона на сенсорные симптомы и нейрофизиологические показатели проводимости по смешанным периферическим нервам у больных ХВДП.
Материал и методы
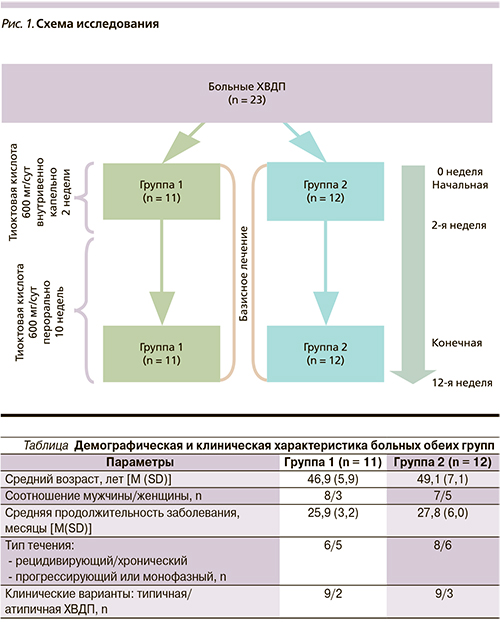
Рандомизированное одноцентровое пострегистрационное контрольно-сравнительное клиническое исследование проведено в условиях Республиканского клинико-диагностического центра по демиелинизирующим заболеваниям Минздрава Республики Татарстан (РКДЦ ДЗ МЗ РТ, www.rkbvl.ru) с 2013 по 2014 г. В исследование включили 23 больных ХВДП, диагноз которым был выставлен в соответствии с критериями Европейской федерации неврологических обществ 2010 г. – EFNS (European Federation of Neurological Societies, [8]) в возрасте от 23 до 65 лет вне обострения и без клинически значимой сопутствующей соматической или онкологической патологии, получавших базисную глюкокортикоидную терапию (метилпреднилозон перорально через день в индивидуальных дозировках). Перед началом участия в исследовании все больные подписали добровольное информированное согласие. Группу 1 (основную) составили 11 пациентов, получавших помимо базисной терапию тиоктовой кислотой (Эспа-Липон). В группу 2 (контрольную) вошли 12 пациентов с ХВДП, получавших только базисную терапию. Общая характеристика обследованной выборки пациентов представлена в таблице.
В группе 1 больные проходили курс лечения тиоктовой кислотой по следующей схеме: первые 2 недели 600 мг/сут (24 мл концентрата тиоктовой кислоты на 250 мл 0,9 %-ного раствора NaCl) внутривенно капельно 1 раз в сутки, затем перорально таблетки по 600 мг/сут в течение 10 недель (общая продолжительность лечения составила 12 недель). Для профилактики развития эрозивного гастрита, особенно с учетом базисной глюкокортикоидной терапии, все испытуемые также получали омепразол по 40 мг/сут перорально в течение всего курса лечения.
Для комплексной субъективной и объективности оценки эффективности проведенного курса лечения тиоктовой кислотой применяли клинические и нейрофизиологические методы, проведенные до начала терапии и через 12 недель (рис. 1).
Для оценки субъективных сенсорных нарушений, таких как боль, парестезии, чувство онемения и жжения в зависимости от интенсивности и частоты возникновения, использовали шкалу оценки общих симптомов TSS (Total Symptom Score). С целью оценки тактильной, болевой и глубокой чувствительности на конечностях, сенситивной атаксии, мышечной силы по 7 мышечным группам на руке и ноге применяли шкалу выраженности симптомов периферической невропатии Ноттерман.
Количественное тестирование вибрационной чувствительности проведено с использованием вибротестера BT-02-1 «Вибротестер-МБН» (Научно-медицинская фирма МБН, Россия) по стандартной методике, заключающейся в измерении порога вибрационной чувствительности (паллестезиометрия) на третьем пальце последовательно правой и левой рук при воздействии вибрации частотой 125 Гц со ступенчатым увеличением ее интенсивности с шагом 0,75 дБ в диапазоне от -21 дБ до +30 дБ [9].
Оценка функционального состояния смешанных нервов (проводимость по двигательным и чувствительным волокнам срединного нерва) в соответствии с рекомендациями EFNS осуществлена посредством стимуляционной электронейромиографии (с-ЭМГ) на многофункциональном нейрофизиологическом комплексе Нейро-МВП (ООО «Нейрософт», Россия).
Статистический анализ полученных данных проведен с применением программного обеспечения StatSoft Statistica 7.0 и Excel из пакета MS Office 2003. Часть исследования выполнена в рамках Гранта Президента России для государственной поддержки молодых российских ученых – кандидатов наук МК-4316.2012.7.
Результаты и обсуждение
Все больные группы 1 завершили 12-недельный курс лечения тиоктовой кислотой. Обострений ХВДП в обеих группах за этот период не отмечено. Переносимость исследуемого препарата была удовлетворительной, из несерьезных побочных эффектов у 2 больных группы 1 отмечено появление нестойких и вполне ожидаемых, особенно на фоне пероральной глюкокортикоидной терапии, диспепсических расстройств (эпизоды ноющих болей в эпигастрии и изжога), интерпретированных как обострение хронического гастрита, что, однако, не послужило причиной для отмены получаемой терапии. Серьезных побочных эффектов, связанных с приемом тиоктовой кислоты, в группе 1 не отмечено.
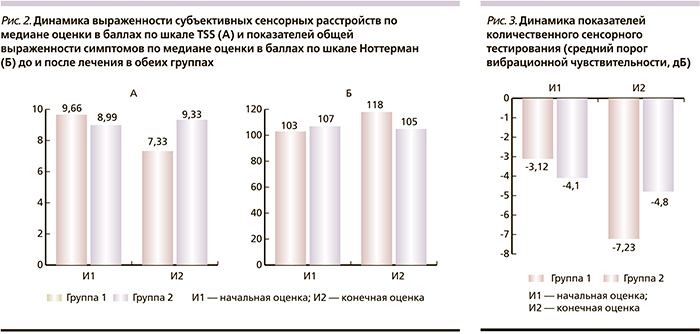
В группе 1 прослежена положительная динамика уменьшения выраженности субъективных сенсорных расстройств (медиана переменной – Me оценки по шкале TSS уменьшилась с 9,66 до 8,99 балла; p > 0,05), а также уменьшение общей выраженности симптомов (Me оценки по шкале Ноттерман увеличилась с 103 до 107 баллов; p > 0,05).
В то время как в группе 2 отмечено статистически значимое прогрессирование оценок как субъективных сенсорных нарушений (Me оценки по шкале TSS уменьшилась с 7,33 до 9,33 балла; p < 0,05), так и общей выраженности симптомов (Me оценки по шкале Ноттерман уменьшилась со 118 до 105 баллов, p < 0,05) (рис. 2).
В группе 1 отмечена положительная динамика показателей количественного тестирования вибрационной чувствительности (средний порог вибрационной чувствительности снизился с -3,12 до -4,1 дБ), в то время как в группе 2 прослеживается статистически значимое продолжающееся прогрессирование нарушения вибрационной чувствительности (средний порог вибрационной чувствительности повысился с -7,23 до -4,8 дБ; p < 0,05) (рис. 3).
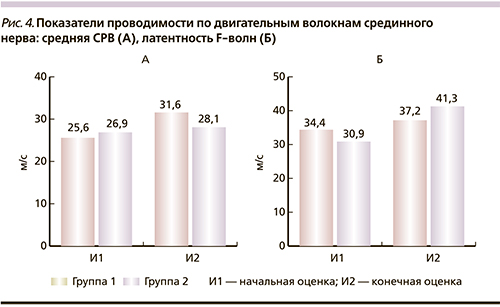
По результатам с-ЭМГ, динамика показателей проводимости оценена по двигательным волокнам срединного нерва (средняя скорость распространения возбуждения – СРВ и латентность F-волны), поскольку сенсорный ответ часто либо полностью отсутствовал из-за высокого порога возбуждения нерва, либо не удавалось простимулировать нерв в проксимальной (в области локтевого сгиба) и дистальной (в области запястья) точках, что препятствовало расчету СРВ.
В группе 1 отмечена слабая динамика улучшения показателей проводимости по двигательным волокнам в форме повышения средней СРВ (с 25,6 до 26,9 м/с; p > 0,05) и уменьшения средней латентности F-волны (с 31,6 до 28,1 мс; p > 0,05). В то время как в группе 2 прослеживается продолжающееся прогрессирующее снижение средней СРВ (с 34,4 до 30,9 м/с; p > 0,05) и статистически значимое увеличение средней латентности F-волн (с 37,2 до 41,3 мс; p < 0,05) (рис. 4).
Таким образом, результаты исследования продемонстрировали, что применение тиоктовой кислоты в дозе 600 мг/сут в течение 12 недель на фоне базисной пероральной глюкокортикоидной терапии сопровождалось у больных ХВДП уменьшением выраженности субъективных и объективных сенсорных нарушений, вызывало замедление прогрессирования симптоматики и способствовало положительной динамике нейрофизиологических показателей функционального состояния периферических нервов. Переносимость терапии была хорошей, каких-либо серьезных побочных эффектов на фоне приема тиоктовой кислоты не отмечено.
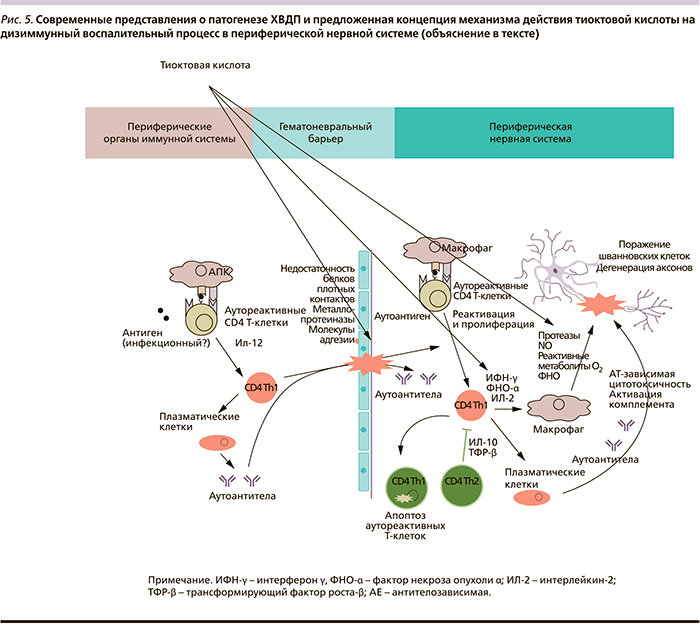
В прикладном аспекте результаты данного исследования позволяют рекомендовать вышеуказанную методику симптоматического лечения чувствительных нарушений у больных ХВДП к применению в рутинной практике невролога. Позитивный эффект тиоктовой кислоты вполне объясним с учетом современных представлений о патогенезе ХВДП и механизме действия препарата. Оказывая антиоксидантное и мембранно-стабилизирующее действие, тиоктовая кислота может улучшать функциональное состояние гематоневрального барьера, тем самым уменьшая миграцию иммунных клеток и попадание антител в пределы периферической нервной системы (рис. 5). Кроме того, препарат, вероятно, обладает иммуно-модулирующим эффектом, препятствует воспалительной демиелинизации и создает благоприятные условия для процессов ремиелинизации.


