Возможности современной химиотерапии высокодифференцированного рака щитовидной железы
И.С. Романов
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» РАМН, Москва
Высокодифференцированные формы рака щитовидной железы (ВДРЩЖ) составляют более 90 % случаев. У 10–15 % больных обнаруживаются отдаленные метастазы, что крайне ухудшает прогноз. Терапия радиоактивным йодом остается основной для этой группы больных. Данное лечение обеспечивает хороший результат, но только в том случае, если опухолевые клетки не потеряли способность накапливать радиоактивный йод. Для пациентов с т.н.радиойодрефрактерным ВДРЩЖ прогноз остается весьма неблагоприятным. С крайне обескураживающими результатами применяется стандартная цитотоксическая химиотерапия. За последние годы развитие молекулярной биологии привело к открытию массы мишеней при раке щитовидной железы. Эти мишени включают протоонкогеныBRAF и RET, VEGFR и PDGFR, ассоциированные с ангиогенезом, и натрий-йодный симпортер. Наиболее изученными в применении в клинике считаются тирозинкиназные ингибиторы, результаты исследования которых позволили ввести в лечение данной группы пациентов новые таргетные препараты.
Рак щитовидной железы (РЩЖ) – сравнительно редкое злокачественное заболевание. Но при этом, например, в 2008 г. в России взяты на онкологический учет почти 9000 больных с таким вновь установленным диагнозом [1]. Высокодифференцированные формы рака щитовидной железы (ВДРЩЖ) (папиллярная и фолликулярная аденокарциномы) составляют 90–95 % всех случаев РЩЖ [2–4]. Стандартное лечение ВДРЩЖ обычно включает экстрафасциальную тиреоидэктомию, радиойодтерапию и заместительную терапию L-тироксином [5, 6]. Результаты лечения ВДРЩЖ достаточно успешные, в частности 10-летняя выживаемость превышает 85 % [7, 8]. Но у части больных ВДРЩЖ (10–15 %) выявляются отдаленные метастазы, причем у половины этих пациентов они выявляются уже при первичном лечении [3, 9, 10]. Прогноз для этой группы пациентов менее благоприятный, и 10-летняя выживаемость падает до 40 % [3, 11, 12]. Наиболее часто отдаленными метастазами при ВДРЩЖ поражаются легкие (до 70 %). Кроме того, отдаленные метастазы обнаруживаются в костях (до 44 %), головном мозге, надпочечниках и печени. Около 20 % больных имеют множественное полиорганное поражение (обычно это легкие и кости) [10, 11].
Радиойодтерапия (радиоактивным йодом-131) – основной метод лечения данной группы пациентов, позволяя части из них достичь 90 % 10-летней выживаемости без прогрессирования [10, 13]. Но у 25–66 % больных ВДРЩЖ с отдаленными метастазами первично или в процессе лечения развивается их частичная или полная резистентность к терапии радиоактивным йодом-131 (с 10-летней выживаемостью около 10 %) [10, 14]. Применение стандартной цитотоксической терапии этих больных дает крайне плохие результаты [15–17]. Именно пациенты с радио-йодрезистентыми ВДРЩЖ нуждаются в новых эффективных методах лечения. Изучение молекулярной биологии РЩЖ выявляет все большее количество мишеней, что может обеспечить прорыв в лечении этих пациентов [18].
Потенциальные молекулярные мишени
Как при папиллярной, так и при фолликулярной форме ВДРЩЖ очень распространены соматические мутации. При папиллярном раке (ПРЩЖ) наиболее распространены три мутации. Мутация B изоформы RAF-киназы (BRAF-мутация) выявляется примерно в 45 %, RAS-мутация выявляется в 15 % и перестройка RET/PTC обнаруживается в 20 % случаев [19]. Все эти мутации ведут к регуляции RAS/BRAF/MAPK/ERK-пути, который и вовлечен в канцерогенез РЩЖ.
BRAF-мутация чаще других выявляется при ПРЩЖ. Более чем в 90 % BRAF-мутаций выявляется точка мутации T1799A, которая ведет к замене аминокислоты в V600E (валина на глутамин). Это приводит к активации BRAF-киназы, и следовательно, к активации нижележащего пути [20, 21]. Хотя эти данные не подтверждаются всеми исследованиями, считается, что эта мутация связана с высоким риском развития рецидива и плохим прогнозом заболевания [22, 23]. В частности, считается, что BRAF-мутация связана с нарушением работы натрий-йодного симпортера, снижая способность тироцита к накоплению йода и приводя к развитию последующей радиойодрефрактерности [24–26].
При фолликулярном раке наиболее распространены RAS-мутации (45 %), PAX8-PPAR-γ генетические перегруппировки (35 %) и мутации, вовлекающие фосфатидилинозитол 3-киназой (PI3K) активирующийся путь (10 %) [19]. PI3K-активирующийся путь служит альтернативой MAPK-пути. При анапластическом раке щитовидной железы или агрессивных формах ВДРЩЖ распространены мутации, регулирующие оба эти пути [27, 28]. Соответственно, эти мутации также являются целью для современной таргетной терапии ВДРЩЖ.
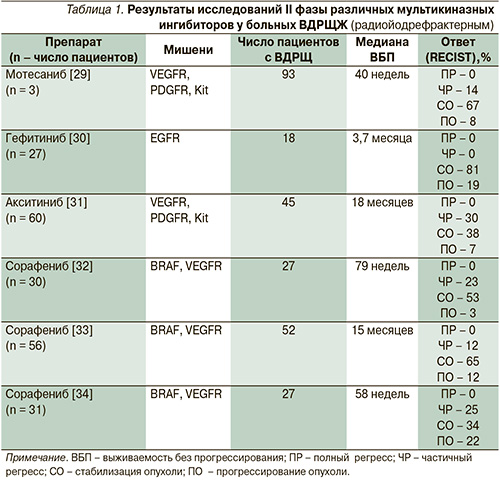
Современные таргетные препараты, направленно воздействующие на эти специфические мутации, включают тирозинкиназные ингибиторы (ТКИ) и ингибиторы ангиогенеза. Исследуются также препараты, которые могут восстанавливать накопление радиоактивного йода. У многих из них механизмы действия перекрываются. Так, например, ТКИ могут подавлять ангиогенез и улучшать поглощение радиоактивного йода. Большинство современных исследований сосредоточено на ТКИ. Результаты исследований II фазы ТКИ представлены в табл. 1.
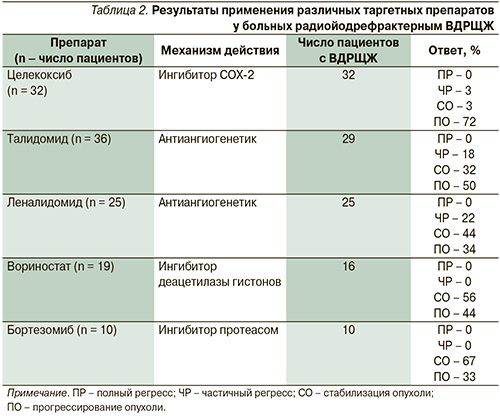
Опубликованные результаты исследований других новых препаратов приведены в табл. 2.
К результатам данных исследований следует относиться с осторожностью.
В большинство исследований включены больные различными гистологическими формами РЩЖ (например, медуллярный, анапластический и ВДРЩЖ). Надо учитывать, что это были исследования II фазы, т.е. не имели контрольных групп сравнения.
Тирозинкиназные ингибиторы
Тирозинкиназные ингибиторы – это малые молекулы, которые соединяются с АТФ-связывающимся доменом, таким образом конкурируя с АТФ внутри клетки, предотвращая фосфорилирование тирозиновых остатков внутриклеточных белков, тем самым блокируя дальнейшую передачу сигнала к ядру клетки. Связываемая часть схожа для различных тирозинкиназ, и хотя лекарство может блокировать конкретную тирозинкиназу, при этом, вероятно, оно оказывает подавляющее действие на множество тирозинкиназ [35]. Из-за того, что большинство злокачественных опухолей обладает множественными мутациями с регуляцией нескольких молекулярных путей, эта высокая степень перекрестной активности тирозинкиназ может быть клинически выгодной. Большинство ТКИ, применяемых в исследованиях, подавляют несколько тирозинкиназ.
В большей степени повышенный клинический интерес вызывают ТКИ «широкого спектра», связанные с сосудистой пролиферацией (VEGF, PDGF). Каждое из этих лекарств имеет т.н. полумаксимальную подавляющую концентрацию (IC50) для каждой специфической мишени, термин, применяемый для сравнения различных ТКИ. К примеру: Мотесаниб обладает IC50 2нМоль/л для VEGFR-1, 6 нМоль/л для Kit, 59 нМоль/л для RET и 83 нМоль/л для PDGFR [36].
Но даже при использовании таких ТКИ «широкого спектра» из-за активации альтернативных тирозинкиназ или молекулярных путей опухоли могут быть рефрактерными к применению ТКИ. Предполагается, что комбинация ТКИ с широким спектром мишеней может быть более эффективной, чем применение одного препарата, из-за подавления большего количества молекулярных путей [38].
Одной из перспектив применения ТКИ при радиойодрефрактерном ВДРЩЖ служит возможность повысить чувствительность данного вида опухоли к традиционным видам лечения. Несмотря на то что клинических данных, подтверждающих этот эффект, не опубликовано, есть данные исследований in vitro, согласно которым использование ТКИ может повысить поглощение радиоактивного йода и чувствительность к доксорубицину [41, 42].
За последние годы были опубликованы результаты не менее 6 исследований II и одного III фаз применения ТКИ при ВДРЩЖ с непосредственными результатами лечения [29–34, 39, 40].
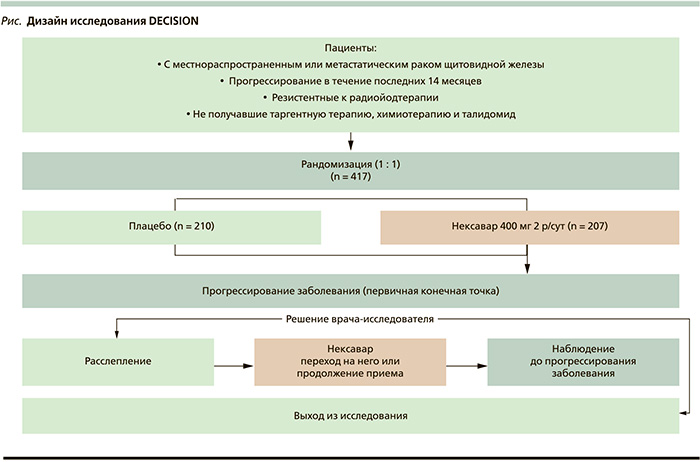
На съезде ASCO-2013 представлены результаты клинического исследования III фазы применения сорафениба при ВДРЩЖ, резистентного к радиоактивному йоду (DECISION). Дизайн исследования представлял собой двойное рандомизированное исследование. В исследуемую группу пациентов, получавших сорафениб 400 мг 2 раза в сутки, были включены 207 больных. В контрольную – 210. Критерий включения пациентов в исследование: гистологически доказанный местнораспространенный или метастатический дифференцированный РЩЖ, резистентный к лечению радиоактивным йодом.
Критерии радиойодрезистентности:
- наличие по крайней мере одного очага, не накапливающего йод;
- прогрессирование заболевания после введения радиоактивного йода в терапевтической дозе (100 мКи и более);
- кумулятивная доза радиоактивного йода 600 мКи и более;
- прогрессирование заболевания в течение последних 14 месяцев (по RECIST).
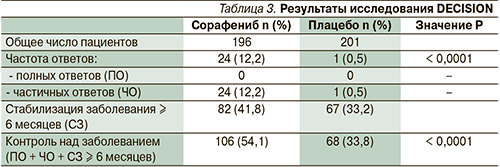
Важным условием было адекватное подавление уровня тиреотропного гормона < 0,5 мМЕ/л). На рисунке представлен дизайн исследования. После выявления прогрессирования дизайн исследования предполагал расслабление лечения и переход на терапию сорафенибом по решению врача-исследователя. С учетом дизайна исследования ее первичной конечной точкой была оценка выживаемости без прогрессирования. При сравнении медианы выживаемости без прогрессирования было обнаружено значительное ее увеличение (10,8 против 5,8 месяца) в группе пациентов, получавших сорафениб (HR – 0,59; 95 % ДИ – 0,45–0,76; p < 0,0001). В табл. 3 представлены непосредственные результаты лечения. При сравнении видно, что в исследуемой группе с применением сорафениба достигнута частота ответов 12,2 против 0,5 % в группе плацебо (p < 0,0001).
Таким образом, на сегодняшний день сорафениб стал первым препаратом, доказавшим свою терапевтическую эффективность в отношении больных ВДРЩЖ, рефрактерных к радиойодтерапии.
Мы ожидаем, что в ближайшем будущем появятся другие эффективные таргетные препараты, а также их комбинации для лечения радио-йодрезистентных форм ВДРЩЖ. Необходимо изучать профиль генетических нарушений в клетках данной опухоли, что, возможно, в перспективе позволит персонифицировать лечение и повысит его эффективность.
Литература
- Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2008 году. Вестник РОНЦ им. Н.Н. Блохина РАМН. 2010;21(2):160. Прил. 1.
- Румянцев П.О., Ильин А.А., Румянцева У.В., Саенко В.А. Рак щитовидной железы. Современные подходы к диагностике и лечению. М., 2009.
- O'Neill C.J., Oucharek J., Learoud D., Sidhu S.B. Standard and emerging therapies for metastatic differentiated thyroid cancer. Oncologist. 2010:15(2):146–56.
- Sherman S.I. Thyroid carcinoma. Lancet. 2003;361:501–11.
- Cooper D.S., Doherty G.M., Haugen B.R., et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2009;19(11):1167–214.
- Perros P., et al. British Thyroid Association Royal College of Physicians; Report of the Thyroid Cancer Guidelines Update Group. Guidelines for the Management of Thyroid Cancer. Second Edition. London: London Royal College of Physicians; 2007. Р. 1–92.
- Mazzaferri E.L., Jhiang S.M. Long-term impact of initial surgical and medical therapy on papillary and follicular thyroid cancer. Am. J. Med. 1994;97(5):418–28.
- Eustatia-Rutten C.F., Corssmit E.P., Biermasz N.R., et al. Survival and death causes in differentiated thyroid carcinoma. J. Clin. Endocrinol. Metab. 2006;91:313–19.
- Hoie J., Stenwig A.E., Kullmann G., Lindegaard M. Distant metastases in papillary thyroid cancer: a review of 91 patients. Cancer. 1988;61:1–6.
- Durante C., Haddy N., Baudin E., Leboulleux S., et al. J. Clin. Endocrinol. Metab. 2006;91(8):2892–99.
- Pittas A.G., Adler M., Fazzari M., et al. Bone metastases from thyroid carcinoma: clinical characteristics and prognostic variables in one hundred forty-six patients. Thyroid. 2000;10:261–68.
- Jonklaas J., Sarlis N.J., Litofsky D., et al. Outcomes of patients with differentiated thyroid carcinoma following initial therapy. Thyroid. 2006;16(12):1229–42.
- Casara D., Rubello D., Saladini G., et al. Different features of pulmonary metastases in differentiated thyroid cancer: Natural history and multivariate statistical analysis of prognostic variables. J. Nucl. Med. 1993;34:1626–31.
- Hodak S.P., Carty S.E. Radioiodineresistant differentiated thyroid cancer: hope for the future. Oncology. 2009;9:775–76.
- Gottlieb J.A., Hill C.S. Jr. Chemotherapy of thyroid cancer with adriamycin. Experience with 30 patients. N. Engl. J. Med. 1974;290(4):193–97.
- Shimaoka K., Schoenfeld D.A., DeWys W.D., et al. A randomized trial of doxorubicin versus doxorubicin plus cisplatin in patients with advanced thyroid carcinoma. Cancer. 1985;56:2155–60.
- Williams SD, Birch R, Einhorn LH. Phase II evaluation of doxorubicin plus cisplatin in advanced thyroid cancer: A Southeastern Cancer Study Group trial. Cancer. Treat. Rep. 1986;70:405–07.
- Sherman S.I. Early clinical studies of novel therapies for thyroid cancers. Endocrinol. Metab. Clin. North. Am. 2008;37:511–24.
- Nikiforova M.N., Nikiforov Y.E. Molecular genetics of thyroid cancer: Implications for diagnosis, treatment and prognosis. Expert Rev. Mol. Diagn. 2008;8:83–95.
- Xing M. BRAF mutation in papillary thyroid cancer: Pathogenic role, molecular bases, and clinical implications. Endocr. Rev. 2007;28:742–62.
- Knauf J.A., Fagin J.A. Role of MAPK pathway oncoproteins in thyroid cancer pathogenesis and as drug targets. Curr. Opin. Cell. Biol. 2009;21:296–303.
- Elisei R., Ugolini C., Viola D., et al. BRAF(V600E) mutation and outcome of patients with papillary thyroid carcinoma: A 15-year median follow-up study. J. Clin. Endocrinol. Metab. 2008;93:3943–49.
- Xing M., Westra W.H., Tufano R.P., et al. BRAF mutation predicts a poorer clinical prognosis for papillary thyroid cancer. J. Clin. Endocrinol. Metab. 2005;90:6373–79.
- Riesco-Eizaguirre G., Gutierrez-Martinez P., Garcia-Cabezas M.A., et al. The oncogene BRAF V600E is associated with a high risk of recurrence and less differentiated papillary thyroid carcinoma due to the impairment of Na+/I- targeting to the membrane. Endocr. Relat. Cancer. 2006;13:257–69.
- Durante C., Puxeddu E., Ferretti E., et al. BRAF mutations in papillary thyroid carcinomas inhibit genes involved in iodine metabolism. J. Clin. Endocrinol. Metab. 2007;92:2840–43.
- Romei C., Ciampi R., Faviana P., et al. BRAFV600E mutation, but not RET/PTC rearrangements, is correlated with a lower expression of both thyroperoxidase and sodium iodide symporter genes in papillary thyroid cancer. Endocr. Relat. Cancer. 2008;15:511–20.
- Liu Z., Hou P., Ji M., et al. Highly prevalent genetic alterations in receptor tyrosine kinases and phosphatidylinositol 3-kinase/Akt and mitogen-activated protein kinase pathways in anaplastic and follicular thyroid cancers. J. Clin. Endocrinol. Metab. 2008;93:3106–16.
- Santarpia L., El-Naggar A.K., Cote G.J., et al. Phosphatidylinositol 3-kinase/Akt and Ras/Raf-mitogen-activated protein kinase pathway mutations in anaplastic thyroid cancer. J. Clin. Endocrinol. Metab. 2008;93:278–84.
- Sherman S.I., Wirth L.J., Droz J.P., et al. Motesanib diphosphate in progressive differentiated thyroid cancer. N. Engl. J. Med. 2008;359:31–42.
- Pennell N.A., Daniels G.H., Haddad R.I., et al. A phase II study of gefitinib in patients with advanced thyroid cancer. Thyroid. 2008;18:317–23.
- Cohen E.E., Rosen L.S., Vokes E.E., et al. Axitinib is an active treatment for all histologic subtypes of advanced thyroid cancer: Results from a phase II study. J. Clin. Oncol. 2008;26:4708–13.
- Gupta-Abramson V., Troxel A.B., Nellore A., et al. Phase II trial of sorafenib in advanced thyroid cancer. J. Clin. Oncol. 2008;26:4714–19.
- Kloos R.T., Ringel M.D., Knopp M.V., et al. Phase II trial of sorafenib in metastatic thyroid cancer. J. Clin. Oncol. 2009;27:1675–84.
- Hoftijzer H.C., Heemstra K.A., Morreau H., et al. Beneficial effects of sorafenib on tumor progression, but not on radioiodine uptake, in patients with differentiated thyroid carcinoma. Eur. J. Endocrinol. 2009;161(6):923–31.
- Castellone M.D., Carlomagno F., Salvatore G., et al. Receptor tyrosine kinase inhibitors in thyroid cancer. Best Pract. Res. Clin. Endocrinol. Metab. 2008;22:1023–38.
- Polverino A., Coxon A., Starnes C., et al. AMG 706, an oral, multikinase inhibitor that selectively targets vascular endothelial growth factor, platelet-derived growth factor, and Kit receptors, potently inhibits angiogenesis and induces regression in tumor xenografts. Cancer. Res. 2006;66:8715–21.
- Castellone M.D., Carlomagno F., Salvatore G., et al. Receptor tyrosine kinase inhibitors in thyroid cancer. Best Pract Res Clin. Endocrinol. Metab. 2008;22:1023–38.
- Stommel J.M., Kimmelman A.C., Ying H., et al. Coactivation of receptor tyrosine kinases affects the response of tumor cells to targeted therapies. Science. 2007;318:287–90.
- Brose M.S., Nutting C.M., Sherman S.I., et al. Rationale and design of DECISION: a double-blind, randomized, placebo-controlled phase III trial evaluating the efficacy and safety of sorafenib in patients with locally advanced or metastatic radioactive iodine (RAI)-refractory, differentiated thyroid cancer. BMC Cancer. 2011;11:349 http://www.biomedcentral.com/1471-2407/11/349
- Brose M.S., Nutting C.M., Jarzab B., et al. Sorafenib in locally advanced or metastatic patients with radioactive iodine-refractory differentiated thyroid cancer: The phase III DECISION trial. Presented at ASCO 2013. J. Clin. Oncol. 2013;31(suppl): Abstract 4.
- Lopez J.P., Wang-Rodriguez J., Chang C.Y., et al. Gefitinib (Iressa) potentiates the effect of ionizing radiation in thyroid cancer cell lines. Laryngoscope. 2008;118:1372–76.
- Lopez J.P., Wang-Rodriguez J., Chang C., et al. Gefitinib inhibition of drug resistance to doxorubicin by inactivating ABCG2 in thyroid cancer cell lines. Arch. Otolaryngol. Head. Neck. Surg. 2007;133:1022–27.
Об авторах / Для корреспонденции
И.С. Романов – ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» РАМН; e-mail: drromanov@mail.ru






