Рак щитовидной железы (РЩЖ) – сравнительно редкое злокачественное заболевание. Но при этом, например, в 2008 г. в России взяты на онкологический учет почти 9000 больных с таким вновь установленным диагнозом [1]. Высокодифференцированные формы рака щитовидной железы (ВДРЩЖ) (папиллярная и фолликулярная аденокарциномы) составляют 90–95 % всех случаев РЩЖ [2–4]. Стандартное лечение ВДРЩЖ обычно включает экстрафасциальную тиреоидэктомию, радиойодтерапию и заместительную терапию L-тироксином [5, 6]. Результаты лечения ВДРЩЖ достаточно успешные, в частности 10-летняя выживаемость превышает 85 % [7, 8]. Но у части больных ВДРЩЖ (10–15 %) выявляются отдаленные метастазы, причем у половины этих пациентов они выявляются уже при первичном лечении [3, 9, 10]. Прогноз для этой группы пациентов менее благоприятный, и 10-летняя выживаемость падает до 40 % [3, 11, 12]. Наиболее часто отдаленными метастазами при ВДРЩЖ поражаются легкие (до 70 %). Кроме того, отдаленные метастазы обнаруживаются в костях (до 44 %), головном мозге, надпочечниках и печени. Около 20 % больных имеют множественное полиорганное поражение (обычно это легкие и кости) [10, 11].
Радиойодтерапия (радиоактивным йодом-131) – основной метод лечения данной группы пациентов, позволяя части из них достичь 90 % 10-летней выживаемости без прогрессирования [10, 13]. Но у 25–66 % больных ВДРЩЖ с отдаленными метастазами первично или в процессе лечения развивается их частичная или полная резистентность к терапии радиоактивным йодом-131 (с 10-летней выживаемостью около 10 %) [10, 14]. Применение стандартной цитотоксической терапии этих больных дает крайне плохие результаты [15–17]. Именно пациенты с радио-йодрезистентыми ВДРЩЖ нуждаются в новых эффективных методах лечения. Изучение молекулярной биологии РЩЖ выявляет все большее количество мишеней, что может обеспечить прорыв в лечении этих пациентов [18].
Потенциальные молекулярные мишени
Как при папиллярной, так и при фолликулярной форме ВДРЩЖ очень распространены соматические мутации. При папиллярном раке (ПРЩЖ) наиболее распространены три мутации. Мутация B изоформы RAF-киназы (BRAF-мутация) выявляется примерно в 45 %, RAS-мутация выявляется в 15 % и перестройка RET/PTC обнаруживается в 20 % случаев [19]. Все эти мутации ведут к регуляции RAS/BRAF/MAPK/ERK-пути, который и вовлечен в канцерогенез РЩЖ.
BRAF-мутация чаще других выявляется при ПРЩЖ. Более чем в 90 % BRAF-мутаций выявляется точка мутации T1799A, которая ведет к замене аминокислоты в V600E (валина на глутамин). Это приводит к активации BRAF-киназы, и следовательно, к активации нижележащего пути [20, 21]. Хотя эти данные не подтверждаются всеми исследованиями, считается, что эта мутация связана с высоким риском развития рецидива и плохим прогнозом заболевания [22, 23]. В частности, считается, что BRAF-мутация связана с нарушением работы натрий-йодного симпортера, снижая способность тироцита к накоплению йода и приводя к развитию последующей радиойодрефрактерности [24–26].
При фолликулярном раке наиболее распространены RAS-мутации (45 %), PAX8-PPAR-γ генетические перегруппировки (35 %) и мутации, вовлекающие фосфатидилинозитол 3-киназой (PI3K) активирующийся путь (10 %) [19]. PI3K-активирующийся путь служит альтернативой MAPK-пути. При анапластическом раке щитовидной железы или агрессивных формах ВДРЩЖ распространены мутации, регулирующие оба эти пути [27, 28]. Соответственно, эти мутации также являются целью для современной таргетной терапии ВДРЩЖ.
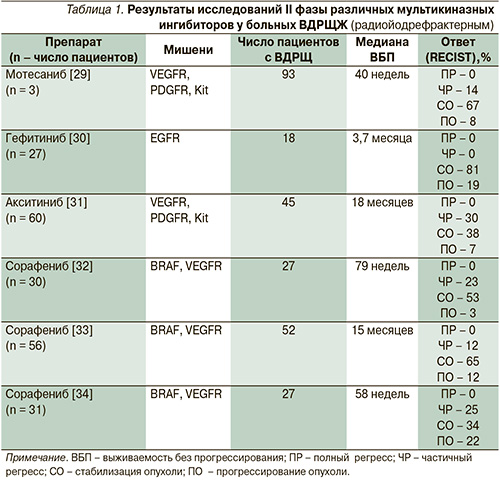
Современные таргетные препараты, направленно воздействующие на эти специфические мутации, включают тирозинкиназные ингибиторы (ТКИ) и ингибиторы ангиогенеза. Исследуются также препараты, которые могут восстанавливать накопление радиоактивного йода. У многих из них механизмы действия перекрываются. Так, например, ТКИ могут подавлять ангиогенез и улучшать поглощение радиоактивного йода. Большинство современных исследований сосредоточено на ТКИ. Результаты исследований II фазы ТКИ представлены в табл. 1.
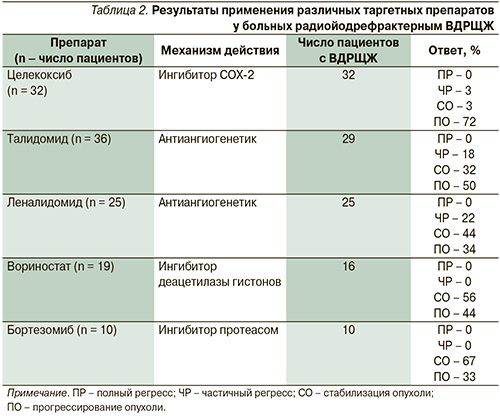
Опубликованные результаты исследований других новых препаратов приведены в табл. 2.
К результатам данных исследований следует относиться с осторожностью.
В большинство исследований включены больные различными гистологическими формами РЩЖ (например, медуллярный, анапластический и ВДРЩЖ). Надо учитывать, что это были исследования II фазы, т.е. не имели контрольных групп сравнения.
Тирозинкиназные ингибиторы
Тирозинкиназные ингибиторы – это малые молекулы, которые соединяются с АТФ-связывающимся доменом, таким образом конкурируя с АТФ внутри клетки, предотвращая фосфорилирование тирозиновых остатков внутриклеточных белков, тем самым блокируя дальнейшую передачу сигнала к ядру клетки. Связываемая часть схожа для различных тирозинкиназ, и хотя лекарство может блокировать конкретную тирозинкиназу, при этом, вероятно, оно оказывает подавляющее действие на множество тирозинкиназ [35]. Из-за того, что большинство злокачественных опухолей обладает множественными мутациями с регуляцией нескольких молекулярных путей, эта высокая степень перекрестной активности тирозинкиназ может быть клинически выгодной. Большинство ТКИ, применяемых в исследованиях, подавляют несколько тирозинкиназ.
В большей степени повышенный клинический интерес вызывают ТКИ «широкого спектра», связанные с сосудистой пролиферацией (VEGF, PDGF). Каждое из этих лекарств имеет т.н. полумаксимальную подавляющую концентрацию (IC50) для каждой специфической мишени, термин, применяемый для сравнения различных ТКИ. К примеру: Мотесаниб обладает IC50 2нМоль/л для VEGFR-1, 6 нМоль/л для Kit, 59 нМоль/л для RET и 83 нМоль/л для PDGFR [36].
Но даже при использовании таких ТКИ «широкого спектра» из-за активации альтернативных тирозинкиназ или молекулярных путей опухоли могут быть рефрактерными к применению ТКИ. Предполагается, что комбинация ТКИ с широким спектром мишеней может быть более эффективной, чем применение одного препарата, из-за подавления большего количества молекулярных путей [38].
Одной из перспектив применения ТКИ при радиойодрефрактерном ВДРЩЖ служит возможность повысить чувствительность данного вида опухоли к традиционным видам лечения. Несмотря на то что клинических данных, подтверждающих этот эффект, не опубликовано, есть данные исследований in vitro, согласно которым использование ТКИ может повысить поглощение радиоактивного йода и чувствительность к доксорубицину [41, 42].
За последние годы были опубликованы результаты не менее 6 исследований II и одного III фаз применения ТКИ при ВДРЩЖ с непосредственными результатами лечения [29–34, 39, 40].
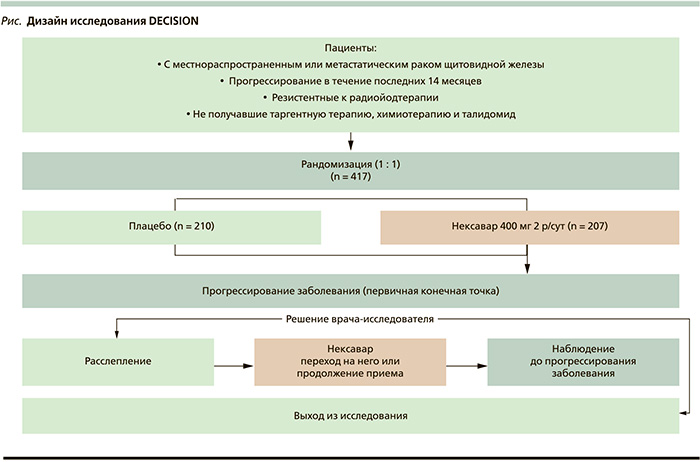
На съезде ASCO-2013 представлены результаты клинического исследования III фазы применения сорафениба при ВДРЩЖ, резистентного к радиоактивному йоду (DECISION). Дизайн исследования представлял собой двойное рандомизированное исследование. В исследуемую группу пациентов, получавших сорафениб 400 мг 2 раза в сутки, были включены 207 больных. В контрольную – 210. Критерий включения пациентов в исследование: гистологически доказанный местнораспространенный или метастатический дифференцированный РЩЖ, резистентный к лечению радиоактивным йодом.
Критерии радиойодрезистентности:
- наличие по крайней мере одного очага, не накапливающего йод;
- прогрессирование заболевания после введения радиоактивного йода в терапевтической дозе (100 мКи и более);
- кумулятивная доза радиоактивного йода 600 мКи и более;
- прогрессирование заболевания в течение последних 14 месяцев (по RECIST).
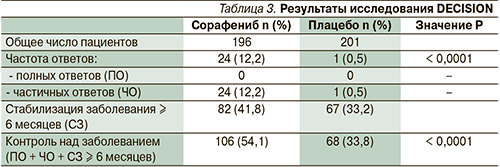
Важным условием было адекватное подавление уровня тиреотропного гормона < 0,5 мМЕ/л). На рисунке представлен дизайн исследования. После выявления прогрессирования дизайн исследования предполагал расслабление лечения и переход на терапию сорафенибом по решению врача-исследователя. С учетом дизайна исследования ее первичной конечной точкой была оценка выживаемости без прогрессирования. При сравнении медианы выживаемости без прогрессирования было обнаружено значительное ее увеличение (10,8 против 5,8 месяца) в группе пациентов, получавших сорафениб (HR – 0,59; 95 % ДИ – 0,45–0,76; p < 0,0001). В табл. 3 представлены непосредственные результаты лечения. При сравнении видно, что в исследуемой группе с применением сорафениба достигнута частота ответов 12,2 против 0,5 % в группе плацебо (p < 0,0001).
Таким образом, на сегодняшний день сорафениб стал первым препаратом, доказавшим свою терапевтическую эффективность в отношении больных ВДРЩЖ, рефрактерных к радиойодтерапии.
Мы ожидаем, что в ближайшем будущем появятся другие эффективные таргетные препараты, а также их комбинации для лечения радио-йодрезистентных форм ВДРЩЖ. Необходимо изучать профиль генетических нарушений в клетках данной опухоли, что, возможно, в перспективе позволит персонифицировать лечение и повысит его эффективность.


