Удельный вес психоорганической патологии растет как среди детей, так и среди взрослых. Комплексная реабилитация обычно дополняется медикаментозной терапией, создающей благоприятный фон для немедикаментозных методов лечения и усиливающей их эффект за счет активации метаболических процессов в нервной системе. К сожалению, нейрометаболиты имеют ряд ограничений – для многих медикаментов стимулирующего типа характерны побочные эффекты в виде раздражительности, возбужденности, агрессивности, а иногда угрозы возникновения судорожных приступов. Применение их также ограничено временными интервалами и постепенным привыканием организма с уменьшением ожидаемой эффективности лечения [1].
Актуальность включения в схему лечения различной психоневрологической патологии детства лекарств, обладающих ноотропным и нейротрофическим эффектами, связана с высокой пластичностью мозга ребенка, возможностью возрастзависимой компенсации и, следовательно, уменьшения степени выраженности неврологического дефицита [2]. Однако существует ряд особенностей терапии и реабилитации детей, связанных как с объективными, так и с субъективными причинами. К первым относятся возрастные, идиопатические и дозозависимые ограничения. Ко вторым – особенности психологии родителей: нежелание «кормить ребенка таблетками вообще», «пугающие» побочные эффекты и обсуждение возможных «ужасов» от лечения на интернет-форумах с далекими от медицины персонами. В таких условиях минимизация медикаментозной терапии с максимально широкими положительными эффектами и относительной безвредностью применяемого препарата гарантирует приверженность пациента к лечению и, соответственно, качество реабилитации.
Выбор и применение тех или иных препаратов определяются характером имеющихся нарушений, степенью их выраженности, возрастом и индивидуальной реакцией ребенка. Поскольку при заболеваниях нервной системы у детей первых лет жизни ведущим является нарушение созревания отдельных функциональных систем, медикаментозная терапия должна быть направлена прежде всего на стимуляцию нормального развития мозга. С этой целью применяют медикаментозные средства, улучшающие обмен веществ в нервной системе. Изучению эффективности применения различных ноотропных препаратов за последние десятилетия посвящены исследования многих отечественных и зарубежных ученых.
В частности, исследованию механизмов действия гопантеновой кислоты как производного одного из главных медиаторов мозга человека посвящены разнообразные работы. Л.С. Чутко [3] (2012) описаны проблема школьной дезадаптации и возможности нейротрофической коррекции этого состояния с помощью Пантокальцина (гопатеновая кислота). Обзор К.В. Воронковой (2011) [4] современной литературы по когнитивным нарушениям различного генеза подтверждает эффективность и безопасность применения Пантокальцина в решении этой проблемы. Статьи Н.Н. Заваденко (2006) [5], В.Б. Сосиной (2006) [6], Н.А. Коровиной (2006) [7], А.Ф. Тумашенко (2006) [8], Н.М. Мусатовой (2006) [9], Н.В. Муратовой (2007) [10], Т.А. Лазебник (2010) [11], Е.А. Морозовой (2011) [12] посвящены применению Пантокальцина при психоневрологической патологии у детей и взрослых, в частности при синдроме дефицита внимания и гиперактивности, вегето-сосудистой дистонии, экстрапирамидных расстройствах, нарушениях речи и старческой деменции. Проблема энуреза и возможности применения Пантокальцина при этом расстройстве освещена в работах В.И. Бородина (2006) [13] и Т.В. Отпущенковой (2009) [14].
Механизм действия препарата основан на сходстве химической формулы с гамма-аминомасляной кислотой (ГАМК), являющейся одним из естественных медиаторов центральной нервной системы (ЦНС). Фармакологическая эффективность связана с прямым влиянием на ГАМКb – рецепторно-канальный комплекс и активирующим влиянием на образование ацетилхолина. Гопантеновая кислота в отличие от ГАМК (благодаря присутствию в ее молекуле пантоильного радикала) проникает через гематоэнцефалический барьер и оказывает выраженное воздействие на функциональную активность ЦНС. Поступление препарата в мозг достигает максимума через 60 минут, после чего он кумулируется преимущественно в клетках коры головного мозга, подкорковых структурах, мозжечке. Пантокальцин выводится из организма в неизменном виде, что также снижает риск развития дозозависимых и накопительных осложнений терапии.
Гопантеновая кислота имеет много точек приложения в клеточном метаболизме, что обусловливает широкий спектр фармакологического действия. Так, препарат улучшает утилизацию глюкозы, обмен нуклеиновых кислот, активирует синтез АТФ, белка и РНК, т.е. стимулирует анаболические процессы в нейронах головного мозга. Косвенное нейрометаболическое действие препарата связано с улучшением микроциркуляции в головном мозге за счет оптимизации пассажа эритроцитов через сосуды микроциркуляторного русла и ингибирования агрегации тромбоцитов. Наряду с нейрометаболическим действием препарат оказывает антигипоксическое и антиоксидантое воздействия. Восстанавливая ГАМК-зависимую нейротрансмиссию, гопантеновая кислота приводит к улучшению биоэлектрической активности и интегративной деятельности мозга, улучшению памяти, восприятия, внимания, мышления, повышению способности к обучению, активации интеллектуальных функций и по той же причине не противопоказана при эпилепсии, что служит ее большим преимуществом по сравнению с другими препаратами нейротрофического ряда. Побочные эффекты препарата встречаются крайне редко и выражаются в виде аллергических реакций (кожного зуда, крапивницы и аллергического ринита).
Пантокальцин не имеет возрастных противопоказаний, что делает его востребованным в педиатрической практике. С учетом всех положительных свойств препарата его применение возможно практически при любой психоневрологической патологии детского возраста.
Собственный опыт применения Пантокальцина при различной психоневрологической патологии детского возраста
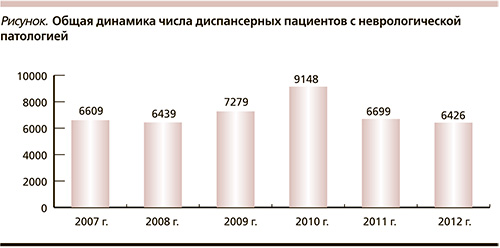
Число детей диспансерной группы с патологией нервной системы (Воронеж) в динамике за последние 6 лет представлено на рисунке.
Как видно из приведенной диаграммы, за последние несколько лет наметилась положительная динамика в числе пациентов, наблюдающихся по поводу неврологической патологии, однако число пациентов остается достаточно большим.
Задержка речевого развития
Одной из массовых причин обращения к неврологу остается задержка речи у детей в возрасте от года до 5 лет. Пик этого заболевания приходится на возраст 2,5–3,5 года. Нередко задержка речевого развития является составной частью общего психоневрологического дефицита, но в большинстве случаев носит характер парциального отклонения в развитии. Нейропротекторная терапия актуальна в большинстве случаев, исключая такие редкие состояния, как эпилептическая энцефалопатия (в частности, синдром Ландау–Клеффнера), истинный аутизм и орфанные заболевания, сопряженные с регрессом психического развития (например, болезнь Ретта). По нашим данным, доля таких заболеваний в структуре задержек речевого развития не превышает 3 %. В остальных случаях необходима ноотропная терапия, стимулирующая и поддерживающая нервную систему ребенка в критические периоды развития.
Мы проанализировали 120 случаев задержки речевого развития у детей в возрасте от 3 до 5 лет. Соотношение парциальной задержки речи (92) и задержки речи в структуре общего психоневрологического дефицита (28) в исследуемой группе составило 3,2 : 1,0. В 98 % (118) случаев применялась нейропротекторная терапия Пантокальцином в дозе 30–40 мг/кг массы тела в сутки. В двух случаях при обследовании были выявлены нарушения, повлекшие исключение пациентов из исследуемой группы (1 – высокий индекс эпилептической активности на электроэнцефалограмме, 1 – аутистический характер поведения). Кроме того, у трети (39; 33,1 %) детей задержка речи сочеталась с гиперактивным поведением, поэтому требовалась добавочная легкая седативная терапия (Тенотен детский, персен, Магне В6).
В связи с тем что данный вид расстройства невозможен без развивающих упражнений, занятий мелкой моторикой, психологических вариаций и социально-психологических условий для развития речи, применение ноотропов носит характер «стимулирующей подушки», на базе которой необходимо выстроить доминанту развития речи. Этот процесс носит достаточно длительный характер и требует в идеале планомерной ежедневной совокупной работы ребенка, родителей, психолога, невролога и логопеда. Поэтому курс Пантокальцина составил в среднем 2,5 месяца (от 2 до 3 месяцев).
В 83,1 % (98 из 118) случаев родители полностью соблюдали рекомендации врача и в 74,5 % (73 из 98) отметили выраженные сдвиги в развитии речи у детей на фоне улучшения поведения и сна. Остальные 25 пациентов показали менее выраженные результаты по истечении 3 месяцев, однако положительная динамика наблюдалась во всех случаях. Отсутствие приверженности терапии со стороны родителей 20 (из118) пациентов не позволили нам с достоверностью оценить результаты лечения.
Эпилепсия и неэпилептические пароксизмальные состояния
Неспровоцированные пароксизмы ежегодно отмечаются у 56,8 человека на 100 тыс. в год, у 23,5 на 100 тыс. в год – это единственный неспровоцированный приступ. В течение жизни хотя бы один пароксизм переносят 5 % населения жизни [15]. Пароксизмы, разворачивающиеся в детском возрасте, клинически более разнообразны, значительная их часть является эпилептическими приступами. К другим, неэпилептическим, относятся обмороки, аффективно-респираторные припадки, синкопы, метаболические судороги, парасомнии и др. В зависимости от этиологии этих состояний для лечения детей применяются различные группы препаратов – психостимуляторы, трициклические антидепрессанты, нейролептики, комбинированные препараты, антиэпилептические средства и т.д. В большинство схем лечения включены нейропротективные лекарства, что непосредственно связано с возрастными особенностями нервной системы детей [16–19].
Как было показано в нашем исследовании [20] (Е.А. Балакирева, 2010), включившем 363 пациента с пароксизмальными состояниями различного генеза, 76 % (276) после трех дней, отведенных на установление клинического диагноза в соответствии со стандартами, необходимо было начать терапию с применением инъекционных лекарственных средств, не установив окончательно этиологию приступов. Кроме того, 47 % (171) лечение должно было проводиться в течение первичного стационарного пребывания без окончательной верификации диагноза. Таким образом, в течение первого стационарного курса возникает необходимость назначения препаратов, не противопоказанных ни при одном из видов пароксизмальных состояний, соответственно, они могут применяться независимо от этиологии и клиники пароксизмов. Разработанный нами алгоритм (Е.А. Балакирева, 2012) [21] включал курс инъекций Кортексина с последующей поддерживающей терапией Пантокальцином в дозе 30–40мг/кг массы/сут на месяц. Выраженное уменьшение частоты пароксизмальных состояний неэпилептического генеза, улучшение поведенческих и диссомнических расстройств отмечено среди 76 % (189 из 248) пациентов. Положительную динамику в поведении и нарушениях сна у детей с эпилептическими приступами констатировали 48 % (28 из 59) родителей.
В 42 % (152) случаев курс Пантокальцина был повторен через 3 месяца для детей как с эпилептическими, так и с неэпилептическими пароксизмальными состояниями. Положительный эффект от применяемой схемы отмечен в 100 % случаев.
Тики
Распространенность тикозного гиперкинеза, по разным литературным данным, варьируется в достаточно большом референтном интервале – от 5 до 25 % [22–24].
Суммируя литературные данные, можно сказать, что этиопатогенетические факторы тиков обязательно включают генетический (тикозное расстройство наследуется по аутосомнодоминантному типу с низкой пенетрантностью), социально-психологический (средовой) и нейрохимический.
Соблюдая принцип подбора наименьшей эффективной и безопасной дозы лекарственной терапии, нами поэтапно были опробованы различные легкие и средние седативные препараты в группе из 138 пациентов в возрасте от 3 до 12 лет (М : Ж – 1,3 : 1,0), страдавших острым и хроническим тикозным расстройством в виде локального тика (мимическая мускулатура, изолированное поперхивание, мигательный тик). Начальная монотерапия Пантокальцином курсом 1–3 месяца стала эффективной в группе детей с острыми тикозными расстройствами – 21 % (29).
Улучшение наступало с первых дней применения, что можно объяснить умеренным седативным эффектом препарата. Полное купирование гиперкинезов происходило у всех детей к концу второй недели применения, когда, очевидно, в действие вступал накопительный ноотропный эффект лекарственного средства. В 27 % (37) случаев полного эффекта добиться не удалось, но положительную динамику отметили большинство (27) пациентов. В остальных случаях избежать политерапии не удалось. Таким образом, почти в половине (48 %) случаев у детей с тикозным расстройством преимущественно легкой степени тяжести Пантокальцин оказался эффективным в монотерапии.
Заключение
Наш опыт применения Панто-кальцина детьми с различными отклонениями в нервной системе показал, что препарат хорошо переносится пациентами и эффективен для коррекции психоневрологических симптомов даже в монотерапии.


