Введение
В течение многих лет нестероидные противовоспалительные препараты (НПВП), глюкокортикоиды (ГК) и иммунодепрессанты были основой терапии ревматических болезней. Ситуация кардинально изменилась с появлением генно-инженерных биологических препаратов (ГИБП), которые, воздействуя на основные механизмы, позволили добиться ремиссии заболевания [1, 2]. Терапия внутривенным человеческим иммуноглобулином (ВВИГ) была и продолжает оставаться жизненно необходимой при ряде заболеваний [3].
Иммуноглобулины – белки плазмы – секретируются плазмоцитами, формирующими главное звено адаптационной иммунной системы. Терапевтический ВВИГ состоит из нормальных поликлональных полиспецифичных иммуноглобулинов (Ig) (главным образом IgG) и изготавливается из человеческой плазмы, каждая партия которого – результат обработки крови от 10–20 тыс. доноров. Конечный продукт содержит антитела к чужеродным антигенам, собственным антигенам (естественные аутоантитела) и к другим антителам (идиотипические антитела) [4, 5]. Впервые ВВИГ был использован в 1950-х гг. для лечения заболеваний с первичным иммунодефицитом [6] и применялся подкожно или внутримышечно. В настоящее время Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration – FDA) одобрило около 12 различных составов ВВИГ [5]. На сегодня на российском фармацевтическом рынке ВВИГ представлен более чем 20 препаратами.
Механизм действия
С момента введения ВВИГ в клиническую практику частота тяжелых инфекций (например, менингита, остеомиелита или лобарной пневмонии) резко снизилась [6]. Но терапевтический эффект ВВИГ не может быть объяснен только заместительной терапией.
Предполагаемые механизмы действия ВВИГ включают взаимодействие с антиидиотипической сетью, системами комплемента и цитокинов; подавление провоспалительных цитокинов, таких как ФНО-α, ИЛ-1α, ИЛ-6; снижение экспрессии молекул адгезии [7] и потребления компонентов комплемента (С3а, С3b, C4b и C5a) [8]; увеличение в крови уровня противовоспалительных цитокинов (ИЛ-10), цитолиз клеток-мишеней посредством комплемент- и антителозависимой клеточно-опосредованной цитотоксичности и индукции апоптоза клеток-мишеней через рецепторы Fc-фрагмента, а также сиализацию Fc-фрагмента IgG; нейтрализацию патогенных аутоантител и модуляцию молекул активации и костимуляции, влияющих на дифференцировку Т-, В- и дендритных клеток [5, 9–12]. Внутривенный человеческий иммуноглобулин подавляет экспансию аутореактивных В-лимфоцитов через FcgRIIB-сигнальный путь, идиотипопосредованное ингибирование рецепторов В-клеток и нейтрализацию цитокинов – таких, например, как фактор активации В-клеток (BAFF и APRIL) [11].
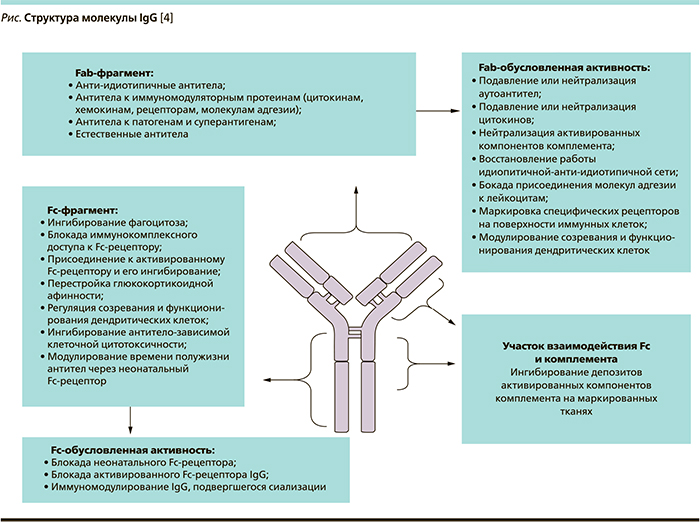
В зависимости от вида молекулы, с которой взаимодействует ВВИГ, последний может оказывать как противовоспалительный, так и провоспалительный эффект. Противовоспалительная активность проявляется при назначении высоких доз ВВИГ, тогда как провоспалительная, включая активацию компонентов комплемента или присоединение IgG через рецептор (R) Fc-фрагмента, в частности, к клеткам-эффекторам врожденного иммунитета, наблюдается при низких дозах. Другие механизмы действия запускаются в зависимости от участия в реакциях Fab- или Fc-фрагмента иммуноглобулина (см. рисунок).
Оба фрагмента могут обусловливать как противовоспалительную, так и иммуномодуляторную активность ВВИГ [4, 13]. Y. Kaneko и соавт. [14] показали, что модуляция гликозилирования иммуноглобулина in vivo может выдвигаться как терапевтическая стратегия лечения хронических воспалительных аутоиммунных заболеваний, в т.ч. ревматоидного артрита, но эффективность на практике пока не доказана.
Способность ВВИГ нейтрализовывать активированные компоненты комплемента (в т.ч. С3а) обеспечивает теоретические предпосылки применения ВВИГ при всех заболеваниях, в патогенезе которых система комплемента играет ведущую роль. С учетом широкого спектра таких болезней, дорогостоящего производства ВВИГ современные показания должны ограничиваться жизнеугрожающими состояниями. Это прежде всего инсульт, занимающий третье место в смертности и одна из наиболее распространенных причин инвалидизации в мире [15]. В 70–80 % случаев церебральный инфаркт обусловлен окклюзией артерии (наиболее часто – средней мозговой) с последующей нейрональной ишемией, активацией системы комплемента и воспалением in situ. В моделях на мышах применение ВВИГ в дозе 2 г/кг веса первые 3 часа после инсульта практически исключало смертельный исход, приводило к редукции зоны ишемии на 60 % и уменьшению неврологического дефицита в 2–3 раза по сравнению с группой контроля, подобный эффект сохранялся при назначении ВВИГ 0,5 г/кг веса [5, 16].
Еще одним свойством ВВИГ является снижение резистентности к ГК. Подобные состояния описаны при различных аутоиммунных и воспалительных заболеваниях, в связи с чем ВВИГ может играть ключевую роль в лечении большинства этих состояний посредством улучшения рецептор-связывающей способности к ГК после 3–6 месяцев терапии за счет подавления продукции провоспалительных цитокинов [17].
Результаты применения ВВИГ: режим дозирования, преимущества, безопасность, нежелательные реакции
Дозировки, используемые для лечения аутоиммунных и воспалительных заболеваний, в 4–5 раз превышают таковые при иммунодефицитах. Наиболее часто назначаемая доза 2 г/кг веса тела вводится в течение от 2 до 5 дней 1 раз в месяц длительно (до достижения эффекта) и приводит к повышению уровня IgG в крови до 2500–3500 мг/дл [4].
Противопоказания к назначению ВИИГ: дефицит IgA, тромбофилия (относительное противопоказание, ВВИГ применяется с осторожностью), хроническая почечная недостаточность на поздней стадии, тяжелая сердечная недостаточность. В остальных случаях введение ВВИГ переносится хорошо и очень редко сопровождается развитием нежелательных реакций (НР) [18]. К непосредственным НР относятся головная боль, гиперемия лица, дисфория, тяжесть в груди, лихорадка, озноб, миалгии, слабость, диспноэ, боль в спине, тошнота, рвота, диарея, изменения артериального давления, тахикардия и анафилактические реакции, особенно у пациентов с дефицитом IgA. Непосредственные НР появляются во время инфузии или в течение 30 минут после нее. Отсроченные НР развиваются позднее и включают острую почечную недостаточность, тромбоэмболию легких и другие тромботические осложнения, асептический менингит, нейтропению, гемолитическую анемию, псевдогипонатриемию, кожные реакции и единичные случаи артритов [18]. В большинстве случаев легкие НР не являются показанием к отмене лечения и их проявление проходит при снижении скорости введения препарата.
Для предотвращения НР на фоне инфузии рекомендуется проводить премедикацию НПВП антигистаминными препаратами или низкими дозами ГК – 100–200 мг гидрокортизона [19].
К одной из наиболее тяжелых НР при введении ВВИГ относится острая почечная недостаточность, которая развивается через несколько часов до 5 суток после инфузии и проявляется транзиторной олигоурией, что ведет к осмотическому повреждению клубочков. В некоторых случаях острая почечная недостаточность может потребовать проведения гемодиализа, но обычно полностью обратима и уровень креатинина возвращается к исходному в течение последующих 2 недель [18].
Механизм тромбоза на фоне ВВИГ остается неясным. Предполагают, что вязкость крови зависит от суммарной дозы ВВИГ и нарастает в течение месяца после введения препарата [20]. Кроме того, ВВИГ может усиливать агрегацию тромбоцитов, активировать коагуляционный каскад и приводить к ангиоспазму [21]. Для снижения риска тромбоэмболических осложнений при ревматических заболеваниях рекомендуется коррекция дозы (уменьшение дозы и скорости введения), назначение антитромботических препаратов.
Показания к назначению ВВИГ в ревматологии
Для каждого из показаний, одобренных FDA для назначения ВВИГ (см. таблицу) [4], были выполнены двойные слепые плацебо-контролируемые исследования эффективности и переносимости ВВИГ.
Для большинства показаний сведения об эффективности ВВИГ взяты из результатов небольших контролируемых исследований, клинических испытаний или личного опыта врачей. D. Pyne и соавт. [22] одними из первых систематизировали применение ВВИГ при аутоиммунных ревматических заболеваниях. За последнее десятилетие число назначений ВВИГ при ревматических болезнях значительно возросло. Отмечено более 150 случаев применения ВВИГ по незарегистрированным показаниям; 6781 пациенту, участвовавшему в клинических исследованиях, и 362 больным в отдельных случаях [23].
Болезнь Кавасаки
Болезнь Кавасаки впервые была описана в 1967 г. японским педиатром Томисаку Кавасаки как «острый лихорадочный кожно-слизистый синдром», развивающийся у маленьких детей, который в отсутствие лечения приводил к 100 %-ной летальности. За прошедшее время стало известно, что назначение ВВИГ детям с болезнью Кавасаки купировало кожно-слизистый синдром и предупреждало развитие аневризм коронарных артерий (АКА) [24].
Эффективность назначения ВВИГ при болезни Кавасаки подтверждена множеством наблюдений [3]. В 2003 г. в электронной базе данных Кохрейн R.Oates-Whitehead и соавт. [25] опубликовали обзор литературы по данной проблеме. Сравнительный мета-анализ различных режимов назначения ВВИГ показал неоспоримые преимущества однократного введения ВВИГ в больших дозах перед остальными способами дозирования препарата: на фоне однократного введения ВВИГ в дозе 2 г/кг веса в течение 30 дней отмечено достоверное снижение количества АКА [26].
По данным рандомизированного плацебо-контролируемого исследования (РПКИ) с участием 178 пациентов с острым течением болезни Кавасаки назначение комбинированного лечения ВВИГ и ГК достоверно улучшило течение и исход болезни, при этом не вызывая побочных эффектов. Другое РПКИ показало отсутствие эффективности повторного введения ВВИГ или дополнительного назначения инфликсимаба 24 ВВИГ-резистентным пациентам с острым течением болезни Кавасаки. На клеточном уровне внутривенное введение человеческого иммуноглобулина восстанавливает выявленные у пациентов с болезнью Кавасаки Т- и В-клеточные нарушения, особенно в отношении CD 5+ В-лимфоцитов [3].
Ювенильный дерматомиозит
До настоящего времени РПКИ эффективности и переносимости ВВИГ при ювенильном дерматомиозите (ЮДМ) не проводилось. Все данные взяты из открытых исследований без плацебо-контроля. Приводится описание 9 случаев применения ВВИГ при рефрактерном ЮДМ (наблюдались побочные эффекты или резистентность к традиционной терапии пациентов). После введения ВВИГ наблюдалось выраженное клиническое улучшение состояния всех пациентов, что в 6 случаях послужило основанием для уменьшения дозы ГК [3].
По данным ретроспективного исследования S.M. Al-Mayouf и соавт. [27], введение ВВИГ способствовало значительному снижению дозы ГК для 12 из 18 детей с ЮДМ, страдавших зависимостью или резистентностью к ГК. За 3 месяца доза ГК была снижена более чем на 50 % без клинических и биохимических признаков обострения заболевания. В заключение можно сказать, что ВВИГ эффективен при рефрактерном ЮДМ в качестве препарата второй линии, однако статистических доказательств в РПКИ не существует.
Системный вариант ювенильного идиопатического артрита, или Болезнь Стилла
В большинстве случаев информация по эффективности и переносимости ВВИГ при рефрактерной болезни Стилла исходит из результатов небольших неконтролируемых клинических испытаний и описаний случаев.
В одном исследовании у 4 из 7 пациентов с болезнью Стилла в течение в среднем 13 месяцев после от 1 до 8 введений ВВИГ наблюдалась клиническая ремиссия [28]. По данным открытого испытания S. Vignes и соавт. [29], примерно у половины пациентов (у 3 из 7) после (от 4 до 6 курсов) ВВИГ также наблюдалась длительная ремиссия.
В противоположность этому в исследовании A.M. Prieur и соавт. [30], несмотря на нормализацию лабораторных показателей 16 пациентов (снижение СОЭ, повышение уровня гемоглобина и купирование тромбоцитоза), клинических улучшений не наблюдалось.
Ретроспективный обзор литературы показал значительное улучшение для 27 пациентов, которые в течение от 3 до 54 месяцев ежемесячно получали ВВИГ, что проявлялось нормализацией температуры тела, снижением дозы ГК, но не было отмечено влияния на артриты [3].
Единственное рандомизированное двойное слепое плацебо контролируемое исследование было выполнено E.D. Silvermann и соавт. [31], включившее 31 пациента с рефрактерной болезнью Стилла. Пациенты получали 1,5 г/кг ВВИГ или плацебо (0,1 %-ный альбумин), препарат вводился каждые 2 недели в течение 2 месяцев, затем ежемесячно в течение 4 месяцев.
И хотя у большинства пациентов, получавших инфузии ВВИГ, наблюдалось улучшение, статистически они были не достоверны.
Системная красная волчанка
Сведения об эффективности и переносимости ВВИГ при СКВ исходят из небольших клинических исследований, обзоров ряда случаев и описаний отдельных случаев [3]. Авторы демонстрируют эффективность высоких доз ВВИГ в отношении различных проявлений системной красной волчанки (СКВ), таких как, миокардит, тампонада сердца, терминальная стадия почечной недостаточности, хорея, полирадикулопатия, поражение ЦНС, миелофиброз и пневмонит, панцитопения, гемолитическая анемия, тромбоцитопения, приобретенные (вторичные) ингибиторы VIII фактора свертывания крови, вторичная болезнь фон Виллебранда, истинная эритроцитарная аплазия, экссудативный плеврит и перикардит, гломерулонефрит, вторичные васкулиты [3, 4, 19].
Волчаночный нефрит – наиболее неблагоприятное и частое проявление СКВ. Применение ГК и цитостатиков больными СКВ сопряжено с риском развития инфекции, что служит одной из причин заболеваемости и смертности среди таких пациентов. В данной ситуации ВВИГ рассматривается как один из предпочитаемых методов одновременного лечения активности аутоиммунного заболевания и инфекции [32]. Y. Levy и соавт. [33] описали 7 пациентов с мембранозным или мембранознопролиферативным волчаночным гломерулонефритом, получивших от 1 до 6 курсов ВВИГ. Во всех случаях наблюдалось уменьшение протеинурии, улучшение длилось до 6 месяцев. Единственное небольшое пилотное рандомизированное исследование эффективности ВВИГ по сравнению с традиционным лечением циклофосфамидом включило 14 пациентов с мембранознопролиферативным нефритом, получавших в прошлом ГК и циклофосфамид, в течение 6 месяцев назначали или циклофосфамид, или ежемесячно ВВИГ. Уровень протеинурии и клиренс креатинина в двух группах достоверно не различался [3].
За последние десятилетия из-за нехватки донорских ресурсов и с целью уменьшения объема используемой крови были предприняты попытки изготовить болезнь-специфический ВВИГ, в частности, для СКВ [12]. Патогенные аДНК-специфичные В-лимфоциты при СКВ могут стать мишенью для целенаправленного терапевтического вмешательства. И одним из интенсивно изучаемых механизмов действия ВВИГ является регуляция антиидиотипичных антител, взаимодействующих с В-клетками и подавляющих патогенные идиотипы [9–11, 34]. Эти антиидиотипичные антитела могут ингибировать присоединение патогенных антител к соответствующим антигенам in vitro и снижать уровень антител in vivo [34, 35]. Другое возможное объяснение для положительного эффекта антиидиотипичных антител включает их негативный эффект на созревание В-клеток в антителопродуцирующие плазматические клетки in vitro [11] или на изменение Th2-клеточного ответа на Th1-ответ.

В своем исследовании Y. Shoenfeld и соавт. [35] предприняли попытки целевого молекулярного воздействия на аДНК при помощи специфических анти-аДНК антиидиотипичных антител, фракционированных из ВВИГ. После назначения препарата лабораторным мышам (NZBxW/F1 mice) отмечено достоверное снижение титров аДНК, улучшение клиники гломерулонефрита: снижение протеинурии и уменьшение депозитов иммуноглобулинов в гломерулах пораженных почек.
Еще одной точкой приложения фракционированного ВВИГ при СКВ является атеросклероз. Фосфорил-холин (ФХ) – это эпитоп, представленный на клеточной стенке С-гликана всех пневмококковых серотипов, филлярийных круглых червей и спирохет, способный выявлять защитный антителоассоциированный ответ к пневмококковой инфекции у мышей [36]. Кардиоваскулярные нарушения при СКВ могут проявляться ускоренным атеросклерозом – частично вследствие дислипидемии и повышения уровня окисленных липопротеидов низкой плотности. J. Su и соавт. [37] продемонстрировали, что анти-ФХ-IgM могут обладать защитными свойствами. Пассивное введение анти-ФХ ингибирует развитие атеросклероза у мышей с дефицитом аполипопротеина [38]. Атеропротективная активность анти-ФХ-ВВИГ определяется посредством ингибирования тромбоцитопосредованной активации эндотелия, что проявляется гиперэкспрессией сосудистых и межклеточных (1-го типа) молекул адгезии [37]. Низкие титры анти-ФХ были зарегистрированы среди больных СКВ [37]. Вот почему разработка и применение анти-ФХ-специфичного ВВИГ могут играть решающую роль для пациентов с длительно текущей СКВ при повышенном риске сердечно-сосудистых осложнений в молодом возрасте.
Антифосфолипидный синдром
Внутривенный человеческий иммуноглобулин используется беременными женщинами с антифосфолипидным синдромом (АФС), как с первичным, так и с вторичным, на фоне СКВ [38, 39]. В 1988 г. L.O. Carreras и соавт. [40] впервые описали случай успешного применения ВВИГ беременной женщиной с АФС с синдромом потери плода на ранних сроках и доложили о родоразрешении живым доношенным плодом после ежемесячной терапии ВВИГ в течение всего срока гестации. В дальнейшем было выполнено несколько РПКИ сравнительной эффективности ВВИГ и плацебо на фоне традиционных методов лечения (антикоагулянты + низкие дозы аспирина) с участием женщин с синдромом потери плода в рамках АФС [3, 41]; полученные результаты оказались противоречивыми. По данным мета-анализов больших групп, ВВИГ не обладал никакими преимуществами перед стандартной схемой лечения, однако в качестве «терапии отчаяния» при неблагоприятном прогнозе неизменно приводил к хорошим результатам [42].
Существуют теоретическая доказательная база эффективности ВВИГ при акушерском АФС с позиции рассмотрения механизма действия иммуноглобулина при синдроме потери плода, а также многочисленные описания случаев благополучных исходов беременностей при СКВ и АФС на фоне терапии ВВИГ [43, 44], что подтверждено результатами небольших открытых клинических испытаний [45]. И до настоящего времени вопрос о терапии резистентного акушерского АФС остается открытым. И.Б. Штивельбанд и соавт. [46] описали три случая успешного применения ВВИГ больными АФС при тромбоцитопении.
Поиск наиболее эффективного препарата постоянно продолжается. Фракционирование ВВИГ было выполнено и для АФС: созданы специфические анти-анти-β-2-гликопротеин-1 антиидиотипичные антитела [47].
D. Caccavo и соавт. [34] in vitro показали дозозависимое ингибирование активности антител к кардиолипину F(ab)2-фрагментом, выделенным из ВВИГ, предположив, что взаимодействие фракции ВВИГ и антител к кардиолипину произошло в непосредственной близости от антигенсвязывающего активного центра [34].
Еще одним показанием к назначению ВВИГ является катастрофический АФС (КАФС) [48]. С учетом тяжести течения болезни, высокого уровня смертности, редкости заболевания (КАФС развивается не более чем в 1 % от всех случаев АФС [49]) рекомендации по лечению базируются на результатах исследования механизма действия ВВИГ и описании случаев его высокой эффективности при КАФС; клинических исследований эффективности иммуноглобулина при КАФС не проводилось. S.Bucciarelli и соавт. [50] ретроспективно проанализировали 250 описаний случаев КАФС и выявили: благодаря своевременно начатой комплексной терапии антикоагулянтами, ГК, свежезамороженной донорской плазмой и ВВИГ уровень смертности среди больных КАФС можно снизить с 50 % (по данным R. Asherson и соавт. [51]) до 20.
Дерматомиозит/полимиозит
Дерматомиозит (ДМ) и полимиозит относятся к идиопатическим воспалительным миопатиям и характеризуются прогрессирующей мышечной слабостью, биохимическими и гистологическими признаками миозита, органными и кожными поражениями [3]. Единственное двойное слепое РПКИ эффективности и переносимости ВВИГ при ДМ было проведено M.C. Dalakas и соавт. [52] и включило 15 больных ДМ, резистентных к традиционной терапии. Результаты повторной биопсии кожно-мышечного лоскута пациентов, получавших ВВИГ, показали увеличение диаметра мышечных волокон, уменьшение диаметра капилляров, уменьшение депозитов комплемента в капиллярах, внутриклеточной молекулы адгезии 1-го типа и антигенов HLA 1-го класса.
P. Cherin и соавт. [53] продемонстрировали значительное улучшение по индексу активности болезни, индексу мышечного повреждения, а также по общей оценке повреждения пациентом по визуальной аналоговой шкале.
M.G. Danieli и соавт. [54] изучали эффективность и переносимость ВВИГ в качестве адъювантной терапии пациентов с ДМ и полимиозитом. В исследование были включены 20 пациентов, ранее получавших преднизолон и циклоспорин А. Тринадцать из 20 больных были резистентны к первоначальной терапии и получали ВВИГ с/без плазмафереза. В течение 4-летнего периода наблюдения в этой группе больных отмечено достоверно большее число ремиссий (р < 0,001). Плазмаферез не влиял на течение болезни.
P. Cherin и соавт. [55] исследовали эффективность и переносимость ВВИГ в качестве препарата первой линии для 11 пациентов с ДМ и полимиозитом. Исследование носило open-label-характер, и улучшение наблюдалось только у 3 из 11 больных. После лечения мышечная сила оставалась прежней.
Системная склеродермия
В настоящее время существует крайне мало данных о применении ВВИГ при системной склеродермии (ССД). Об эффективности ВВИГ при ССД свидетельствуют только единичные описания случаев в литературе или результаты небольших испытаний. Так, в исследование F. Nacci и соавт. [56] были включены 7 пациентов с ССД: 5 – с лимитированной формой и 2 – с диффузной. Несмотря на проводимую терапию циклофосфамидом и метотрексатом, у больных сохранялся тяжелый рефрактерный суставной синдром, в связи с чем всем пациентам было проведено 6 ежемесячных курсов ВВИГ (в дозе 2 г/кг веса в течение 4 дней). На фоне проводимой терапии отмечено достоверное уменьшение боли в суставах (р < 0,03), восстановление функции суставов кистей (р < 0,02), улучшение качества жизни (р < 0,03), уменьшение числа баллов кожного счета (р < 0,003).
H. Amital и соавт. [57] обследовали 8 пациентов с фиброзными заболеваниями (трое из них страдали ССД) и показали, что у всех этих больных фиброзные изменения редуцировали после введения ВВИГ.
АНЦА-ассоциированные системные васкулиты
Способность ВВИГ регулировать продукцию аутоантител В-клетками через идиотипантиидиотипические реакции сделала его препаратом выбора в терапии системных АНЦА-ассоциированных васкулитов (ААСВ), к которым относятся гранулематоз c полиангиитом Вегенера (ГВ), микроскопический полиангиит (МПА) и синдром Чарга–Штросса (СЧШ). По данным РПКИ, однократное введение высокой дозы ВВИГ (1–2 г/кг веса) больным ГВ и МПА способствовало снижению уровня С-реактивного белка и уменьшению активности заболевания по Бирмингемской шкале активности васкулитов (р < 0,01) [3].
Эффективность и безопасность ВВИГ при васкулитах оценивались в нескольких открытых испытаниях. V. Martinez и соавт. [58] исследовали эффективность и безопасность 6-месячного курса низких доз ВВИГ (0,5 г/кг веса) при обострениях ГВ и МПА, развившихся во время терапии или в течение года после отмены ГК и/или иммунодепрессантов. Результаты показали положительный эффект в 100 % случаев (20/20 больных), который сохранялся в среднем в течение 6–8 месяцев. Y. Levy и соавт. [59] зарегистрировали улучшение у 6 из 10 больных ААСВ, резистентных к стандартной терапии, на фоне высоких доз ВВИГ. D.R. Jayne и соавт. [60] использовали ВВИГ в качестве монотерапии 6 больных с впервые диа-гностированным ААСВ. Через год лечения у 4 из 6 пациентов наблюдалась полная ремиссия.
C. Richter и соавт. [61] исследовали влияние ВВИГ (однократное/многократное введение в дозе 30 г/сут в течение 5 дней) при резистентных к традиционной терапии васкулитах. И хотя у 6 (40 %) пациентов отмечено улучшение, положительная динамика имела место только в отношении кожной и ЛОР-симптоматики. Не было выявлено различий в эффективности многократных курсов ВВИГ по сравнению с однократным.
Большинство опубликованных научных работ проведено с участием больных ГВ и МПА. Эффективность ВВИГ при СЧШ оценивалась отдельно. Так, в 1991 г. D.L. Hamilos и J. Christensen [62] впервые доложили об успешном применении ВВИГ 33-летней пациенткой с СЧШ, резистентной к ГК. Наряду с клиническим выздоровлением у больной присутствовала нормализация уровня эозинофилов. В 2004 г.
N. Tsurikisawa и соавт. [63] продемонстрировали достоверное улучшение неврологической симптоматики и патологии сердца у 15 пациентов с СЧШ, резистентных к ГК с/без циклофосфана. Из-за отсутствия рандомизации и небольшой выборки интерпретация результатов остается сомнительной.
Существуют отдельные описания случаев успешного применения ВВИГ при геморрагическом васкулите и узловатой эритеме. Наиболее выраженный терапевтический эффект наблюдался главным образом при тяжелых гастроинтестинальных проявлениях пурпуры Шенлейна–Геноха, но есть сообщение о парадоксальном персистирующем поражении почек на фоне ВВИГ при геморрагическом васкулите [3].
Ревматоидный артрит
По данным множества исследований, ВВИГ зарекомендовал себя неэффективным препаратом для лечения ревматоидного артрита у взрослых. По данным одного РПКИ с участием 32 больных ранним активным ревматоидным артритом, достоверных различий в степени активности артрита в группах ВВИГ и плацебо не было получено [64]. Те же результаты получены в другом исследовании, включившем 22 пациента с рефрактерным ревматоидным артритом, получавших низкие дозы ВВИГ, не выявившего никакого терапевтического эффекта ВВИГ [65]. Таким образом, показаний к применению ВВИГ для лечения РА не получено.
Другие ревматические заболевания
Существует несколько описаний случаев, свидетельствующих об эффективности ВВИГ при артритах, резистентном кожном васкулите, периферической полинейропатии и нарушениях автономной нервной системы в рамках синдрома Шегрена [66, 67]. Однако клинических исследований, подтверждающих эту эффективность, не существует.
Аутоантитела к М3-мускариновым рецепторам (аМ3Р) обусловливают нарушения постганглионарной холинергической нейротрансмиссии, являются причиной для дисфункции диафрагмы и желудочно-кишечного тракта у пациентов с синдромом Шегрена. A.J. Smith и соавт. [68] показали, что антиидиотипические аМ3Р-антитела в составе ВВИГ способствовали снижению, аМ3Р-обусловленному ингибированием активности гладкой мускулатуры, и улучшению симптомов у 3 пациентов (с «первичным» синдромом Шегрена, глютеновой болезнью и с антисинтетазным синдромом).
Небольшое открытое исследование было посвящено оценке эффективности ВВИГ при поражении глаз при болезни Бехчета [69]. Четыре пациента (с общим числом пораженных глаз 6), резистентных к проводимой терапии ГК и циклоспорином А, получали низкие дозы ВВИГ (0,5 г/кг веса) ежемесячно в течение более года. У всех пациентов (во всех глазах) наблюдалось улучшение.
R. Kaaja и H. Julkunen [70] использовали ВВИГ и ГК для профилактики формирования полной атриовентрикулярной блокады сердца плода у 8 женщин (из которых 2 – с СКВ, 5 – с синдромом Шегрена, 1 – носитель антител без признаков ревматического заболевания). У всех пациенток в анамнезе уже были атриовентрикулярные блокады у новорожденных и/или позитивность по aRo/aLa. Семь из 8 рожениц разрешились здоровыми младенцами. Атриовентрикулярная блокада была зарегистрирована только у 1 новорожденного, чья мать не получала ГК во время беременности. По полученным данным, эффективность ВВИГ в профилактике поражения сердца при наличии aRo/aLa антител не доказана.
Исследований ВВИГ при идиопатическом анкилозирующем спондилите (болезни Бехтерева), как и описаний случаев назначения препарата при данной нозологии, не существует.
A. Bouchra и соавт. [71] приводят описание случая успешного применения ВВИГ при развитии синдрома Гийена–Барре (как НР инфликсимаба) у пациента с анкилозирующим спондилитом на фоне неспецифического язвенного колита.
Заключение
В течение десятилетий была доказана неоспоримая роль ВВИГ в лечении ревматических болезней. Сложность диагностики, отсутствие параметров прогнозирования исхода и способов оценки активности заболеваний, вероятно, остаются решающими в данных ситуациях. Все это отражает потребность в проведении дальнейших исследований, поиске новых терапевтических подходов и применении ВВИГ.


