Острые кишечные инфекции (ОКИ) в настоящее время занимают второе место в структуре инфекционной заболеваемости детей, уступая только острым респираторным инфекциям. Уровень заболеваемости ОКИ среди детей в 2,5–3,0 раза выше, чем среди взрослых. По данным ВОЗ (2008), ежегодно в мире регистрируется до 2 млрд диарейных заболеваний и около 5 млн детей ежегодно умирают от кишечных инфекций и их осложнений. В Европе ежегодно регистрируется от 0,5 до 1,9 эпизода инфекционных диарей у детей младше 3 лет [1, 2].
Известно, что 70 % кишечных инфекций в любое время года вызываются вирусными агентами, а в холодное время года на долю вирусных гастроэнтеритов приходится до 90 % случаев инфекционных диарей у детей [1, 3]. Нами был проведен анализ этиологической структуры кишечных инфекций у более чем 5000 госпитализированных детей в 2009–2013 гг. в ФГБУ НИИДИ ФМБА России (Санкт-Петербург) с использованием как микробиологического метода, так и полимеразной цепной реакции (ПЦР). Было установлено, что структура этиологически расшифрованных диарей представлена следующим образом: в 72,9 % случаев заболевание вызвано одним или несколькими вирусными агентами (доминировали рота- и норовирусы), на долю бактериальных диарей пришлось 19,8 % случаев и у 6,9 % пациентов кишечная инфекция была обусловлена вирусно-бактериальными ассоциациями.
По данным нашей клиники, за последние 7 лет (2007–2013) произошло изменение этиологической структуры бактериальных диарей у детей (сальмонеллеза, кампилобактериоза, эшерихиозов, иерсиниозов). Зарегистрирован резкий спад заболеваемости бактериальной дизентерией (с 15 в 2007 г. до 1 % в 2013-м), уровень заболеваемости сальмонеллезной инфекцией оставался (29–47 %) стабильно высоким, был отмечен значительный рост заболеваемости эшерихиозами (к 2010 г. – 51 %) и кампилобактериозом (с 9 в 2007 г. до 30 % в 2011-м), при этом сохранялся стабильно устойчивый уровень регистрации иерсиниозной инфекции (2,9–4,3 %).
При использовании полимеразной цепной реакции для диагностики бактериальных ОКИ нами установлено, что на долю кампилобактериоза приходится 29 %, сальмонеллеза – 22,73 %; нуклеиновые кислоты диареегенных эшерихий обнаружены у 12,8 % детей с бактериальными ОКИ, у 29,45 % пациентов зарегистрированы вирусно-бактериальные диареи, а у 6,15 % детей отмечена одновременная детекция нескольких бактериальных агентов.
В настоящее время в России отсутствуют согласованные подходы к терапии ОКИ у детей, причем частота назначения антимикробных препаратов остается на высоком уровне, особенно для госпитализированных пациентов [4], поэтому представляется актуальным освещение вопросов тактики терапии бактериальных диарей на современном этапе. Прежде чем начать терапию ОКИ, необходимо установить патогенетический тип диареи (инвазивный, секреторный, осмотический или смешанный), определить синдром поражения желудочно-кишечного тракта (ЖКТ) (гастрит, гастроэнтерит, энтерит, гастроэнтероколит, энтероколит, колит, дистальный колит); кроме этого необходимо диагностировать развившиеся осложнения ОКИ (синдром дегидратации, инфекционно-токсический шок, гемолитико-уремический синдром и т.д.) и оценить преморбидный фон пациента (пищевая аллергия, синдром мальабсорбции, иммунодефицитное состояние и т.д.) [5].
Основные принципы терапии ОКИ у детей предполагают целенаправленное воздействие в первую очередь на макроорганизм, обусловливающее коррекцию возникших водно-электролитных расстройств, а также элиминацию возбудителя [5].
Дети с инфекционными диареями могут получать медицинскую помощь как в амбулаторных, так и в стационарных условиях. В настоящее время в России единых подходов к показаниям к госпитализации не сформулировано. По нашим данным, около 28 % пациентов, госпитализированных в клинику НИИ детских инфекций с диагнозом ОКИ, не нуждались в лечении в стационаре, в то же время 11 % детей госпитализировались на поздних сроках болезни в связи с наличием серьезных осложнений.
Всемирной гастроэнтерологической ассоциацией (2012) четко сформулированы показания к госпитализации при инфекционных диареях у детей: клиника обезвоживания; изменение психического состояния; ранний возраст пациента (< 6 месяцев или < 8 кг массы тела); отягощенный преморбидный фон (недоношенность, хронические заболевания и пр.); лихорадка > 38 °С для детей < 3 месяцев или > 39 °С для детей от 3 до 36 месяцев; видимая кровь в стуле; выраженный диарейный синдром (частый и значительный по объему стул); упорная (повторная) рвота; отсутствие эффекта от оральной регидратации; недостаточный эффект от амбулаторного лечения в течение 48 часов; клинический симптомокомплекс тяжелого инфекционного заболевания с расстройством гемодинамики, недостаточностью функции органов; эпидемиологические показания (дети из «закрытых» учреждений с круглосуточным пребыванием, из многодетных семей и т.д.); невозможность обеспечить надлежащий уход на дому (социальные или технические проблемы) [6].
Основополагающей в лечении является именно патогенетическая терапия, построенная на трех «китах»: регидратации, диетотерапии и энтеросорбции. Следует отметить, что многие специалисты относят энтеросорбцию не только к патогенетической, но и к этиотропной терапии [5, 7].
При водянистой диарее Всемирная организация здравоохранения (ВОЗ) считает абсолютно доказанной эффективность двух терапевтических мероприятий: регидратации и диетотерапии (2006) [1].
Эффективность глюкозо-солевых растворов для оральной регидратации обусловлена тем, что при их использовании происходит замещение теряемых солей, наличие глюкозы служит не только восполнению энергетических потерь макроорганизма, но кроме этого глюкоза обеспечивает транспорт натрия и калия через слизистую оболочку тонкой кишки, что способствует более быстрому восстановлению водно-солевого гомеостаза [8].
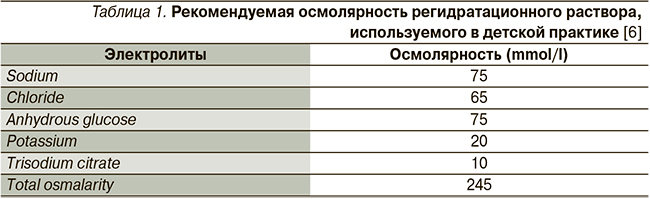
«Классические» растворы для оральной регидратации имели осмолярность 282–311 мОсм/л, «улучшенные» регидратационные растворы рекомендованы ВОЗ и ЮНИСЕФ в 2006 г. Требования к растворам со сниженной осмолярностью: соотношение натрия и глюкозы – 60/90 ммоль/л, осмолярность – 200–240 мосмоль/л и энергетическая ценность – до 100 ккал (табл. 1). Согласно данным ВОЗ и ESPGAN, только при лечении растворами со сниженной осмолярностью улучшается всасывание в кишечнике воды и электролитов, сокращаются объем и длительность диареи [1, 8]. Следует отметить, что данный тезис закреплен и в Национальной программе оптимизации вскармливания детей первого года жизни (2010). К растворам со сниженной осмолярностью относятся Хумана электролит с фенхелем (188 мОсмоль/л), Хумана электоролит с бананом (230 мОсмоль/л), Гидровит (240 мОсмоль/л), ОРС 200 (145 мОсмоль/л), Регидрон Оптимум (240 мОсмоль/л, в РФ не зарегистрирован).
Доказано, что при лечении гастроэнтеритов у детей оральная регидратация высокоэффективна в отношении большинства детей, не уступает по эффективности, а по некоторым показателям превосходит парентеральную регидратационную терапию [9].
Диетотерапия острых инфекционных диарей у детей преследует следующие цели: предупреждение катаболизма; предотвращение развития атрофии слизистой кишечника; обеспечение достаточным количеством жиров и углеводов в легкодоступных формах в качестве источников энергии; поступление необходимого количества белка; при этом необходимо откорригировать имеющийся синдром мальабсорбции (в 90 % случаев вторичную лактазную недостаточность); к тому же желательно воздействовать на иммунорезистентность макроорганизма и по возможности снизить частоту нозокомиального инфицирования пациентов. Адекватная диетотерапия ребенка с ОКИ служит залогом гладкого течения заболевания и отсутствия нарушений трофического статуса в периоде поздней реконвалесценции [6, 7].
По данным Всемирной гастроэнтерологической ассоциации, эффективность энтеросорбентов доказана при инфекционных диареях у детей [6]. Энтеросорбция – единственный неинвазивный метод детоксикации, энтеросорбенты связывают и выводят патогенные агенты: вирусы, бактерии и их токсины, непереваренные углеводы и желчные кислоты; способствуют восстановлению слизистой кишечника; ограничивают проникновение вирусов, оказывают цитомукопротективный эффект [10].
Прием энтеросорбентов приводит к уменьшению симптомов интоксикации, улучшению самочувствия больных и купированию симптомов воспаления, к снижению болевого синдрома, уменьшению вздутия живота, снижению массы стула, исчезновению гемоколита, что сопровождается восстановлением целостности и проницаемости слизистых оболочек толстой кишки [7].
Наиболее дискутабельным остается вопрос о целесообразности использования антимикробных препаратов (АМП) в лечении бактериальных ОКИ у детей. Назначая АМП в этих случаях, врач ожидает уменьшения выраженности клинических симптомов; сокращения продолжительности заболевания; снижения частоты развития осложнений; прекращения выделения возбудителя; предупреждения дальнейшего распространения инфекции [11, 12].
В то же время доказано, что использование антибиотиков далеко не всегда эффективно и безопасно при бактериальной диарее. При энтерогеморрагическом эшерихиозе, вызванном как E. coli О157:Н7, так и E. coli O104:H4, применение антибиотиков приводит к массивному высвобождению шигаподобного токсина, следовательно, увеличивает риск развития гемолитико-уремического синдрома, причем включение в терапию фторхинолонов и триметоприм/сульфометаксозола сопровождалось высоким риском его развития, а наиболее безопасным и эффективным оказалось использование карбапенемов, макролидов и рифаксимина [13].
Назначение АМП при бактериальных диареях в значительном проценте случаев не только не приводит к санации макроорганизма от возбудителя, а наоборот, способствует продолжительной персистенции бактериального агента в ЖКТ вследствие не только подавляющего влияния на аутохтонную микробиоту кишечника, но и прямого иммуносупрессивного действия [14, 15]. По данным отечественных и зарубежных исследователей, затяжное реконвалесцентное бактериовыделение сальмонелл формируется у значительного числа пациентов, получавших антибиотики в острую фазу инфекции, по сравнению с лицами, получавшими исключительно патогенетическую терапию [16, 17]. По нашим собственным данным, бактериовыделение сальмонелл в период реконвалесценции отмечено в среднем у 37 % детей, лечившихся системными АМП. Влияние антимикробной терапии на иммунный ответ было нами показано при шигеллезе, причем комбинированная антибактериальная терапия приводила к выраженной супрессии как гуморального иммунного ответа, так и показателей фагоцитоза [18].
Самым серьезным недостатком широкого использования АМП при лечении инфекционных диарей является быстрое развитие резистентности представителями семейства Enterobacteriaceae [19]. Так, отечественными авторами зафиксирован неуклонный рост числа штаммов Salmonella enteritidis, устойчивых к большинству стартовых АМП. Например, к налидиксовой кислоте в настоящее время резистентно до 60 % циркулирующих штаммов сальмонелл [16]. Все чаще выявляются штаммы кампилобактерий, обладающие широкой антибиотикорезистентностью, в т.ч. к макролидам и фторхинолонам [20, 21]. Параллельно с ростом антибиотикорезистентности отмечено снижение клинической эффективности стартовой антибактериальной терапии при назначении налидиксовой кислоты, она уменьшилась к 2009 г. по сравнению с 2000–2005-ми от 61,0 до 48,3 %, а при использовании амикацина от – 53,9 до 31,7 % [16, 17].
Кроме того, применение противомикробных средств нередко обусловливает развитие аллергических реакций вплоть до анафилактического шока, а также назначение антибиотиков может приводить к развитию как идиопатической антибиотикоассоциированой диареи, так и тяжелого антибиотикоассоциированного колита, обусловленных токсинообразующими штаммами Clostridium difficile [13, 14].
Проведенные в России немногочисленные фармакоэпидемиологические исследования показали, что в отношении детей с ОКИ в стационаре в большинстве случаев используется антибактериальная терапия (72–100 % госпитализированных), причем минимум у трети больных отсутствуют какие-либо показания к ее назначению, при этом во многих стационарах применяются малоэффективные или токсичные препараты (фуразолидон, хлорамфеникол, естественные пенициллины, рифампицин) [4, 21, 22].
В практическом здравоохранении не только отмечаются ошибки в выборе АМП для лечения инфекционных диарей, но и часто встречаются как недостаточные, так и избыточные дозы назначаемых препаратов, неадекватный способ введения, неправильный выбор интервалов между введениями, необоснованное сочетание двух и более антибактериальных средств [15]. Если доза антибиотика недостаточна и не создает в крови и тканях концентрации, превышающие минимально подавляющие основных возбудителей инфекции, то это становится одной из причин неэффективности лечения, а также создает предпосылки к формированию антибиотикорезистентности микроорганизмов. В современной ситуации при наличии высокоэффективных АМП широкого спектра действия лечения инфекционных диарей показания к комбинированной антибактериальной терапии практически отсутствуют и приоритет в лечении остается за монотерапией [7, 11, 20].
Кроме этого до настоящего времени при инфекционных диареях проводится необоснованно длительная антибактериальная терапия со сменой 3–4 лекарственных средств, реже имеет место неоправданно короткая антимикробная терапия [4].
Поэтому в настоящее время показания к использованию антибиотиков в лечении ОКИ строго ограничены, определяются типом диареи и этиологией заболевания, формой тяжести инфекционного заболевания, воз-растом и состоянием преморбидного фона пациента [1, 7, 11].
Антимикробный препарат, предназначенный для лечения инфекционных диарей у детей, должен отвечать следующим критериям: иметь высокую активность в отношении основных циркулирующих возбудителей бактериальных ОКИ; обладать бактерицидным действием; иметь высокую биодоступность действующего вещества и создавать высокую концентрацию в ЖКТ; кроме этого необходим низкий уровень штаммов, имеющих резистентность к препарату. Немаловажную роль в педиатрии играют профиль безопасности (количество и характер токсических эффектов), фармакоэкономические характеристики (соотношение эффективности, безопасности и стоимости) препарата, удобная для детей форма выпуска (суспензия) и режим дозирования лекарственного средства [1, 5–7].
За последние годы в лечении бактериальных ОКИ широко применяются невсасывающиеся АМП (нитрофураны, нефторированные хинолоны и хинолины, рифаксимин, некоторые сульфаниламиды и др.). Их преимуществами по сравнению с системными АМП являются возможность непосредственного воздействия на бактериальный агент при низком риске развития резистентности штаммов; практически полное отсутствие негативного влияния на аутохтонную микробиоту; незначительная частота развития системных побочных реакций; отсутствие лекарственного взаимодействия, т.к. они не оказывают влияния на ферменты системы цитохрома Р450 [23–26]. Высокие концентрации невсасывающихся АМП в пищеварительном тракте служат важной характеристикой для лечения инфекционных диарей, но в случае генерализации инфекции эти антимикробные средства оказываются неэффективными, т.к. не обеспечивают терапевтических концентраций в крови и паренхиматозных органах [27].
В соответствии с рекомендациями ВОЗ антимикробная терапия при инфекционных диареях показана только при следующих нозологических формах: холере, брюшном тифе, шигеллезе и амебиазе [1], а в 2012 г. Всемирная гастроэнтерологическая ассоциация дополнила этот список инвазивным кампилобактериозом и манифестным лямблиозом (табл. 2) [6].
По мнению ведущих отечественных инфекционистов, показаниями к назначению антимикробной терапии детей с ОКИ являются развитие (угроза развития) генерализованных форм (тифоподобных, септических) заболеваний; тяжелые формы инвазивных диарей, а также среднетяжелые формы инвазивных ОКИ у детей групп риска. К пациентам групп риска относятся дети с тяжелыми хроническими заболеваниями (первичные иммунодефициты, злокачественные новообразования, воспалительные заболевания кишечника, корригированные оперативным путем врожденные пороки сердца, ювенильные артриты и т.д.) и дети раннего возраста (первые 6–12 месяцев жизни) [5–7, 11]. Кроме вышеперечисленных лиц антибактериальная терапия является обязательной для пациентов с иерсиниозами.
Принципы рациональной антибактериальной терапии ОКИ у детей включают своевременное назначение препарата (период разгара болезни); разделение используемых АМП на стартовые, альтернативные и препараты резерва; учет антибиотикочувствительности выделенных штаммов; использование оптимального способа, дозы, кратности введения и курса терапии, а также учет индивидуальных особенностей пациента (возраста, преморбидного фона и т.д.).

Большинство зарубежных источников препаратами выбора терапии инфекционных диарей у детей, протекающих с клиникой гемоколита, считают цефтриаксон и азитромицин, а у взрослых пациентов – фторхинолоны и азитромицин [1, 21]. Длительность назначения АМП не превышает 5 суток, а во многих случаях ограничивается 24–48 часами. Для терапии шигеллезов еще сохраняют актуальность ампициллин, налидиксовая кислота, триметоприм/сульфаметоксазол [21, 28].
«Стартовые» препараты антибактериальной терапии ОКИ целесообразно использовать в ранние сроки заболевания при среднетяжелых формах инвазивных диарей и отсутствии индивидуальной непереносимости препаратов. Преимущество отдается препаратам с широким спектром действия, которые обладают бактерицидным или бактериостатическим действием, плохо всасываются из кишечника и не оказывают подавляющего влияния на аутохтонную микробиоту. К таким препаратам относятся производные оксихинолина, нитрофураны, аминогликозиды I–I поколений. Так как выбор АМП в острый период инфекционной диареи осуществляется эмпирически, при необходимости следует корригировать терапию в соответствии с антибиотикочувствительностью выделенного возбудителя [15, 27].
Эффективность антибактериальной терапии, основными критериями которой являются нормализация температуры тела, купирование или уменьшение выраженности интоксикации и диарейного синдрома, оценивается в течение 48–72 часов после начала лечения. В отсутствие положительной клинической динамики или прогрессирования симптомов заболевания, а также на поздних сроках заболевания как альтернатива стартовым антибиотикам могут использоваться альтернативные антибиотики: защищенные аминопенициллины, нефторированные хинолоны (налидиксовая кислота), хлорамфеникол, макролиды II поколения, цефалоспорины 2–3-й генераций, аминогликозиды II–III поколений (амикацин, нетилмицин), нитроимидазолы. При тяжелых формах ОКИ целесообразно начинать терапию с парентерального введения АМП, а по достижении клинического эффекта возможен переход на пероральный прием антибиотика до завершения полного курса терапии.
Антибиотики резерва используются в стационарных условиях, обладают широким спектром действия и высокоэффективны в отношении практически всех возбудителей ОКИ, в т.ч. и устойчивых к АМП стартовой и альтернативной терапии. Показания к назначению резервных препаратов: генерализованные и септические формы ОКИ, тяжелое течение ОКИ у детей с неблагоприятным преморбидным фоном, подозрение на нозокомиальную природу заболевания, а также неэффективность вышеназванных групп антибиотиков. К препаратам резерва относятся цефалоспорины III–IV генераций, карбапенемы, аминогликозиды II–III поколений, фторхинолоны (в РФ разрешены лицам старше 18 лет, поэтому детям их можно использовать только по жизненным показаниям) [7, 11, 27].
При выборе этиотропной терапии необходимо учитывать не только предполагаемый возбудитель ОКИ, но и быстроформирующуюся резистентность циркулирующих энтеробактерий к традиционно применяемым АМП. В связи с этим рекомендации по выбору оптимального антибактериального средства должны обязательно основываться на региональных данных по структуре антибиотикорезистентности [6].
В детской практике имеются сложности в антимикробной терапии инфекционных диарей, особенно это касается пероральных форм лекарственных средств и связано в первую очередь с возрастными ограничениями по применению препаратов в педиатрии. Так, налидиксовая кислота разрешена к применению с двух лет (а по некоторым источникам, с 18); рифаксимин – с 12-летнего возраста, а Интетрикс в настоящее время вообще не разрешен в педиатрии.
Необходимо подчеркнуть важность антимикробной терапии при псевдотуберкулезе и иерсиниозе, назначение АМП обязательно в острую и подострую фазу болезни. При локализованных формах длительность терапии составляет 7, при генерализованной – не менее 14 дней. Стартовые препараты при иерсиниозах: парентеральные цефалоспорины 3-го поколения (цефотаксим); хлорамфеникол, аминогликозиды II поколения (гентамицин); оральные защищенные пенициллины; при поражении ЖКТ: нитрофураны; Интетрикс, налидиксовая кислота; триметоприм/сульфаметоксазол. Препараты резерва: парентеральные цефалоспорины 3-го поколения (цефтриаксон, цефепим); аминогликозиды II–III поколений (амикацин, нетилмицин); парентеральные защищенные пенициллины; фторхинолоны (ципрофлоксацин, офлоксацин); тетрациклины (доксициклин с 8 лет), при тяжелых формах – карбапенемы. Продолжительность этиотропной терапии зависит от формы заболевания.
Имеются особенности антимикробной терапии кампилобактериоза. Препараты выбора стартовой терапии среднетяжелых инвазивных форм кампилобактериоза – макролиды (эритромицин, мидекамицин, азитромицин, кларитромицин) курсом 5 дней. Кроме этого могут быть использованы аминогликозиды, хлорамфеникол, нитрофураны (нифуроксазид, нифурантел) и нефторированные хинолоны (налидиксовая кислота), тетрациклины (лицами старше 8 лет). По жизненным показаниям возможно назначение фторхинолонов (ципрофлоксацин, офлоксацин, норфлоксацин и др.). Резервными препаратами лечения генерализованных форм кампилобактериоза, резистентных к проводимой терапии, являются карбапенемы (имепенем/циластин, меропенем) и комбинированные с ингибиторами β-лактамаз пенициллины. Продолжительность этиотропной терапии зависит от формы заболевания, при генерализованной – не менее 14 дней.
Экономический ущерб, наносимый возникновением антибиотикорезистентных форм бактерий, исчисляется десятками и сотнями миллионов долл. Например, в странах Европейского Союза он составляет минимум 1,5 млрд евро в год [29]. В сложившейся ситуации достойную альтернативу антибиотикам в терапии множества заболеваний бактериального происхождения способны составить бактериофаги, которые являются средством иммунобиологической терапии [30, 31].
Бактериофаги – высокоэффективные иммунобиологические препараты антибактериального действия, применяются в качестве лечения и профилактики ОКИ. Бактериофаги представляют собой вирусы, избирательно поражающие бактериальные клетки. Антибактериальный эффект бактериофагов обусловлен внедрением фага в бактериальную клетку с последующим его размножением и лизисом инфицированной клетки. Вышедшие во внешнюю среду в результате лизиса бактериофаги повторно инфицируют и лизируют другие бактериальные клетки, действуя до полного уничтожения патогенных бактерий в очаге воспаления [30, 32].
Перспективы применения бактериофагов в терапевтических целях во многом определяются особенностями их взаимодействия с организмом человека. Установлено, что в многоклеточном организме бактериофаги либо лизируют бактерии, либо переводят их в лизорезистентные формы, содействуя фагоцитозу бактерий клетками ретикуло-эндотелиальной системы организма хозяина. Действие бактериофага усиливается при повышении его концентрации в биологической среде, а также при терапии типовыми бактериофагами, т.е. фагами, свойственными конкретному штамму внутри бактериального вида. При использовании фагов в сочетании с терапевтическими дозами АМП отсутствует негативное воздействие этих препаратов на развитие бактериофагов, но отмечается взаимное потенциирование их терапевтического эффекта. Установлено, что воздействие фагов на антибиотикоустойчивые штаммы бактерий может быть более активным по сравнению с воздействием на антибиотикочувствительные штаммы того же вида. В настоящее время не установлено противопоказаний, кроме аллергических реакций, к использованию фагов в терапии и профилактике бактериальных инфекций [32]. Следовательно, показания к использованию фаготерапии можно сформулировать следующим образом: в качестве монотерапии – при стертых и легких формах инвазивных ОКИ; в сочетании с антибактериальной терапией или последовательно – при среднетяжелых и тяжелых формах ОКИ; при бактериовыделении (у реконвалесцентных или здоровых бактерионосителей); в комплексе терапии энтероколитов условно-патогенной и стафилококковой этиологии у детей раннего возраста и коррекции нарушений микробиоценоза кишечника. Бактериофаги также находят свое применение и с профилактической целью при чрезвычайных ситуациях природного характера (наводнения и т.д.), очагах бактериальной инфекции, в первую очередь шигеллеза и брюшного тифа [32].
Немаловажное значение в терапии бактериальных диарей имеет использование про- и пребиотиков. Пробиотики могут быть отнесены к средствам патогенетической терапии и рассматриваться в качестве этиотропного воздействия за счет антагонизма в отношении патогенных бактерий, вирусов и простейших. В детском возрасте широкое применение нашли различные штаммы бактерий, но доказанной эффективностью при инфекционных диареях обладают L. reuteri ATCC 55730, L. rhamnosus GG, L. casei DN-114 001 и Saccharomyces cerevisiae (boulardii). При этом состав пробиотиков должен соответствовать закономерностям формирования микробиоценоза кишечника у детей и содержать доминантные виды бифидобактерий и лактобацилл, несущих разнонаправленные функции [33].
Пробиотические штаммы с доказанной эффективностью обладают следующими свойствами: продукцией бактериоцинов, конкурентным ингибированием патогенных бактерий; торможением бактериальной адгезии или транслокации, уменьшением рН; пробиотические бактерии могут также увеличивать барьерную функцию кишечника, увеличивая производство слизи [33].
При тяжелом и осложненном течении заболевания у лиц с отягощенным преморбидным фоном при формировании реконвалесцентного бактерио- и вирусовыделения показана иммунокорригирующая терапия: внутривенные иммуноглобулины, комплексный иммуноглобулиновый препарат, препараты рекомбинантного интерферона, стимуляторы интерфероногенеза, глюкозаминилмурамилдипептид, азоксимера бромид, системная энзимотерапия [5, 7].
Таким образом, основой терапии бактериальных диарей остаются адекватная и своевременная регидратация, диетотерапия и энтеросорбция. Постоянный рост и изменение лекарственной чувствительности штаммов возбудителей бактериальных диарей требуют строгих подходов к назначению АМП при ОКИ у детей на фоне растущей антибиотикорезистентности. Альтернативой АМП могут быть бактериофаги и другие иммунобиологические препараты.



