Воспалительные заболевания кишечника (ВЗК), к которым относятся язвенный колит (ЯК) и болезнь Крона, являются одной из наиболее серьезных проблем современной гастроэнтерологии. Хотя распространенность ВЗК не очень высока и составляет для ЯК от 21 до 268 случаев на 100 тыс. населения, заболеваемость им за последние годы значительно увеличилась и продолжает расти. По тяжести течения, количеству осложнений и летальности ВЗК занимают одно из первых мест среди других заболеваний желудочно-кишечного тракта [1, 2].
В 2013 г. ведущими российскими гастроэнтерологами и колопроктологами был разработан проект клинических рекомендаций по диагностике и лечению взрослых больных ЯК. Составленные на основании данных литературы, а также Европейского доказательного консенсуса по диагностике и лечению ЯК рекомендации служат руководством для практических врачей, осуществляющих ведение таких пациентов.
Классификация
ЯК – хроническое заболевание толстой кишки, которое характеризуется иммунным воспалением ее слизистой оболочки [3]. В соответствии с рекомендациями классификация ЯК предполагает оценку протяженности поражения кишки, характера течения заболевания, степени тяжести текущего обострения (атаки), наличия осложнений и ответа на лекарственную терапию [4].
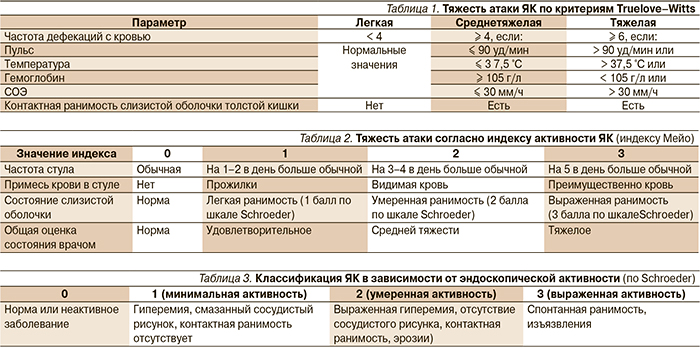
В зависимости от локализации воспалительных изменений рекомендуется выделять проктит (изолированное поражение прямой кишки), левосторонний колит (поражение распространяется не дальше левого изгиба толстой кишки) и тотальный колит [5]. По характеру течения выделяют острое (если прошло не более 6 месяцев с момента дебюта заболевания), хроническое рецидивирующее (с наличием ремиссий продолжительностью не менее 6 месяцев) и хроническое непрерывное (в отсутствие четко выраженных периодов ремиссии). Тяжесть текущего обострения (атаки) рекомендуется оценивать, используя критерии Truelove–Witts, которые учитывают объективные и лабораторные данные, а также индекс Мейо, дополнительно включающий эндоскопическую оценку состояния слизистой оболочки толстой кишки по шкале Schroeder (табл. 1–3) [6, 7].
В зависимости от реакции на назначение глюкокортикостероидов (ГКС) выделяют гормональную резистентность (сохранение активности заболевания на фоне приема адекватной дозы преднизолона) и гормональную зависимость (увеличение активности заболевания или возникновение рецидива после уменьшения дозы или отмены преднизолона).
Использование рекомендованной классификации с учетом всех перечисленных аспектов значительно облегчает выбор оптимальной лечебной тактики.
Диагностика
Диагноз ЯК выставляется на основании сочетания данных анамнеза, клинической картины, типичных эндоскопических и гистологических изменений.
К основным клиническим симптомам ЯК относятся диарея и/или ложные позывы с кровью, тенезмы и императивные позывы на дефекацию. Боль в животе при ЯК встречается реже, чем при болезни Крона, и обычно предшествует дефекации. При тяжелой атаке возможно появление общих симптомов, таких как снижение массы тела, общая слабость, анорексия и лихорадка [8].
В анализах крови обычно отмечаются лейкоцитоз, ускорение СОЭ, повышение уровня острофазовых белков (СРБ, фибриноген), железодефицитная анемия, гипопротеинемия, дисбаланс электролитов. Для исключения сопутствующих заболеваний (в т.ч. первичного склерозирующего холангита) и осложнений медикаментозной терапии в биохимическом анализе крови необходимо исследовать уровни печеночных трансаминаз и щелочной фосфатазы, амилазы, креатинина, мочевой кислоты. Пациентам также показано исследование кала, включая копрологию, микробиологическое исследование для исключения острой кишечной инфекции, исследование токсинов А и В Clostridium difficile, уровня фекального кальпротектина при первичной дифференциальной диагностике ЯК с функциональными заболеваниями кишечника, а также для неивазивной оценки активности воспалительного процесса на фоне лечения [9, 10].
Согласно настоящим рекомендациям, эндоскопическое исследование толстой кишки служит основным методом диагностики ЯК, однако не существует специфичных эндоскопических признаков данного заболевания. Наиболее характерным считается непрерывное воспаление, ограниченное слизистой оболочкой, начинающееся в прямой кишке и распространяющееся проксимальнее, с четкой границей. Признаками эндоскопической активности ЯК являются контактная ранимость (выделение крови при контакте с эндоскопом), отсутствие сосудистого рисунка, наличие эрозий и язв.
При микроскопическом исследовании могут выявляться деформации крипт (разветвленность, разнонаправленность, появление крипт разного диаметра, уменьшение плотности крипт, «укорочение крипт», крипты не достигают подлежащего слоя мышечной пластинки слизистой оболочки), «неровная» поверхность слизистой оболочки в биоптате, уменьшение числа бокаловидных клеток, базальный плазмоцитоз, инфильтрация собственной пластинки слизистой оболочки, наличие крипт-абсцессов и базальных лимфоидных скоплений.
В качестве дополнительных методов исследования при проведении дифференциальной диагностики, а также для исключения осложнений могут применяться трансабдоминальное ультразвуковое исследование тонкой и толстой кишки, трансректальное ультразвуковое исследование прямой кишки и анального канала, магнитно-резонансная и компьютерная энтероколография, капсульная энтероскопия, одно- и двубаллонная энтероскопия.
К числу заболеваний, с которыми необходимо проводить дифференциальную диагностику при подозрении на ЯК, относятся [11, 12]:
- болезнь Крона толстой кишки;
- острые кишечные инфекции (дизентерия, сальмонеллез, кампилобактериоз, иерсиниоз);
- глистные инвазии, паразитозы;
- антибиотико-ассоциированный колит;
- туберкулез кишечника;
- системный васкулит;
- рак толстой кишки;
- дивертикулит;
- микроскопический колит (коллагеновый и лимфоцитарный);
- радиационный колит.
Лечение
Лечение ЯК включает диетические рекомендации, назначение лекарственных препаратов, психосоциальную поддержку и хирургическое вмешательство при необходимости. Выбор тактики лечения определяется активностью воспаления, объемом поражения толстой кишки, наличием внекишечных проявлений, длительностью анамнеза, эффективностью и переносимостью ранее проведенной терапии, а также риском развития осложнений заболевания.
Проктит
Пациентам с язвенным проктитом при легкой или среднетяжелой атаке заболевания рекомендуется назначать терапию препаратами месалазина в виде ректальных форм (суппозитории, клизмы) в дозе 1–2 г в сутки. Эффективность месалазина для индукции клинической эндоскопической и гистологической ремиссии ЯК была подтверждена в 38 исследованиях, включенных в Кокрейновский систематический обзор [13]. При этом суппозитории при проктите предпочтительнее, чем клизмы, поскольку обеспечивают более высокую концентрацию действующего вещества в зоне воспаления [14]. Введение лекарственных средств дважды в сутки не имело преимуществ по сравнению с однократным введением [15].
В случае отсутствия клинического эффекта в течение двух недель необходимо добавить к лечению ректальные формы ГКС в дозе 10–20 мг/сут. Возможно также комбинированное назначение месалазина внутрь и в виде ректальных суппозиториев в общей дозе 3–4 мг/сут. Такая тактика лечения обусловлена тем, что по результатом исследований монотерапия ректальными формами месалазина более эффективна, чем монотерапия топическими ГКС или прием месалазина внутрь [16, 17]. Однако комбинация ректальных форм ГКС и месалазина или месалазина в ректальной и пероральной формах эффективнее монотерапии ректальным месалазином [18, 19]. При наступлении клинической ремиссии для поддерживающей терапии также применяются топические формы месалазина в дозе 1–2 г/сут 3 раза в неделю не менее двух лет.
При сохраняющейся активности заболевания показано применение ГКС в дозе, эквивалентной 0,75 мг/кг преднизолона в комбинации с азатиоприном. Если ремиссия заболевания была достигнута с применением ГКС, для поддерживающей терапии назначается азатиоприн в дозе 2 мг/кг.
В редких случаях у пациентов с изолированным проктитом возможно развитие тяжелой атаки заболевания. Таким больным для индукции ремиссии рекомендуется назначать системные ГКС в дозе, эквивалентной 1 мг/кг преднизолона. Местная терапия при этом может быть продолжена. Поддерживающее лечение проводится пероральными и/или местными формами месалазина. При рецидиве, требующем повторного применения ГКС, для поддерживающей терапии рекомендуется использовать азатиоприн.
Левосторонний и тотальный колит
При легкой или среднетяжелой атаке заболевания необходимо назначение месалазина в таблетках в комбинации с месалазином в клизмах в суммарной дозе 3–5 г/сут [20]. Возможно также назначение сульфасалазина. Этот препарат обладает не меньшей эффективностью, чем месалазин, однако переносится несколько хуже [21]. Клинический ответ оценивается в течение 2 недель.
В случае улучшения терапия продолжается до 6–8 недель. Вероятность наступления ремиссии значительно увеличивается (с 20 до 40 %) в случае назначения месалазина в форме мультиматриксной системы (ММХ, препарат Мезавант), обеспечивающей постепенное высвобождение действующего вещества и его равномерное распределение по всей толстой кишке, включая дистальные отделы. Причем эффективность терапии не снижается, если препарат принимается однократно в течение суток [22, 23]. При достижении ремиссии проводится поддерживающая терапия месалазином (или сульфасалазином) по 1,5–2,0 г/сут внутрь, возможно в сочетании с ректальными формами (2–3 раза в неделю) [24]. Доза препарата выбирается, исходя из клинической ситуации и в некоторых случаях может быть увеличена, однако не должна составлять менее 1,0–1,2 г/сут [25, 26].
Важную роль в поддержании ремиссии играет строгое соблюдение пациентами лечебных рекомендаций. Известно, что у больных в период ремиссии заболевания приверженность лечению невелика и составляет около 40 % [27]. Однако, по данным ряда исследований, приверженность пациентов терапии и удовлетворенность проводимым лечением оказываются более высокими, если лекарственных средств не много и рекомендован их однократный прием в течение суток [28]. Так, в случае монотерапии месалазином ММХ в течение года приверженность лечению составила более 80 % [29].
В случае отсутствия эффекта от препаратов 5-аминосалициловой кислоты рекомендовано назначение системных ГКС в дозе, эквивалентной 1 мг/кг преднизолона, в сочетании с азатиоприном 2 мг/кг, который в дальнейшем используется для поддерживающего лечения [30]. Если же атаку не удалось купировать с помощью системных ГКС, показано проведение биологической терапии (инфликсимаб 5 мг/кг на 0-й, 2-й, 6-й неделях) в сочетании с азатиоприном 2 мг/кг [31]. Поддерживающее лечение проводится при помощи азатиоприна в сочетании с введениями инфликсимаба каждые 8 недель в течение не менее года. При невозможности назначения инфликсимаба на длительный срок поддерживающая терапия проводится только тиопуринами. Возможна также монотерапия инфликсимабом [31, 32].
При тяжелой атаке заболевания лечение пациента необходимо проводить в стационаре под наблюдением специалистов – гастроэнтерологов и колопроктологов. Для купирования тяжелого обострения рекомендовано внутривенное введение преднизолона в дозе 2 мг/кг/сут в сочетании с ректальным введением месалазина до 4 г/сут или гидрокортизона 125 мг/сут. В случае положительного эффекта через 7 дней показано назначение ГКС внутрь (преднизолон 1 мг/кг или метилпреднизолон 0,8 мг/кг с последующим снижением на 5–10 мг в неделю до полной отмены). Поддерживающая терапия проводится при помощи месалазина или сульфасалазина.
Дополнительно для лечения тяжелой атаки ЯК рекомендуются инфузионная терапия с целью дезинтоксикации и коррекции водно-электролитных нарушений, препараты железа парентерально (при анемии), энтеральное питание (при трофологической недостаточности). [33]. В случае сопутствующей кишечной инфекции показано применение антибиотиков (метронидазол, фторхинолоны, цефалоспорины) в течение 7–10 дней [34].
В отсутствие эффекта от внутривенного введения ГКС в течение 7 дней возможно лечение инфликсимабом в дозе 5 мг/кг (введения в рамках индукционного курса на 0-й, 2-й и 6-й неделях) или циклоспорином А внутривенно или внутрь по 2–4 мг/кг в течение 7 дней [35, 36].
При ответе на индукционный курс инфликсимаба в дальнейшем препарат вводится через каждые 8 недель в течение не менее года в сочетании с азатиоприном в дозе 2 мг/кг.
В случае успешного применения циклоспорина А для поддерживающего лечения препарат назначается перорально в сочетании с азатиоприном в дозе 2 мг/кг и ГКС с постепенной отменой последних в течение 12 недель [37]. Поддерживающая терапия проводится пероральным циклоспорином в течение 3 месяцев до момента достижения терапевтической концентрации азатиоприна. Прием последнего целесообразно продолжать не менее двух лет.
В отсутствие ответа на вторую инфузию инфликсимаба или 7-дневную терапию циклоспорином А пациенту рекомендуется хирургическое лечение. Решение о проведении операции необходимо принимать своевременно, поскольку при отсроченном хирургическом лечении повышается риск послеоперационных осложнений и ухудшается дальнейший прогноз. Как указано в рекомендациях по лечению ЯК, для определения тактики ведения больного целесообразно использовать критерии прогноза эффективности консервативного лечения.
Предикторы неэффективности ГКС:
- частота стула > 12 раз/сут на вторые сутки внутривенной гормональной терапии повышает риск колэктомии до 55 % [38];
- если на 3-й день гормональной терапии частота стула превышает 8 раз/сут или составляет от 3 до 8 раз/сут и при этом уровень С-реактивного белка (СРБ) превышает 45 мг/л, вероятность колэктомии составляет 85 % (т. н. оксфордский индекс) [39];
- на 3-й день также можно определить «шведский индекс» по формуле: частота стула 0,14 уровень СРБ. Его значение ≥ 8 повышает вероятность колэктомии до 75 % [40];
- риск колэктомии повышается в 5–9 раз при наличии гипоальбуминемии и лихорадки при поступлении, а также в отсутствие уменьшения частоты стула как минимум на 40 % за 5 дней внутривенной гормональной терапии [41];
- наличие глубоких изъязвлений толстой кишки (на фоне которых остаточная слизистая оболочка определяется только в виде «островков») повышает риск колэктомии до 86–93 % [42, 43].
Предикторы неэффективности инфликсимаба:
- эффективность инфликсимаба при гормонорезистентной тяжелой атаке ЯК уменьшается с возрастом, при наличии тотального поражения толстой кишки, а также при выраженной гипоальбуминемии, уровне гемоглобина < 95 г/л и уровне СРБ > 10 мг/л на момент первого введения препарата [44–47];
- эффективность инфликсимаба существенно ниже у пациентов, у которых показания к антицитокиновой терапии возникли уже при первой атаке ЯК;
- наличие обширных язвенных дефектов слизистой оболочки толстой кишки при колоноскопии до начала терапии инфликсимабом с 78 %-ной точностью прогнозирует ее дальнейшую неэффективность [48].
При назначении медикаментозной терапии необходимо проводить профилактику возможных осложнений. Так, при лечении ГКС общая продолжительность курса не должна превышать 12 недель, необходимо постепенное снижение дозы препарата, показан динамический контроль уровня глюкозы в крови. Также на фоне терапии ГКС рекомендован сочетанный прием ингибиторов секреции, препаратов кальция, витамина D. При лечении иммуносупрессорами и биологическими препаратами необходим скрининг на туберкулез [49]. На фоне иммуносупрессоров показано динамическое исследование анализов крови. Четкое соблюдение графика лечения биологическими препаратами снижает риск развития инфузионных реакций. Для профилактики оппортунистических инфекций лицам группы повышенного риска (пожилой возраст, тяжелые сопутствующие заболевания, длительный прием высоких доз препаратов) рекомендована вакцинация [50].
Согласно рекомендациям, показаниями к хирургическому лечению язвенного колита служат неэффективность консервативной терапии, осложнения заболевания (кишечное кровотечение, токсическая дилатация или перфорация толстой кишки) а также рак толстой кишки или высокий риск его возникновения. По данным литературы, неэффективность консервативной терапии служит показанием к удалению толстой кишки у 10–30 % больных [51]. В настоящее время «золотым» стандартом хирургического лечения считается восстановительно-пластическая операция – колопроктэктомия с илеоанальным резервуарным анастомозом. При успешном выполнении данная операция обеспечивает возможность контролируемой дефекации через задний проход: средняя частота дефекации после формирования указанного анастамоза составляет от 4 до 8 раз в сутки [52–54].
Наиболее частым осложнением такой операции является резервуарит – неспецифическое воспаление тонкокишечного резервуара [55]. Диагноз резервуарита устанавливается на основании клинических симптомов, а также характерных эндоскопических и гистологических изменений. Для воспаления резервуара характерны учащение дефекаций, жидкий стул, спастические боли в животе, недержание стула и тенезмы. В редких случаях возможно появление лихорадки и внекишечных проявлений. Эндоскопические признаки резервуарита: очаговая или диффузная эритема, отек и зернистость слизистой оболочки, спонтанная и контактная кровоточивость, эрозии и изъязвления. При этом эрозии или язвы по линии скобок неспецифичны и необязательно свидетельствуют о резервуарите. Гистологические проявления резервуарита включают признаки острого воспаления с полиморфоядерной лейкоцитарной инфильтрацией, крипт-абсцессами и изъязвлениями.
В соответствии с рекомендациями основными препаратами лечения резервуарита остаются антибиотики. Первая линия терапии включает 14-дневный курс перорального метронидазола (15–20 мг/кг/сут) или ципрофлоксацина (1000 мг/сут). В отсутствие эффекта возможно назначение резервных препаратов – рифаксимина (2000 мг/сут), тинидазола, ректальных ГКС, ректальных форм месалазина, азатиоприна.
Следует также учитывать, что медикаментозная терапия, проводимая в предоперационный период, может оказать влияние на результаты хирургического лечения. Известно, что прием преднизолона в дозе более 20 мг/сут продолжительностью более 6 недель повышает риск развития хирургических осложнений [56, 57]. Однако резкое прекращение терапии ГКС может вызывать синдром отмены (острую недостаточность коры надпочечников), что диктует необходимость продолжения ранее назначенной гормональной терапии после операции до полной отмены. На время оперативного вмешательства и в раннем послеоперационном периоде до возможности приема пациентом препаратов внутрь рекомендуется внутривенное введение ГКС в дозе, эквивалентной 2 мг/кг преднизолона (доза, таким образом, может превышать принимавшуюся до хирургического вмешательства). Назначение инфликсимаба и циклоспорина незадолго до операции может увеличивать частоту послеоперационных осложнений, хотя результаты исследований инфликсимаба противоречивы [58, 59]. Прием азатиоприна не влияет на исход хирургического лечения [60].
Прогноз
Прогноз ЯК в значительной мере зависит от характера течения заболевания и проводимой терапии. Факторами риска тяжелого течения ЯК считаются ранний дебют заболевания, постепенное распространение поражения от дистального к тотальному, а также сочетание с первичным склерозирующим холангитом. В целом вероятность тяжелого обострения ЯК в течение жизни составляет 15 %, при этом риск повышается в случае тотального поражения. Вероятность колэктомии в течение первого года болезни составляет 4–9 % и увеличивается на 1 % с каждым последующим годом.
При проведении адекватной противорецидивной терапии в течение 5 лет обострений удается избежать половине пациентов, а в течение 10 лет – 20 % больных.



