Хроническая сердечная недостаточность (ХСН) является одной из наиболее сложных проблем здравоохранения развитых стран мира. Прогноз при ХСН остается крайне серьезным независимо от ее этиологии, поэтому вопросы фармакотерапии ХСН постоянно находятся в центре внимания клиницистов. Основная идея современной тактики лечения пациентов с ХСН предусматривает активную терапию на начальных стадиях болезни, достижение максимально возможных результатов и предотвращение прогрессирования процесса. Лечение направлено на устранение симптомов заболевания – одышки, сердцебиения, повышенной утомляемости и задержки жидкости в организме, защиту органов-мишеней (сердце, почки, мозг, сосуды, мускулатура), профилактику прогрессирования декомпенсации, поддержание и улучшение качества жизни. К сожалению, на практике нередко реализуются далеко не все эти принципы, что и приводит к быстрому возврату декомпенсации, требующей повторной госпитализации.
По современным представлениям, в основе прогрессирования ХСН любой этиологии лежит процесс сердечно-сосудистого ремоделирования, тесно связанный с активацией нейрогормональных систем организма больного (симпатикоадреналовой и ренин-ангиотензин-альдостероновой – РААС). Для сохранения длительной и стабильной компенсации состояния и замедления, а также прогрессирования болезни необходимо стремиться к защите органов-мишеней, прежде всего самого сердца, почек, сосудов. Согласно рекомендациям по диагностике и лечению ХСН, к основным направлениям в ее лечении относятся уменьшение застойных явлений и предотвращение патологического ремоделирования. Врачу необходимо определить вариант дисфункции миокарда (систолический, диастолический или комбинированный), оценить степень тяжести нарушения сократительной способности миокарда в сочетании с анализом клинических проявлений болезни и выбрать среди различных классов лекарственных препаратов наиболее эффективное и хорошо переносимое.
При обсуждении медицинским сообществом возможных причин несоответствия доказанной высокой эффективности современных лекарственных препаратов и сохраняющегося в популяции высокого уровня смертности больных ХСН особая роль отводится низкой приверженности пациентов к предписанному терапевтическому режиму, включая строгое выполнение врачебных рекомендаций, касающихся диеты и образа жизни [3–5]. Врачи не уделяют должного внимания всесторонней информированности пациентов, а в детской практике родителей больного ребенка – возможностях лечения и профилактики ХСН. Участие пациента или его родителей в процессе лечения может позитивно воздействовать на симптомы, функциональную активность, самочувствие и прогноз ХСН.
Согласно рекомендациям Европейского общества кардиологов, медикаментозная терапия ХСН представляет собой очень важную составляющую лечения, однако игнорирование немедикаментозных методов затрудняет достижение конечного успеха и снижает эффективность лечебных воздействий [1].
Немедикаментозное лечение
Врачу следует обращать внимание на мероприятия по стабилизации баланса жидкости, разъяснять родителям пациентов необходимость ежедневного контроля диуреза, массы тела, чтобы своевременно обнаруживать задержку жидкости. При симптоматической СН следует вводить ограничение потребления натрия для предупреждения появления отеков. Определенных рекомендаций по количеству соли в рационе питания при ХСН не существует, однако необходимо избегать ее чрезмерного потребления (класс рекомендаций IIa, уровень доказательности С).
Для улучшения физического состояния пациентов с ХСН медицинский персонал не должен ограничивать их физическую активность, также не рекомендуется длительно держать больных на строгом постельном или постельном режиме даже при тяжелых проявлениях нарушения кровообращения из-за повышенного риска флеботромбоза, гипотрофии мышц с потерей калия. Следует приобщать детей к выполнению умеренных физических нагрузок, лечебной гимнастике и массажу. Необходимо понимание, что умеренные физические тренировки способствуют повышению чувствительности к медикаментозному лечению и переносимости нагрузок, устранению нейрогормональных расстройств, улучшению качества жизни (класс рекомендаций I, уровень доказательности А).
Контроль массы тела пациентов с ХСН или контроль трофологического статуса сегодня приобретает важнейшее значение. К сожалению, врачи не знают и не используют необходимые рекомендации по коррекции питания детей с ХСН и даже при сердечной кахексии. Однако патологическая потеря массы тела (явные или субклинические признаки) обнаруживается у 50 % больных ХСН. В лечении таких больных необходимым остается сочетание медикаментозной коррекции нейрогормональных расстройств (степень доказательности А) и нутритивной поддержки (степень доказательности С) [1]. Для выбора тактики диетологического лечения необходимо установить степень выраженности дефицита массы тела и роста, определить причины нарушения физического развития, проанализировать фактическое питание ребенка. Коррекция качественного и количественного состава рациона проводится с учетом потребностей ребенка в пищевых веществах и энергии, его функциональных возможностей, специфики патологии. Для коррекции недостаточности питания и задержки физического развития детей наряду с оптимизацией рациона питания используются продукты со специально заданным составом [2].
У больных декомпенсацией кровообращения, когда резко ухудшаются показатели всасывания, оптимально применение олигомерных питательных смесей (уровень доказательности С). В период стабилизации состояния для ежедневного приема можно рекомендовать высокомолекулярные сбалансированные смеси в количестве 25–50 % от суточной энергопотребности (уровень доказательности С).
Хорошая приверженность лечению может значительно уменьшить количество осложнений и смертность при ХСН, улучшить общее самочувствие пациентов (класс рекомендаций I, уровень доказательности С). В практике педиатра существенная роль в успешном лечении больного ребенка отводится родительской заботе, степени ответственности при выполнении рекомендаций врача. В связи с этим актуальным стал вопрос о необходимости проведения с родственниками пациентов бесед, обучения с включением всей полезной информации о проблеме ХСН, возможным убеждением активно изменять образ жизни всей семьи, чтобы достигать максимальных результатов в лечении ребенка (улучшение прогноза, увеличение продолжительности жизни). Родители должны научиться мониторировать изменения симптоматики, распознавать ухудшение, свидетельствующее о прогрессировании патологии и необходимости коррекции схемы лечения, постоянно контролировать массу тела, выведение жидкости из организма, частоту сердечных сокращений (ЧСС), артериальное давление (АД), выявлять побочные эффекты от принимаемых лекарственных препаратов.
Принципы медикаментозного лечения
Современные терапевтические мероприятия при ХСН предусматривают повышение сократительной способности миокарда, снижение нагрузки на сердечную мышцу, коррекцию электролитного баланса и кислотно-основного равновесия, профилактику и лечение тромбоэмболического синдрома, лечение нарушений ритма сердца и проводимости.
Лекарственные препараты лечения больных ХСН применяются согласно классификации и рейтинговой оценке пользы или эффективности, а также уровню доказательности (табл. 1, 2).

В отличие от пациентов с ХСН и нормальной (сохранной) систолической функцией сердца (фракция выброса [ФВ] левого желудочка [ЛЖ] > 40 %) для пациентов с ХСН и низкой (< 40 %, иногда учитывается величина < 35 %) ФВ ЛЖ имеется множество доказательств эффективности медикаментозных и инструментальных методов лечения. Согласно Национальным рекомендациям по диагностике и лечению ХСН (четвертый пересмотр), лекарственные средства лечения ХСН и сниженной ФВ ЛЖ можно разделить на две основные категории соответственно степени доказательности (табл. 3). Фармакологическое лечение больных рекомендуется проводить в зависимости от функционального класса (ФК) ХСН (табл. 4) [6]. Медикаментозное лечение больных ХСН не может быть курсовым, а предполагает пожизненный прием препаратов. Врачу необходимо выбирать наиболее эффективное и хорошо переносимое лекарственное средство среди различных классов препаратов.
Ингибиторы АПФ
В настоящее время ингибиторы ангиотензинпревращающего фермента (ИАПФ) играют ключевую роль в длительной терапии больных ХСН вследствие миокардиального поражения сердца, что оправданно в первую очередь с патофизиологической точки зрения. Процессы апоптоза, некроза, патологического ремоделирования кардиомиоцитов и сердца, изменения экспрессии генов, коронарная и периферическая вазоконстрикция — все эти и другие механизмы, лежащие в основе перестройки миокарда при ХСН вследствие миокардиального поражения, во многом обусловлены активацией основных эффекторов РААС. Целесообразность применения ИАПФ определяется их способностью блокировать АПФ и нарушать образование ключевого вазоконстрикторного и антидиуретического фактора – ангиотензина II. Другие положительные эффекты ИАПФ связаны с их способностью блокировать разрушение брадикинина, препятствующего развитию гипертрофии и патологического ремоделирования сердца. Многочисленные исследования ИАПФ подтвердили их способность не только улучшать клиническое состояние, но и продлевать жизнь пациентов с различными стадиями ХСН. В 1995 г. R. Garg и S. Yusuf суммировали имеющиеся данные в виде мета-анализа 32 контролированных исследований, включивших более 7100 пациентов. Было показано, что применение ИАПФ достоверно снижало (на 23 %) риск смерти больных ХСН [7]. Эффект отмечается уже в первые 3 месяца терапии (снижение риска смерти на 44 %). Эти результаты неоднократно подтверждены в других исследованиях, показавших, что положительные эффекты ИАПФ не зависят от возраста больных, сохраняются в большинстве клинических ситуаций и при любой степени тяжести ХСН (I–IV ФК). По этим позициям установлены класс рекомендаций I, уровень доказательности А [6]. Согласно рекомендациям Общества специалистов по сердечной недостаточности (ОССН) и Всероссийского научного общества кардиологов (ВНОК), ИАПФ показаны всем пациентам с ХСН при любой этиологии и стадии процесса и должны назначаться даже при нормальном уровне АД. Отказ от назначения ИАПФ не может считаться оправданным и приводит к заведомому увеличению риска смерти декомпенсированных больных [6]. Основываясь на принципах доказательной медицины, к основным препаратам лечения ХСН с полным правом могут быть отнесены лишь те ИАПФ, эффективность (положительное воздействие на симптомы, качество жизни, прогноз больных ХСН) и безопасность которых были доказаны. Это эналаприл, каптоприл, фозиноприл и периндоприл.
Первым ИАПФ, широко используемым детьми, является каптоприл, обладающий наименьшим периодом полувыведения, что является оптимальным для начала терапии больных СН с исходно низким АД. В последние годы наряду с каптоприлом в педиатрической практике применяется эналаприл. В работах, касающихся изучения эффективности ИАПФ при лечении ХСН у детей, отмечается улучшение клинического состояния больных и морфофункциональных параметров сердца [8–14].
Практические вопросы применения ИАПФ при ХСН, в т.ч. детьми (дозы, тактика лечения, меры предосторожности), подробно изложены в рекомендациях по диагностике и лечению ХСН [6, 14, 16, 17], однако врачи часто допускают ошибки при назначении этих препаратов. Игнорируется обязательное титрование доз всех ИАПФ, начиная с малых, при их постепенном повышении (не чаще 1 раза в 2–3 дня, а при системной гипотонии – не чаще 1 раза в неделю) до оптимальных (средних терапевтических). Поскольку пациенты с ХСН нередко имеют низкий или нормальный уровень АД, важно соблюдать индивидуальный подход к подбору дозы, понимая, что для каждого пациента есть свои оптимум и максимум в эффективных и переносимых дозах лекарств. При этом необходимо учитывать, что стартовое назначение чрезмерно высоких доз может обусловливать развитие гипотонии, ухудшение самочувствие больного и отказ от приема препарата, а оставление пациента на малых дозах препарата, руководствуясь исходной гипотонией, может приводить к значительному снижению эффективности лечения [16].
Многими врачами не учитывается вероятная на фоне приема ИАПФ задержка калия в организме, не выполняется рекомендованное ограничение в отношении применения калийсберегающих диуретиков в начале лечения ИАПФ, особенно больных с исходно высоким уровнем калия плазмы. Следует подчеркнуть, что у пациентов с ХСН, принимающих ИАПФ, важно регулярно контролировать функцию почек (уровень креатинина). В случае выявления нарушений рекомендуется переводить больного на препараты с двойным путем выведения, такие как фозиноприл и рамиприл. При неэффективности этих мер возможно уменьшение дозы применяемого ИАПФ вдвое и/или его замена на антагонисты рецепторов к ангиотензину II (АРА).
Важно учитывать, что ИАПФ предназначены для длительного лечения, т.к. их благоприятный клинический эффект наиболее отчетливо проявляется в отдаленные от начала терапии сроки – не ранее 3–4-й недели от начала приема.
Антагонисты рецепторов к ангиотензину II
АРА более 10 лет широко используются в клинической практике при лечении ХСН. Согласно данным крупных исследований, АРА рекомендованы при ХСН либо в случаях, когда ИАПФ плохо переносятся (обусловливают кашель) либо в дополнение к ИАПФ, если симптоматика ХСН не устраняется на фоне применения оптимальных доз ИАПФ, диуретиков и β-адреноблокаторов (БАБ). Они улучшают показатели функции ЛЖ и самочувствие пациента, уменьшают потребность в госпитализации, обусловленной прогрессированием СН (класс рекомендаций I, уровень доказательности А). Применение АРА уменьшает риск смерти от сердечно-сосудистых причин (класс рекомендаций IIА, уровень доказательности B).
Назначать АРА необходимо согласно тем же принципам, что и ИАПФ, т.е. с титрованием дозы на протяжении 2–4 недель (более быстрое титрование дозы – только в условиях стационара), мониторированием функции почек и содержания электролитов сыворотки крови. Госпитализированным пациентам препараты этой группы назначаются перед выпиской из стационара (класс рекомендаций I, уровень доказательности В) [15].
Возможные побочные эффекты АРА – те же, что у ИАПФ (исключе-ние – отсутствует кашель).
Блокаторы β-адренергических рецепторов
К настоящему времени благоприятные клинические эффекты БАБ при ХСН показаны более чем в 20 крупных плацебо-контролируемых клинических исследованиях. БАБ показаны всем пациентам с симптомной СН, а также с асимптомным снижением ФВ ЛЖ ≤ 40 %. Длительный прием БАБ повышает выживаемость, уменьшает потребность в повторных госпитализациях, улучшает качество жизни многих больных, может при длительном применении улучшать клиническое состояние пациентов (снижать ФК заболевания), уменьшать дилатацию и повышать сократительную способность ЛЖ. Рекомендуется начинать терапию БАБ только в условиях стационара с подбором оптимальной доза до выписки (класс рекомендаций I, уровень доказательности В).
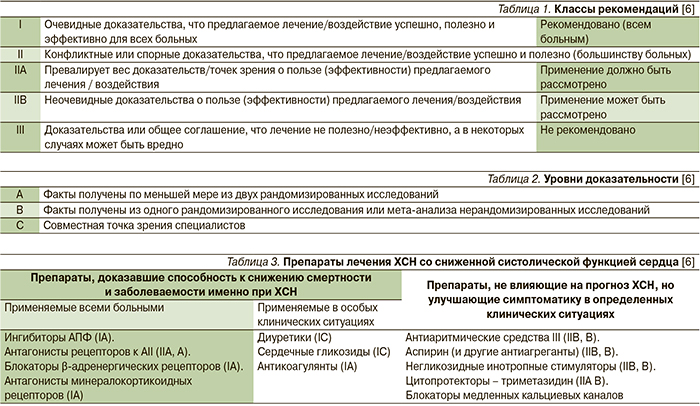
Следует отметить, что врачи не всегда соблюдают правила применения рекомендованных БАБ и назначают их в адекватных дозировках. На основании доказательной медицины пациенты с ХСН могут применять 2 типа БАБ: β1-селективные (кардиоселективные) – бисопролол и метопролола сукцинат с замедленным высвобождением препарата; неселективный β1/β2-блокатор с дополнительными свойствами α1-блокатора, антиоксиданта и антипролиферативного средства – карведилол (класс рекомендаций I, степень доказательности А). Другие БАБ, включая атенолол, метопролола тартрат и небиволол, не продемонстрировали способность улучшать прогноз больных ХСН. Применение атенолола и метопролола тартрата в качестве лечения больных ХСН противопоказано (степень доказанности А). В случае если пациентам с ХСН врачами уже назначены нерекомендованные БАБ, следует осуществлять перевод больных на рекомендованные препараты(табл. 5) [6].
Соблюдение правил безопасного применения БАБ больными ХСН подразумевает их использование на фоне ранее подобранной терапии (ИАПФ + диуретики, возможно дигоксин) при стабильном состоянии больного (не требующем инотропной поддержки и активной терапии внутривенными диуретиками). Однако врачам необходимо учитывать, что в отдельных клинических ситуациях существует необходимость первичного назначения БАБ пациентам, не получающим ИАПФ. Как правило, такая необходимость возникает у больных с низким исходным АД при выраженной тахикардии (часто с низкой ФВ левого желудочка). В данной ситуации рекомендуется начать терапию БАБ со скорейшим присоединением ИАПФ для достижения максимальной эффективности лечения [19].
Врачи нередко не учитывают возможное в первые две недели применения БАБ снижение сердечного выброса с обострением симптомов ХСН, что носит временный характер и требует тщательного контроля, устранения преходящих нарушений, но не отмены препарата. В этих случаях рекомендуется увеличение дозы диуретиков и, если возможно, дозы ИАПФ, краткосрочное применение инотропных препаратов (малых доз сердечных гликозидов или сенситизатора кальция – левосимендана), в дальнейшем более медленное титрование дозы БАБ. В случаях декомпенсации ХСН на фоне длительного приема БАБ следует попытаться оптимизировать другую терапию (диуретики, ИАПФ, сердечные гликозиды), снизить дозу БАБ, но без его полной отмены. Врачи должны осознавать, что отмена БАБ может приводить к ухудшению течения ХСН. Поэтому после стабилизации состояния лечение БАБ должно быть возобновлено начиная с меньших доз с последующим титрованием. Лишь при обострении симптомов бронхообструкции на фоне терапии БАБ от их применения следует отказаться. Средством выбора в такой ситуации служит использование высокоселективного β1-блокатора бисопролола (степень доказательности С) [15].
Сегодня БАБ наряду с ИАПФ стали главным средством лечения ХСН cо сниженной систолической функцией сердца. Их способность замедлять прогрессирование болезни, уменьшать число госпитализаций и улучшать прогноз декомпенсированных больных не вызывает сомнений (класс рекомендаций I, уровень доказательности А) [6].
Антагонисты минералокортикоидных рецепторов (АМКР)
Исследования 1990-х гг. и начала этого века доказали, что негативная роль гиперальдостеронизма при ХСН связана не только с задержкой жидкости и электролитным дисбалансом, но и с развитием фиброза миокарда, прогрессирующим ухудшением функции сердца, риском жизнеугрожающих аритмий и провоцированием коронарной недостаточности. С учетом доказанной способности АМКР уменьшать выраженность фиброза миокарда [20, 21], сопровождающуюся блокадой ремоделирования сердца (уменьшение объемов сердца и уровня мозгового натрийуретического пептида) и ростом ФВ ЛЖ [22–24], было предложено их длительное применение в малых дозах пациентами с ХСН.
При продолжительном лечении ХСН применение АМКР в качестве третьего нейрогормонального модулятора может быть целесообразным для всех пациентов с тяжелой ХСН (ФВ ЛЖ ≤ 35 %). Назначать АМКР следует в небольших дозах при условии отсутствия гиперкалиемии и значительной почечной дисфункции. В случае пребывания пациента на стационарном лечении инициировать такую терапию необходимо еще до его выписки из больницы. Мониторирование содержания креатинина и калия в сыворотке крови показано при любом изменении в лечении или клиническом состоянии пациента. Препараты этого класса уменьшают риск госпитализации по поводу прогрессирования СН и увеличивают выживаемость больных СН (класс рекомендаций I, уровень доказательности В).
Наиболее широкое распространение в нашей стране получил АМКР спиронолактон, однако врачи, назначая его в рекомендованных небольших дозах как нейрогормональный модулятор, ожидают и диуретического эффекта, который в этом случае не выражен.
В настоящее время появляются новые АМКР; в частности, прошел испытания и рекомендован к применению пациентами с ХСН препарат эплеренон, также относящийся к селективным антагонистам рецепторов альдостерона.
Диуретики
Положительное действие диуретиков при ХСН основано на способности препаратов этой группы угнетать реабсорбцию натрия и/или воды в канальцах почек и усиливать диурез. Благодаря снижению объема циркулирующей крови под влиянием мочегонных препаратов уменьшаются пред- и постнагрузки, происходит гемодинамическая разгрузка сердца. Показанием к началу терапии диуретиками являются очевидные признаки застоя, как правило, начиная со ХСН II ФК (класс рекомендаций I, уровень доказательности В). Детям с СН I стадии диуретики, подавляющие реабсорбцию натрия в нефроне, не назначаются. При СН IIА-стадии, когда пациенты страдают небольшой задержкой жидкости и нет отека легких, назначают тиазидные диуретики. Наиболее часто в детской практике применяется комбинация гидрохлоротиазида с калийсберегающим препаратом триамтереном (Триампур). Однако тиазиды неэффективны при сниженной функции почек. У этих больных, а также в случаях более выраженной задержки жидкости необходимо применение петлевых диуретиков (фуросемид). Эффективно их сочетание с конкурентными антагонистами альдостерона (спиронолактон), которые могут быть назначены и изолированно. Диуретики являются неотъемлемой частью комплексного лечения детей с СН IIБ и III стадий при наличии отечного синдрома, которое включает 2 фазы: 1-я – фаза активной диуретической терапии или форсированного диуреза (устранение клинических признаков легочного застоя и задержки жидкости в организме, ортопноэ, периферических отеков, гепатомегалии, гидроторакса, асцита), при этом количество выделяемой мочи должно превышать количество потребляемой жидкости; 2-я – фаза поддерживающей диуретической терапии (сохранение достигнутого эуволемического состояния). При этом следует отдавать предпочтение мощным диуретикам (фуросемид, этакриновая кислота). Для лечения рефрактерных отеков целесообразно комбинирование тиазидов и петлевых диуретиков.
В настоящее время в терапии застойной СН особое место отводится торасемиду, первому диуретику, способному влиять не только на симптоматику больных ХСН, но и на прогрессирование болезни, а также течение патологических процессов в сердечной мышце. В многочисленных исследованиях показаны антиальдостероновые эффекты торасемида, сопровождающиеся достоверным уменьшением фиброза миокарда и параллельным улучшением диастолических свойств миокарда [26]. Выраженные положительные клинические результаты лечения торасемидом и его преимущество перед фуросемидом объясняются дополнительной антиальдостероновой активностью препарата.
Диуретики начинают назначать с низких доз, постепенно их увеличивая до достижения достаточного диуретического эффекта. Терапия проводится путем ежедневного приема минимальной поддерживающей дозы диуретика. Нередко рекомендуемое врачами применение ударных доз 1–2 раза в неделю нецелесообразно, т.к. увеличивает риск развития побочных эффектов.
Контроль эффективности терапии мочегонными средствами следует осуществлять не только на основании измерения диуреза и сопоставления его с количеством принятой жидкости, но и путем взвешивания больного. При недостаточном диуретическом эффекте целесообразно увеличивать дозу, пересматривать режим приема препаратов или путь их введения (внутривенное введение), использовать комбинацию мочегонных средств с ингибиторами карбоангидразы, которые как самостоятельные средства в лечении ХСН не применяются из-за недостаточного диуретического действия. Представитель этой группы ацетазоламид используется в качестве вспомогательного средства на фоне приема активных мочегонных (тиазидных и/или петлевых). Назначаемый в возрастной дозе в течение 3–4 дней с двухнедельным перерывом, этот препарат подкисляет среду, что восстанавливает диуретическую активность тиазидных и петлевых диуретиков, при длительном применении которых типично развитие алкалоза [6].
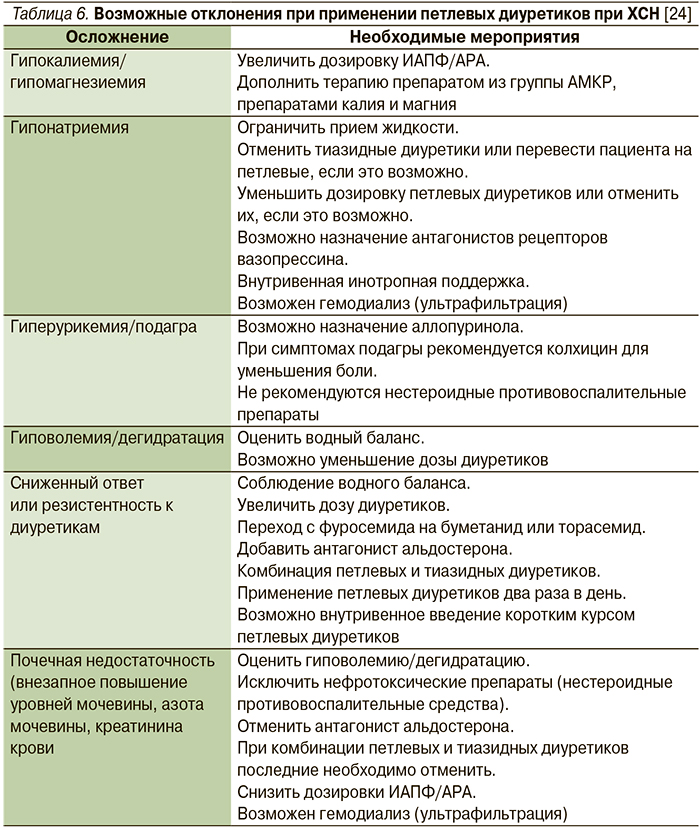
Диуретики не следует применять в качестве монотерапии даже в случае умеренно выраженной ХСН из-за усиления нейрогуморальной активации и развития ряда побочных эффектов, оказывающих неблагоприятное влияние на течение ХСН. Важно учитывать возможные осложнения при применении петлевых диуретиков (табл. 6).
Сердечные гликозиды
Единственным препаратом группы сердечных гликозидов, рекомендованным в настоящее время для лечения пациентов с ХСН, является дигоксин.
Сердечные гликозиды имеют три основных механизма действия – положительный инотропный, отрицательный хронотропный и нейромодуляторный. Это хорошо и давно известный факт, однако врачи, как правило, считают главным именно положительное инотропное действие гликозидов, что совершенно необоснованно. Более того, назначение дигоксина как положительного инотропного агента не может считаться правильным и оправданным при ХСН. Дело в том, что, оказывая мощное позитивное инотропное действие, препарат также приводит к быстрому развитию гликозидной интоксикации. При использовании малых доз инотропное действие дигоксина выражено слабо и на передний план выходят отрицательный хронотропный (а также нормализация диастолы, в особенности при мерцательной аритмии) и нейрогормональный модулирующий эффекты, которые и определяют его положительное влияние, не стимулируя развития нарушений сердечного ритма.
Патогенетически обосновано назначение дигоксина пациентам с умеренной или тяжелой ХСН, если ее симптомы сохраняются, несмотря на терапию диуретиками и ИАПФ, а также если имеется тяжелая систолическая дисфункция ЛЖ (ФВ < 25 %) или сохраняется кардиомегалия (кардиоторакальный индекс > 0,55; класс рекомендаций IIА, уровень доказательности B).
В настоящее время при лечении ХСН рекомендуется использование невысоких доз дигоксина, при применении которых полностью проявляется его экстракардиальное нейромодуляторное действие и не выражено инотропное и проаритмическое влияния. Дигоксин может быть назначен с целью инициального контроля ЧСС декомпенсированным больным ХСН с мерцательной аритмией (ЧСС в покое > 80 уд/мин, при нагрузке > 110–120 уд/мин) еще до того, как им можно будет назначить БАБ. В долгосрочной перспективе с этой целью предпочтительны либо БАБ, либо их комбинация с дигоксином. Следует помнить, что дигоксин хорошо контролирует ЧСС в покое, но хуже – при физической нагрузке.
Антикоагулянты
Важным условием успешного лечения ХСН является коррекция нарушений гемостаза и функционального состояния внутренних органов (печени, почек, желудочно-кишечного тракта и др.), которые наблюдаются довольно часто. Особенно грозными клиническими проявлениями ХСН остаются тромбозы и эмболии, которые у детей встречаются главным образом при дилатационной кардиомиопатии и инфекционном эндокардите.
У больных ХСН фактором высокого риска тромбоэмболий служит стаз крови в полостях сердца, наблюдаемый при выраженной дилатации ЛЖ, который способствует развитию как периферического венозного, так и внутрисердечного тромбоза и рассматривается в качестве источника будущих тромбоэмболий. К дополнительным предрасполагающим факторам относятся интенсивная дегидратационная терапия и нахождение больного на постельном режиме (при декомпенсации). Поэтому важную роль в терапии этого синдрома играют антикоагулянты. Таким больным в отсутствие противопоказаний в обязательном порядке назначается варфарин под контролем международного нормализованного отношения, которое должно поддерживаться на уровне от 2 до 3 [6].
Негликозидные инотропные средства
К негликозидным положительным инотропным агентам, применяемым при лечении ХСН, относят дериваты катехоламинов (дофамин, добутамин), ингибиторы фосфодиэстеразы (амринон, милринон, левосимендан), а также глюкагон. Они могут оказывать положительное действие при лечении декомпенсации ХСН, но при длительном назначении эти препараты приводят к увеличению риска смерти среди больных СН (уровень доказательности А) [4, 17]. По этой причине эти препараты не рекомендуются в качестве длительной терапии ХСН, но могут применяться в период декомпенсации при значимых нарушениях гемодинамики.
Антиаритмические средства
Отдельного рассмотрения требуют подходы к лечению ХСН у детей с нарушениями ритма сердца, которые в одних случаях являются следствием, в других – причиной гемодинамических нарушений. В зависимости от этого определяется тактика лечения больных. В тех случаях, когда аритмии непосредственно связаны с органической патологией, терапевтическая тактика зависит от характера заболевания. Однако у детей нарушения ритма сердца могут быть самостоятельной причиной развития ХСН. В частности, ХСН часто возникает у детей раннего возраста при длительно некупируемом приступе пароксизмальной тахикардии. Нередко ХСН развивается у детей с хронической непароксизмальной тахикардией, являясь одним из серьезных клинических проявлений т.н. аритмогенной дисфункции миокарда. Назначение антиаритмиков пациентам с ХСН должно проводиться с исключительной осторожностью вследствие опасности возникновения проаритмического эффекта. Считается, что лечения требуют только аритмии, представляющие угрозу жизни.
При этом предпочтение отдается представителям группы БАБ, улучшающим гемодинамику и обладающим слабым антиаритмическим свойством. При необходимости возможно использование амиодарона при условии контроля побочных эффектов. Применение препаратов I класса при ХСН противопоказано (уровень доказанности А) [4]. Наиболее эффективным и безопасным методом лечения аритмий, развившихся на фоне ХСН, является имплантация кардиовертера-дефибриллятора. Также возможно применение ресинхронизирующей терапии, которая, оптимизируя сокращение камер сердца при помощи электрических импульсов, позволяет облегчить работу миокарда и замедлить прогрессирование ХСН.
Таким образом, во второй половине ХХ в. произошла смена нескольких концепций прогрессирования ХСН и прямым следствием этого стало изменение подходов к лечению больных. Модулирование активности различных систем, участвующих в патогенезе ХСН на циркуляторном, тканевом и клеточном уровнях, привело к улучшению прогноза пациентов с этой тяжелой патологией. На сегодняшний день своевременное и адекватное применение фармакотерапии больных ХСН наряду с улучшением качества жизни приводит и к снижению смертности. Однако следует подчеркнуть, что на качестве и эффективности получаемого пациентами лечения негативно сказывается низкая приверженность практикующих врачей существующим клиническим рекомендациям, четкое и неукоснительное соблюдение которых позволяет избегать тактических ошибок в ведении больных ХСН и добиваться лучших результатов.


