Введение
В настоящее время в литературе используется несколько терминов, обозначающих изменения в скелетной мускулатуре: кахексия, атрофия и саркопения. Каждое из этих состояний – результат метаболических адаптационных процессов, связанных с деградацией белков (кахексия), со снижением их синтеза (атрофия) или протекающих одновременно (саркопения) [1]. Кахексия характеризуется снижением мышечной массы и общей массы тела и обусловлена влиянием факторов, вызванных каким-либо заболеванием. Саркопения, как правило, является возраст-ассоциированным патологическим состоянием, сопровождающимся нарушением мышечной функции. Нередко саркопению и синдром старческой немощи (frailty) относят к гериатрическим синдромам, которые являются мощными предикторами смертности [2]. Саркопения при сочетании с остеопорозом у пожилых пациентов приводит к повышению риска смертности, т. к. является самостоятельным предиктором падений, приводящим к возникновению переломов при минимальной травме.
Иволютивные процессы в мышечной ткани стали объектом изучения в связи с увеличением продолжительности жизни практически во всех странах и на всех континентах. Cтарение населения в мире приобрело глобальные масштабы. В некоторых странах уже сейчас доля людей в возрасте старше 60 лет достигает 20 %. Не миновал этот процесс и Российскую Федерацию, в некоторых регионах которой (например, Санкт-Петербург) 21,1 % составляют люди старшего возраста. Первые упоминания о мышечной слабости пожилых людей относятся к 1931 г., когда молодой невролог из госпиталя Королевского колледжа Лондона Macdonald Critchley подробно описал эти изменения в журнале Lancet, назвав их сенильной атрофией [3]. Позже, в 1970-е гг., появилась серия работ под руководством Nathan Shock, посвященных нарушению мышечной функции, обусловленной возрастом [4]. Термин «саркопения» был впервые предложен Irwin Rosenberg в 1988 г. на конференции в New Mexico (США), а сам феномен автором определен как снижение массы и силы скелетных мышц в процессе старения и опубликован в 1989 г. [5]. С появлением рекомендаций и разработкой подходов к оценке мышечной массы и мышечной функции стало возможно изучать распространенность этого синдрома в популяции. Этой проблематике были посвящены многочисленные работы J.E. Morley начиная с 1993 г. Следует обратить внимание на то, что некоторые авторы, не оспаривая термин «саркопения» в нынешнем представлении, предлагают ввести термин «динопения», понимая под ним снижение мышечной силы [6]. В качестве одного из обоснований они выдвигают факт более быстрого снижения мышечной силы по сравнению с мышечной массой по мере старения, что может иметь определяющее значение для наступления неблагоприятных событий.
Достаточно трудно сопоставить эпидемиологические данные, полученные в ходе исследований по изучению распространенности саркопении, в связи с отсутствием четких критериев синдрома, использованных методик определения, расовыми, половыми, географическими и другими различиями. Вместе с тем считается, что примерно 5–13 % людей в возрасте 60–70 лет имеют саркопению и их число увеличивается до 11–50 % к 80 годам [7]. Сопоставимые результаты были получены в другом исследовании, подтвердившем представленный ранее уровень заболеваемости (или пораженности), предоставив цифры от 8 до 40 % среди всех людей старше 60 лет [8]. Прогрессирование саркопении приводит к развитию другого гериатрического синдрома – frailty, но не все пациенты с саркопенией имеют этот синдром. Распространенность саркопении в 2 раза выше, чем синдрома frailty [9].
Пожалуй, нет какой-либо другой ткани, как мышечная, которая столь быстро и в таком объеме терялась бы с возрастом. Считается, что средние потери мышечной массы человека составляют около 1 % в год после 35–40 лет, или 3–8 % на каждое следующее десятилетие, а после 60 лет этот процесс резко ускоряется [10, 11].
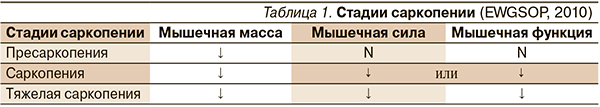
В связи с тем что вклад саркопении в ухудшение здоровья населения стал более чем очевидным, в 2010 г. была создана Европейская рабочая группа по саркопении у пожилых людей (European Working Group on Sarcopenia in Older People – EWGSOP), которая разработала клиническое определение и достигла консенсуса в формировании общих диагностических критериев для саркопении, обусловленной возрастом [12]. Таким образом, в соответствии с EWGSOP саркопения как синдром характеризуется прогрессирующей и генерализованной потерей скелетной мышечной массы и силы с высоким риском неблагоприятных исходов, таких как инвалидность, низкое качество жизни и смертность. Для диагностики саркопении EWGSOP рекомендует использовать методики, позволяющие оценивать снижение мышечной массы, силы и функции.
Постановка диагноза саркопении основывается на выявлении двух из трех нижеперечисленных критериев. Причем наличие первого критерия обязательно. Критерии саркопении: 1) снижение мышечной массы; 2) снижение мышечной силы; 3) снижение мышечной функции.
EWGSOP предлагает также выделить стадии саркопении с учетом постепенного и неуклонно прогрессирующего ее развития: пресаркопению, саркопению и тяжелую саркопению (табл. 1) [12].
Пресаркопеническая стадия характеризуется только снижением мышечной массы, что не влияет на мышечную силу и функцию. Наряду со снижением массы скелетных мышц саркопения характеризуется снижением ее силы или функции. Тяжелая саркопения является этапом развития синдрома, когда выявляются все три критерия: низкая мышечная масса, низкая мышечная сила и нарушенная функция. Выделение стадийной классификации может дать возможность разработать меры профилактики и лечения, установить соответствующие цели восстановления на каждом из этапов.
Факторы риска и основные причины саркопении
Количество опубликованных работ по различным аспектам проблемы саркопении неуклонно увеличивается, однако патогенез данного синдрома сложен и многогранен.
Выделяют четыре группы факторов риска развития саркопении:
- Конституциональные факторы: женский пол, низкий вес при рождении, генетическая предрасположенность.
- Образ жизни и влияние окружающей среды: недостаточное питание, голодание; низкое потребление белков, алкогольная зависимость, курение, низкая физическая активность, длительная иммобилизация, пребывание в невесомости.
- Возрастные изменения в системе анаболических/катаболических процессов в мышцах и других органах; преобладание распада белков над их синтезом; уменьшение числа мышечных клеток за счет активации апоптоза, увеличение уровня миостатина; нарастание гормональной дисфункции (снижение уровня эстрогена, тестостерона, холекальциферола, гормона роста, инсулиноподобного фактора роста 1, инсулинорезистентность); нарушение нервно-мышечной регуляции (уменьшение числа α-мотонейронов, денервация моторных единиц и др.); митохондриальная дисфункция и уменьшение периферического кровообращения.
- Хронические заболевания: когнитивные нарушения, сахарный диабет, сердечная, печеночная, почечная и дыхательная недостаточность, дегенеративные заболевания суставов, хронический болевой синдром, ожирение, злокачественные новообразования, хронические воспалительные заболевания.
В отсутствие должной профилактики саркопения может трансформироваться из возрастзависимого физиологического в патологическое состояние. Несмотря на то что саркопения в основном наблюдается среди пожилых людей, она может развиваться и в молодом возрасте.
В зависимости от причины, вызвавшей развитие саркопении, выделяют следующие ее типы (EWGSOP):
- Первичная саркопения (саркопения, ассоциированная с возрастом).
- Вторичная саркопения:
- саркопения, ассоциированная со сниженной физической активностью (малоподвижный образ жизни, длительная иммобилизация, отсутствие гравитации);
- саркопения, ассоциированная с хроническим заболеванием (тяжелые заболевания сердечно-сосудистой системы, легких, печени, почек, головного мозга, воспалительные заболевания, заболевания эндокринной системы, злокачественные новообразования);
- саркопения, ассоциированная с недостаточным питанием (недостаточное потребление углеводов и белков с пищей как при мальабсорбции, желудочно-кишечных расстройствах, так и при использовании медикаментов, провоцирующих анорексию).
Методы диагностики
Существует широкий спектр методов, которые могут быть использованы для оценки мышечной массы, силы и ее функции как в научных исследованиях, так и в повседневной клинической практике (табл. 2) [13].
Двойная рентгеновская абсорбциометрия (DXA) считается наиболее точной и воспроизводимой методикой, позволяющей определять массу жировой ткани, костную минеральную массу, а также нежировую массу мягких тканей (тощую массу) с точностью до грамма [14]. Результаты компьютерной обработки результатов дают информацию как для всего тела, так и отдельно для каждой конечности, верхней и нижней половины туловища. В тощую массу туловища входят также паренхиматозные органы. Тощая масса конечностей наиболее точно совпадает с их мышечной массой, т. к. в конечностях в тощую массу помимо мышц входят только кожа, связки и сосудистая система. В качестве клинического порога, при котором можно говорить о наличии саркопении, предложено считать снижение индекса нежировой массы мягких тканей конечностей (тощей массы) на 2 стандартных отклонения по сравнению с лицами молодого возраста (от 18 до 40 лет) с учетом пола. Индекс определяется как вес нежировой массы мягких тканей конечностей, выраженный в килограммах, деленный на квадрат роста пациента, выраженный в метрах (тощая масса [кг]/рост² [м²]). Соответственно, данному индексу выделяют умеренную и тяжелую саркопению (табл. 3) [15].
Методология оценки саркопении с помощью компьютерной и магнитно-резонансной томографии заключается в следующем: вначале по аксиальному срезу, выполненному на уровне тела третьего поясничного позвонка L3, определяется площадь (см2) поперечно-полосатой мускулатуры вручную либо с помощью специального программного обеспечения. Отношение полученного показателя площади скелетной мускулатуры к квадрату роста пациента является «скелетно-мышечным индексом L3» (СМИ L3). Пороговыми значениями СМИ L3, ниже которых состояние расценивается как саркопения, считаются 52,4 см2/м2 для мужчин и 38,5 см2/м2 для женщин [16].
Биоимпедансный анализ позволяет получать точные данные о количестве жира, мышечной ткани и содержания воды в организме. Принцип работы биоимпедансного анализатора основан на измерении электропроводимости тела с помощью слабого тока. Однако рассчитываемый индекс (отношение скелетной мышечной массы к общей массе тела) может существенно изменяться в зависимости от гидратации человека, его телосложения, пола, возраста.
Измерение окружности плеча в средней трети и оценка толщины кожной складки широко используются в клинической практике. Доказано, что размер окружности плеча и голени коррелировали с мышечной массой. Нормальной считается окружность плеча ≥ 31 см. Однако возрастные изменения кожи, а также отложения подкожного жира не позволяют использовать этот метод для оценки мышечной массы в пожилом возрасте [17].
Динамометрия кисти служит для оценки мышечной силы и может быть выполнена в стандартных условиях при помощи динамометра. Нормальным показателем для женщин считается сила сжатия динамометра ≥ 20 кг, для мужчин ≥ 30 кг [18].
Сила мышц разгибателей колена может быть измерена изометрически или изокинетически, причем последняя лучше отражает мышечную функцию в повседневной деятельности. Изометрическое измерение силы определяется как сила, приложенная к лодыжке в положении сидя на стуле с прямой спиной и согнутыми под углом 90° коленями. Современные изокинетические динамометры позволяют измерять силу при различных угловых скоростях. Измерение можно проводить у немощных пожилых людей. Эти методы пригодны для научных исследований, но их использование в клинической практике ограничено необходимостью специального оборудования.
Пиковая скорость выдоха у людей без патологии дыхательной системы определяется силой дыхательных мышц. Однако данный метод исследования не может использоваться в качестве изолированного теста для оценки мышечной силы.
SPPB-тест – это совокупность тестов на равновесие, выносливость, скорость походки, предложенных для оценки функции скелетных мышц EWGSOP в 2010 г. [19].
Измерение скорости походки является частью SPPB-тестов, но она также может быть использована в качестве отдельного теста для оценки мышечной функции. Для выполнения теста необходимо преодолеть расстояние в 4 метра с обычной скоростью. Тест считается пройденным, если скорость передвижения испытуемого составляет менее 0,8 м/с. Если скорость передвижения более 0,8 м/с, необходимо проводить измерение мышечной силы.
Тест «Встань и иди» заключается в том, что испытуемому необходимо встать со стула, пройти расстояние 3 метра, развернуться, возвратиться и снова сесть. Таким образом, тест выступает в качестве оценки динамического равновесия. Оценивается тест по пятибалльной шкале и в норме должен выполняться за 10–12 секунд. Данный тест используется в гериатрической практике для оценки степени устойчивости и риска падений.
Профилактика и лечение саркопении
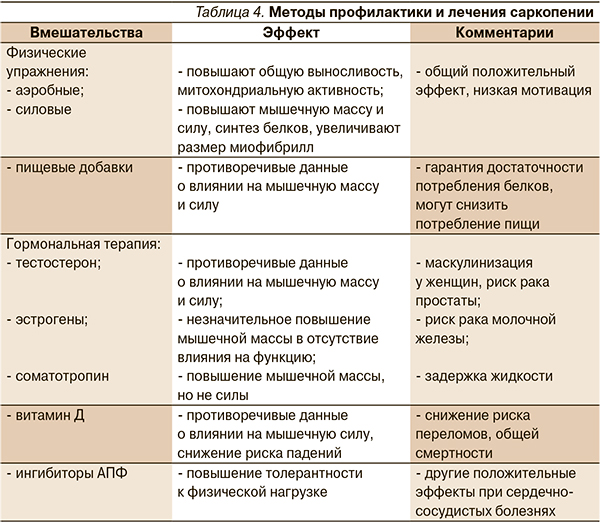
С учетом многофакторности и полиэтиологичности синдрома саркопении не может существовать какой-либо один метод профилактики и лечения. Для решения проблемы предлагается много методов лечения, однако питание и физические упражнения являются основой предупреждения прогрессирования саркопении (табл. 4).
Пациентам старшего возраста показаны аэробные упражнения и упражнения на сопротивление (или силовые), способные снижать скорость потери мышечной массы и силы [20]. Аэробные упражнения (плавание, ходьба) улучшают работу сердечно-сосудистой системы и повышают выносливость организма. В то же время в некоторых работах показано, что они способны увеличивать площадь поперечного сечения мышечных волокон, повышать активность ферментов и снижать митохондриальную дисфункцию, тем самым увеличивая синтез протеинов [21]. Аэробные движения могут также уменьшать содержание внутримышечного жира [22]. Увеличение мышечной силы в пожилом возрасте может быть достигнуто при помощи упражнений на сопротивление [23]. W.R. Frontera и соавт. (1988) показали, что при проведении 12-недельного курса упражнений на сопротивление у мужчин в возрастной группе старше 65 лет отмечено увеличение площади поперечного сечения в мышцах на 11 %, а также повышение мышечной силы практически вдвое [24]. Аналогичные результаты были получены в другом исследовании, в котором улучшение мышечной силы имело место даже у людей в возрасте старше 90 лет при выполнении упражнений в течение 10–12 недель [25]. На основании данных S.M. Roth и соавт. (2001) сделано следующее заключение: при проведении 6-месячного курса упражнений на сопротивление у людей в возрасте 65–75 лет наблюдалось повышение площади поперечного сечения мышц, которое достигалось в молодом возрасте [26]. При выполнении упражнений на сопротивление увеличивается синтез белков, размеров мышечных волокон I и II типов, тем самым увеличивается мышечная сила [27]. Систематический обзор Кокрановской электронной библиотеки (2003) показал, что упражнения на сопротивление периодичностью хотя бы 2–3 раза в неделю способны улучшать физическую активность пожилых людей, скорость походки, способность к балансировке, подъем по лестнице [28]. Также по результатам этого обзора было выявлено, что обучение упражнениям на сопротивление представляется относительно безопасным даже для пациентов с несколькими сопутствующими заболеваниями и может помочь в предотвращении падений [29].
Проведенные исследования с участием пожилых людей, проживавших в домах престарелых, показали, что физические упражнения на сопротивление приводят к увеличению мышечных волокон на 3–9 %, мышечной силы вдвое, а также улучшению физической работоспособности, скорости ходьбы и подъема по лестнице [27, 28]. При проведении обучения пожилых людей методикам выполнения физических упражнений необходима их мотивация, что требует подбора грамотного персонала.
Согласно рекомендациям RDA (Recommended dietary allowance), необходимое суточное потребление белка должно составлять 0,8 г/кг массы в день. Примерно 40 % людей старше 70 лет не придерживаются данных рекомендаций [30]. Низкобелковая диета приводит к значительному снижению мышечной силы и мышечной массы у женщин в возрасте старше 65 лет [31]. Тем не менее пожилым людям, принимающим достаточное количество белковых продуктов при отрицательном азотистом балансе, необходимо более высокое содержание белка [32]. Однако, по результатам систематического обзора Кокрановской электронной библиотеки (2009), не было выявлено положительного влияния пищевых добавок, содержащих белок, в старшей возрастной группе на состояние мышечной ткани [33].
Некоторые исследования дают противоречивые результаты по поводу положительного влияния сбалансированного питания и физических упражнений на сопротивление на функциональное состояние мышечной ткани пожилых людей. В одном рандомизированном клиническом исследовании, проведенном в доме престарелых в течение 10 недель, было показано, что дополнительные 360 калорий способны увеличивать силу мышц ног [27]. Другое рандомизированное клиническое исследование показало, что использование в течение 12 недель пищевых белковых добавок способно увеличивать мышечную массу, но не мышечную силу [34]. Необходимо проводить оценку пищевой ценности продуктов питания, особенно при низком уровне общей массы тела.
C. Leeuwenburgh и соавт. (2005) показали, что сочетание высококалорийной диеты с физическими нагрузками наиболее благоприятно для сохранения массы и силы мышц, т. е. предотвращения саркопении при старении [35].
Множество работ посвящено возможному влиянию витамина Д на мышечную функцию и снижение риска падений, которые у людей старшего возраста обусловлены снижением мышечной силы в нижних конечностях и нарушением координации. Уровень 25(ОН) Д в сыворотке крови в интервале между 40 и 94 нмоль/л соотносился с лучшими показателями мышечной функции в нижних конечностях, что было показано во время выполнения пациентами тестов на вставание со стула и подъема по лестнице (8-ступенчатый тест) [36].
Взаимоотношения между уровнем 25(ОН) Д и синдромом старческой немощи, оцененным по наличию клинических проявлений (слабость, утомляемость, медлительность) и уровню физической активности, были исследованы как для женщин, так и для мужчин. Для женщин U-образная кривая показала оптимальный уровень витамина 25(ОН) Д между 50 и 75 нмоль/л [37]. Встречаемость синдрома старческой немощи у женщин, чей уровень 25(ОН) Д был ниже 37,5 нмоль/л, составил 47 %, в то время как у женщин, у которых 25(ОН) Д находился в пределах 50–75 нмоль/л, лишь у 32 % (ОР – 1,32, 95 % ДИ – 1,06–1,63) [16]. Похожее исследование мужчин показало, что синдром старческой немощи у них встречался реже, когда значения 25(ОН) Д находились в пределах 50 и 75 нмоль/л, при этом по сравнению с женщинами наблюдался существенно реже при высоком уровне 25(ОН) Д, но большим ДИ [38]. Однако никакие из этих исследований не продемонстрировали достоверного взаимоотношения между высоким уровнем 25(ОН) Д и низким риском развития синдрома старческой немощи или смерти.
Влияние витамина Д на риск падений изучен в двух больших недавно проведенных мета-анализах. Так, M.H. Murad и соавт. (2011) показали статистически значимое снижение риска падений в 26 рандомизированных клинических исследованиях при применении витамина Д (OР – 0,85; 95 % ДИ – 0,77–0,95). Этот эффект был более значимым для пациентов с дефицитом витамина Д [39]. H.A. Bischoff-Ferrari и соавт. (2009) провели мета-анализ на основании 8 рандомизированных клинических исследований с включением 2426 пациентов. Ими было показано, что среди тех пациентов, у которых содержание 25(ОН) Д было 60 нмоль/л и более, относительный риск падений снижался на 23 % [40].
Заключение
Внедрение методов диагностики саркопении в клиническую практику позволит улучшить качество оказания специализированной гериатрической помощи населению. Расширение возможностей медицинских организаций по внедрению программ реабилитации, обучению людей старшего возраста правилам выполнения физических упражнений, рациональному питанию, обоснованному применению лекарственной терапии, направленных на сохранение мышечной массы/функции, будет способствовать снижению росту таких неблагоприятных событий, как падения, переломы, инвалидность, преждевременная смерть.




