Острые респираторные вирусные инфекции (ОРВИ) занимают ведущее место в инфекционной патологии детского возраста. Одним из вариантов течения респираторной инфекции у детей раннего возраста является острый стенозирующий ларинготрахеит (ОСЛТ, ложный круп), который часто требует неотложной помощи и может приводить к неблагоприятному исходу. Актуальность проблемы послужила предпосылкой к созданию клинических рекомендаций для врачей «Стенозирующий ларинготрахеит у детей», в работе над которыми приняли участие ведущие специалисты в области педиатрии, отоларингологии и инфекционных болезней из различных регионов РФ.
Острый стенозирующий ларинготрахеит – угрожающее жизни заболевание верхних дыхательных путей различной этиологии, характеризующееся лающим кашлем, дисфонией, инспираторным стридором и стенозом гортани различной степени выраженности.
Чаще всего ОСЛТ вызывается вирусами парагриппа и гриппа, адено- иногда респираторным синцитиальным вирусом и Mycoplasma pneumonia, а также вирусно-вирусными ассоциациями. Ведущим этиологическим фактором, обусловливающим воспалительный процесс в гортани и трахее, сопровождающим развитие синдрома крупа, является вирус парагриппа. На его долю приходится примерно половина всех вирусных ОСЛТ, развивающихся чаще в осеннее-зимний период. Бактериальный ларингит встречается крайне редко. Однако бактериальная флора, активизирующаяся при ОРВИ или присоединяющаяся в результате внутрибольничного инфицирования, может иметь важное значение в развитии неблагоприятного (тяжелого, осложненного) течения ОСЛТ.
Наиболее часто ОСЛТ возникает у детей второго и третьего года жизни (более 50 % заболевших), несколько реже – в грудном возрасте (6–12 месяцев) и на четвертом году жизни. ОСЛТ редко возникает у детей старше 5 лет и никогда в первые 4 месяца жизни. Поскольку основная клиника ОСТЛ обусловлена выраженностью стеноза гортани на фоне ОРВИ, в отсутствие признаков ОРВИ следует проводить дифференциальный диагноз с другими заболеваниями, сопровождающимися стенозом гортани.
Предрасполагающими факторами к развитию ОСЛТ являются анатомо-физиологические особенности детской гортани и трахеи: малый диаметр, мягкость и податливость хрящевого скелета; короткое узкое преддверие и воронкообразная форма гортани; высоко расположенные и непропорционально короткие голосовые складки; гипервозбудимость мышц-аддукторов, замыкающих голосовую щель; функциональная незрелость рефлексогенных зон и гиперпарасимпатикотония. Обилие лимфоидной ткани у детей раннего возраста с множеством тучных клеток, сосудов, слабое развитие эластических волокон в слизистой оболочке и подслизистой основе быстро приводят к отеку подсвязочного пространства и способствуют развитию ОСЛТ. Неблагоприятным фоном служат атопия (у детей с атопическим фенотипом возможна предрасположенность к отеку гортани и рецидивы крупа на фоне ОРВИ), лекарственная аллергия, аномалии строения гортани, сопровождающиеся врожденным стридором, паратрофия, перинатальное поражение ЦНС, недоношенность.
В результате вирусной инфекции возникает воспалительный отек с клеточной инфильтрацией голосовых связок, слизистой подскладочного пространства, трахеи и прилегающих тканей, сопровождающийся гиперсекрецией слизистых желез и скоплением в просвете дыхательных путей густой мокроты, а также рефлекторным ларингоспазмом. Наличие густой мокроты в просвете дыхательных путей, отек и воспалительные изменения слизистой оболочки гортани, в т. ч. и в области голосовых складок, приводят к нарушению смыкания голосовых складок при фонации и вызывают дисфонию.
Острый стенозирующий ларинготрахеит начинается с продромальных явлений в виде субфебрильной или фебрильной лихорадки и катаральных явлений в течение 1–3 дней. Начало заболевания часто внезапное, преимущественно ночью или в вечернее время. Ребенок просыпается от приступа грубого кашля, шумного затрудненного дыхания. Клинические проявления ОСЛТ динамичны и могут прогрессировать во времени от нескольких минут до 1–2 суток, от стадии компенсации до состояния асфиксии. Дисфония нарастает по мере прогрессирования отека вплоть до развития афонии. Отмечается грубый «лающий» короткий отрывистый кашель, громкость которого может меняться: чем больше отек, тем тише кашель. Появляется также инспираторный, или двухфазный, стридор – стенотическое дыхание, обусловленное затрудненным прохождением вдыхаемого воздуха через суженный просвет гортани. Вдох либо и вдох, и выдох (двухфазный стридор) удлинены и затруднены, дыхание приобретает шумный хриплый характер с раздуванием крыльев носа и втяжением уступчивых мест грудной клетки. Сужение подсвязочного отдела гортани можно обнаружить на рентгенограмме шеи в передне-задней и боковой проекции, «симптом шпиля» или «симптом пирамиды». Основной повод для рентгенологического исследования – исключение других причин стридора при атипичном течении. При прогрессировании симптомов выявляется изменение окраски кожных покровов: бледность, периоральный цианоз, усиливающийся во время приступа кашля. Обструкция нижних дыхательных путей клинически отмечается у части детей. Появляется вялость или возбуждение в результате гипоксемии.
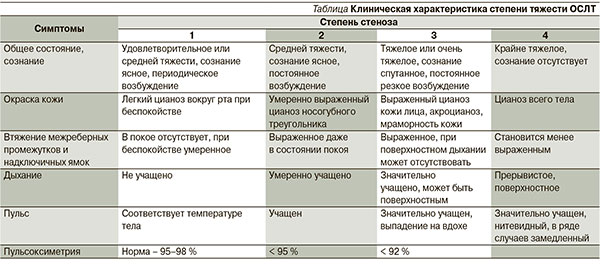
В зависимости от выраженности клинической симптоматики выделяют различные степени стеноза гортани (см. таблицу).
Диагноз основывается на наличии характерной триады симптомов (дисфонии, лающего кашля, инспираторного стридора), а также на других проявлениях ОРВИ.
Основные диагностические мероприятия:
- Сбор анамнеза и жалоб, в т. ч. данные о вакцинации.
- Общий осмотр ребенка.
- Измерение частоты дыхания, аускультация легких, АД, пульса, пульсоксиметрия.
По показаниям проводится общий анализ периферической крови (число лейкоцитов обычно в пределах нормы, может отмечаться лимфоцитоз или лейкопения), газы крови, консультация ЛОР-врача, фиброэндоскопия гортани (при необходимости дифференциальной диагностики). При состоянии ребенка, не требующем реанимационных мероприятий, только данные фиброларингоскопии в сочетании с анамнестическими сведениями, результатами объективного осмотра и дополнительными методами обследования позволяют рекомендовать осмотр дыхательных путей под наркозом, который должен включать прямую ларингоскопию, желательно – с использованием микроскопа, трахеобронхо- и эзофагоскопию.
При необходимости дифференциальной диагностики проводится вирусологическая диагностика (атипичная картина крупа, смешанный характер дыхательных нарушений, наличие сопутствующих катаральных изменений в легких), бактериологическое исследование (слизь из ротоглотки, носа) для исключения дифтерии, бактериоскопия мазков при подозрении на дифтерийный круп (ребенок из очага дифтерии; сочетание стеноза гортани с ангиной и отеком подкожной клетчатки шеи).
Стеноз гортани может быть молниеносным (чаще при спазмах голосовых складок, инородном теле гортани и трахеи), острым (до 2 недель) – при ОРВИ (собственно ОСЛТ), дифтерии гортани. Сохранение симптомов стеноза гортани более 2 недель указывает на подострые или хронические стенозы гортани, обусловленные поражением других органов и систем, сдавлением извне или обтурацией гортани или являющимися осложнением интубации трахеи, врожденной патологии.
Оценка степени стеноза гортани обусловливает медицинскую тактику и объем медицинских вмешательств, оказываемых ребенку. Объем медицинской помощи больному ребенку, несомненно, зависит также от этапа оказания медицинской помощи. Лечебные мероприятия при ОСЛТ должны быть направлены на как можно быстрое восстановление дыхательной функции и улучшение состояния больного, предупреждение прогрессирования стеноза гортани и летального исхода. При обращении родителей за медицинской помощью в поликлинику (вызов врача на дом) диспетчер обязан уточнить давность появления симптомов ОРВИ, осиплости, затрудненного дыхания, беспокойства или вялости ребенка и направить на госпитализацию.
Показания к госпитализации:
- Все дети со 2-й и выше степенью стеноза гортани.
- При 1-й степени:
-
- дети до года жизни;
- отсутствие эффекта от проводимой терапии;
- предшествующие применения кортикостероидов;
- недоношенность;
- сопутствующая патология;
- врожденные аномалии развития гортани;
- эпидемиологические показания;
- по социальным показаниям.
Патогенетически обосновано использование глюкокортикостероидов (ГКС) (оказывают противовоспалительный эффект, вызывают снижение проницаемости капилляров, уменьшение отека гортани и экссудации). До недавнего времени терапия крупа при ОРВИ ограничивалась ингаляциями увлажненного воздуха или парокислородной смеси, а при тяжелом ларинготрахеальном стенозе – с дополнительным введением системных ГКС. Однако введение системных ГКС сопряжено с высоким риском развития побочных эффектов, поэтому широкое их применение в педиатрической практике нежелательно. Современные стандарты терапии обструктивных состояний респираторного тракта в качестве эффективных противовоспалительных средств рекомендуют широкое использование ингаляционных ГКС. Терапия ингаляционными ГКС настолько быстро и эффективно купирует симптомы ОСЛТ, обусловленные отеком слизистой оболочки дыхательных путей, что получила название медикаментозной трахеотомии.
В настоящее время первая линия терапии ОСЛТ – ингаляционный ГКС будесонид суспензия в дозе 2 мг однократно или 1 мг дважды через 30 минут.
Будесонид – ингаляционный ГКС, обладающий выраженной противовоспалительной активностью. Биодоступность будесонида составляет 10 % от попавшей в кишечник фракции; около 28 % всасываются из легких. От 85 до 90 % будесонида в крови связываются с белками плазмы. Будесонид подвергается интенсивному метаболизму в печени, причем у детей этот процесс на 40 % быстрее, чем у взрослых; при этом образуются неактивные метаболиты, выводящиеся из организма в основном с мочой.
В систему кровообращения у детей попадает около 6 % от назначенной дозы будесонида, что примерно в 2 раза меньше, чем у взрослых.
Низкий уровень будесонида, определяемый в кровотоке, в сочетании с высоким клиренсом на 1 кг массы и коротким периодом полувыведения позволяет использовать одинаковые дозы будесонида через небулайзер детям дошкольного возраста и взрослым без повышения риска развития нежелательных побочных реакций. Будесонид – единственный ГКС с возможным однократным назначением в сутки. Исследования дозозависимого эффекта при титровании дозы показывают быстрый клинический эффект и улучшение функциональных показателей на низких дозах будесонида. Эффект будесонида в форме суспензии для ингаляций обусловлен быстрым поступлением ГКС непосредственно в дыхательные пути, его высокой местной противовоспалительной активностью, в т. ч. выраженным сосудосуживающим эффектом. Средством доставки будесонида при ОСЛТ является небулайзер. Для будесонида в форме суспензии для инглаций характерно быстрое начало противовоспалительного эффекта – уже в течение 15–30 минут с максимальным улучшением через 3–6 часов.
Небулайзер – универсальная система ингаляции лекарств у детей любого возраста, т. к. не требует специальной техники вдоха и применяется даже к новорожденным. Для доставки будесонида следует использовать струйные и мембранные небулайзеры. Детям небулайзер обеспечивает более надежную доставку препарата в дыхательные пути благодаря простой технике ингаляции, возможности доставки большей дозы препарата и получения эффекта за более короткий промежуток времени. Детям раннего возраста при этом необходимо использовать маску соответствующего размера.
Системные ГКС назначаются из расчета 0,6 мг/кг дексаметазона парентерально однократно. В случае сохранения симптомов стеноза гортани II степени и выше используется повторное введение ГКС в той же дозе. Лечебный эффект от введения стероидов наступает спустя 15–45 минут. Действие ГКС длится 4–8 часов. При возобновлении симптомов необходимо их повторное введение. Преднизолон назначают в дозе 2–5 мг/кг парентерально.
Стероидная терапия может быть продолжена на протяжении нескольких дней, однако со второго дня дозу ГКС снижают.
Противовирусные препараты эффективны в первые 48 часов. Эффективность антибактериальной терапии при вирусном крупе не доказана.
Показания к назначению антибактериальной терапии при ОСЛТ:
- микоплазменная этиология заболевания или подозрение на нее (применяются антибиотики из группы макролидов;
- длительность курса – 7–14 (для азитромицина – 3–5) дней;
- признаки бактериальных осложнений или сопутствующих состояний.
Интубация и трахеостомия осуществляются при неэффективности консервативной терапии и проведении реанимационных мероприятий.
В отношении детей с атопией оправданно включение в комплексную терапию компенсированного стеноза гортани Н1-гистаминолитика 2-го поколения.
Седативная терапия нежелательна, т. к. нивелирует возможность оценки тяжести состояния ребенка, а значит, не позволяет назначать адекватную терапию. После ликвидации острых проявлений стеноза гортани с целью разжижения и удаления мокроты из дыхательных путей при сохраняющемся кашле, обструкции нижних дыхательных путей назначают бронхо- и муколитические препараты внутрь или в ингаляциях (амброксол, ацетилцистеин, бромгексин, карбоцистеин) или комбинированные (сальбутамол + бромгексин + гвайфенезин). Детям старше 2 лет возможно назначение фенспирида в сиропе.
Таким образом, оптимизация стандартов диагностики и лечения детей с ОСЛТ позволят адекватно оценивать тяжесть состояния больных, уменьшать частоту развития осложнений и необходимость в госпитализации, сокращать сроки пребывания пациентов в стационаре и снижать затраты на лечение.