Боль в спине – одна из наиболее актуальных проблем здравоохранения, прежде всего в силу высокой распространенности и величины наносимых обществу экономических потерь. Ежегодно боль в спине возникает у 25–40 % населения, вызывает длительную временную утрату трудоспособности среди 4 %, а стойкую утрату трудоспособности – среди 1 % трудоспособного населения [3, 12].
В сравнительно небольшом количестве случаев (не более 5 %) причиной боли в спине служат заболевания, требующие специфической терапии (остеопороз, спондилит, опухоли, миеломная болезнь и др.). В подавляющем большинстве случаев боль в спине носит скелетно-мышечный характер, связана с дегенеративно-дистрофическими изменениями позвоночника и миофасциальным синдромом. Условно выделяют острую боль, продолжающуюся менее 12 недель, и хроническую, сохраняющуюся более 12 недель, т. е. сверх обычного периода заживления тканей. Хроническую боль в свою очередь условно подразделяют на персистирующую и рецидивирующую [2, 3, 5].
 У 50 % пациентов с острой болью регресс болевого синдрома происходит в течение 2 недель, у 90 % острая боль регрессирует в течение 6 недель. Столь благоприятный кратковременный прогноз должен настраивать врача на благодушный лад: чем бы он ни лечил пациента, он довольно быстро достигнет успеха. Однако на практике все обстоит серьезнее: более чем у половины пациентов болевой эпизод повторяется в течение года либо в течение этого срока происходит формирование персистирующего болевого синдрома. В части случаев хронификация боли – неизбежное следствие дегенеративного процесса или психопатологической предрасположенности пациентов, но иногда это результат неоптимального ведения пациента на этапе острой боли [2, 9, 13].
У 50 % пациентов с острой болью регресс болевого синдрома происходит в течение 2 недель, у 90 % острая боль регрессирует в течение 6 недель. Столь благоприятный кратковременный прогноз должен настраивать врача на благодушный лад: чем бы он ни лечил пациента, он довольно быстро достигнет успеха. Однако на практике все обстоит серьезнее: более чем у половины пациентов болевой эпизод повторяется в течение года либо в течение этого срока происходит формирование персистирующего болевого синдрома. В части случаев хронификация боли – неизбежное следствие дегенеративного процесса или психопатологической предрасположенности пациентов, но иногда это результат неоптимального ведения пациента на этапе острой боли [2, 9, 13].
Клиническая квалификация боли в спине
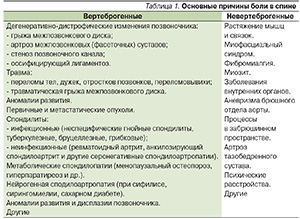
Причины боли в спине многообразны и могут быть разделены на вертеброгенные, связанные с патологией позвоночника, и невертеброгенные, вызванные патологией мышц и связок спины, поражением внутренних органов, забрюшинного пространства, психическими расстройствами и т. д. (табл. 1).
Столь разнообразную патологию можно разделить на четыре основные группы:
- Боль, вызванная специфическими причинами: вертеброгенными (опухоли, остеопороз, спондилит и т. д.) или отраженными (аневризма аорты, панкреатит и т. д.).
- Неспецифическая, преимущественно аксиальная боль (люмбалгия/люмбоишиалгия), которая может быть вызвана миофасциальным синдромом, протрузией диска, фасеточным синдромом, психогенными факторами и т. д.
- Радикулопатия (корешковый синдром), вызванная протрузией диска или стенозом корешкового отверстия.
- Стеноз позвоночного канала с синдромом каудогенной перемежающейся хромоты.
Выделение этих четырех форм позволяет формировать алгоритм диагностического поиска пациентов с болью в спине (рис. 1). Признаки, указывающие на необходимость особенно тщательного обследования пациента с целью выявления заболевания, требующего специфической терапии, т. н. красные флажки, приведены в табл. 2 [13].
Наличие этих признаков требует тщательного дополнительного обследования (см. далее).
Признаки радикулопатии выявляются примерно в 5–10 % случаев боли в спине. Ее самая частая причина – грыжа межпозвонкового диска, но она может быть также связанной со стенозом межпозвонкового отверстия или позвоночного канала. При радикулопатиях боль ощущается преимущественно в конечности и иррадиирует в дистальную часть зоны иннервации соответствующего корешка. Боль, ограничивающаяся областью спины, исключает корешковое поражение. На практике нередки затруднения при дифференциальной диагностике корешкового синдрома, сопровождающегося нейропатической болью, и рефлекторной люмбоишиалгии, представляющей собой разновидность отраженной ноцицептивной боли. Их сравнительная характеристика дана в табл. 3 [1, 4, 12].
 К наиболее четким признакам грыжи межпозвонкового диска с поражением спинномозгового корешка относятся дерматомная иррадиация боли, усиление боли при кашле, чихании, натуживании, признаки денервации в миотоме при электромиографии. Симптом Ласега может быть признаком корешкового синдрома только при соответствующей иррадиации боли (как правило, при сгибании стопы в голеностопном суставе). Ограничение угла, под которым может быть поднята в тазобедренном суставе прямая нога, не специфично для грыжи диска или корешкового поражения, но пригодно для оценки тяжести и динамики вертеброгенного болевого синдрома [4, 12].
К наиболее четким признакам грыжи межпозвонкового диска с поражением спинномозгового корешка относятся дерматомная иррадиация боли, усиление боли при кашле, чихании, натуживании, признаки денервации в миотоме при электромиографии. Симптом Ласега может быть признаком корешкового синдрома только при соответствующей иррадиации боли (как правило, при сгибании стопы в голеностопном суставе). Ограничение угла, под которым может быть поднята в тазобедренном суставе прямая нога, не специфично для грыжи диска или корешкового поражения, но пригодно для оценки тяжести и динамики вертеброгенного болевого синдрома [4, 12].
Основное клиническое проявление стеноза позвоночного канала – нейрогенная (каудогенная) перемежающаяся хромота. Она выражается в появлении при ходьбе или длительном стоянии двусторонних болей, онемения, парестезий, слабости в мышцах голени, реже – бедра, которые уменьшаются в течение нескольких минут, если больной наклонится кпереди или сядет. На долю стеноза позвоночного канала приходится около 5 % случаев боли в спине.
Выявление причины неспецифической аксиальной боли, которая носит гетерогенный характер и составляет более 80 % случаев болевого синдрома в пояснично-крестцовой области, остается трудной задачей и может быть только предположительным. Общепризнанных убедительных клинических или клинико-визуализационных критериев, которые бы позволили выделять различные подварианты боли, связанные, например, с протрузией межпозвонкового диска, дисфункцией фасеточных суставов или крестцово-подвздошного сочленения, не выработано [3, 5].
Если грыжа межпозвонкового диска не сопровождается поражением корешка, она максимально выражена в пояснице, но может распространяться также в ягодицу и бедро. Она может быть постоянной или перемежающейся и обычно усиливается при сгибании и сидении, тогда как при разгибании она может как усиливаться, так и ослабляться. При упражнениях на разгибание можно отметить феномен «централизации» боли, которая ослабляется в ноге, но усиливается в поясничной области.
Артроз межпозвонковых (фасеточных) суставов (спондилоартроз) является причиной боли в спине примерно в 20 % случаев. Клинически спондилоартроз проявляется двусторонней болью, которая в отличие от дискогенной обычно локализуется паравертебрально, а не по средней линии. Боль максимально выражена в пояснице, но нередко иррадиирует в крестцово-подвздошное сочленение, ягодицу, бедро; возможно и более дистальное распространение боли. Как правило, она имеет интермиттирующий характер и усиливается при длительном стоянии и разгибании, особенно при одновременной ротации (хотя это не абсолютный признак!), но уменьшается или по крайней мере не усиливается при наклоне вперед, сидении и ходьбе, а также в положении лежа на спине.
Синдром крестцово-подвздошного сочленения («сакроилеит») проявляется болью в области сочленения, иррадиирующей в пах, большой вертел, ягодицу. При осмотре можно выявить болезненность в области сочленения при пальпации, боковом давлении на таз, отведении бедра против сопротивления, переразгибании или наружной ротации бедра.
Миофасциальный синдром в паравертебральных мышцах может развиваться на фоне дегенеративного процесса в позвоночнике или независимо от него – в связи с длительным пребыванием в нефизиологической позе, хронической микротравматизацией, перегрузкой, перерастяжением или сдавлением мышц, травмой, длительной иммобилизацией. В основе миофасциального синдрома лежит формирование в мышцах триггерных точек, раздражение которых вызывает не только локальную, но и отраженную боль (в удаленной от этой точки зоне). Миофасциальный синдром в малой ягодичной и грушевидной мышцах может имитировать вертеброгенную некорешковую люмбоишиалгию. Триггерной точке соответствует зона локального мышечного уплотнения, пальпация которой не только воспроизводит боль, которую испытывает больной, но и вызывает локальное мышечное сокращение. Инактивация активных миофасциальных зон путем инъекции в них местного анестетика с последующим пассивным растяжением пораженных мышц приводит к купированию болевого синдрома.
Тревога, депрессия или другие психические изменения чаще всего лишь усиливают боль вертеброгенного происхождения, но иногда являются непосредственной причиной боли в спине и ногах. Для психогенной боли характерна диффузность, нелокализованность. При осмотре слабость или онемение также выявляются во всей конечности и не укладываются в анатомические зоны иннервации, болезненность носит поверхностный характер (болезненны кожные покровы) или отмечается в необычных местах (например, над крестцом). Для выявления психогенной боли прибегают к специальным тестам. Например, проверяют симптом Ласега в положении сидя: больные с психогенной болью, которые демонстрировали неспособность в положении лежа поднять ногу выше нескольких градусов, могут в этом положении полностью выпрямить больную ногу. В последние годы выделяют группу признаков, называемых «желтыми флажками», которые указывают на склонность к хронификации болевого синдрома за счет психогенных факторов и требующих особого подхода к лечению. К ним, например, относятся явные эмоциональные расстройства, неанатомическое распределение сенсорных «нарушений», наличие множественных болезненных точек, рентные устремления, неадекватные представления о причинах, значении боли и др. [1–3].

Дополнительное обследование
Основная задача рентгенографии позвоночника – исключить травматические или патологические переломы, врожденные аномалии, инфекционные или воспалительные заболевания, первичные или метастатические опухоли. Она показана всем больным с травмой, стойким (более 4 недель) болевым синдромом, а также всем больным, направляемым на физио- или мануальную терапию. Часто рентгенография необходима, чтобы убедить больного в доброкачественности его заболевания. Люмбализация, сакрализация, spina bifida обычно не становятся непосредственной причиной болей в спине. Не являются причиной боли и грыжи Шморля (грыжа диска в тело выше или ниже лежащего позвонка), но они могут служить индикатором дегенеративного процесса в позвоночнике. Компрессионный перелом без указаний на травму может свидетельствовать о метаболическом остеопорозе, инфекции или опухоли. Однако опухоль или спондилит выявляется на рентгенограмме лишь в том случае, если произошла деструкция более 50 % костной ткани. В силу этого рентгенография позволяет диагностировать эти заболевания на сравнительно поздней стадии. Тем не менее рентгенография по-прежнему показана при подозрении на онкологическое заболевание, травму, анкилозирующий спондилит или инфекцию, но если она не выявила патологии, а клиническое подозрение обоснованно, следует назначить компьютерную (КТ) или магнитно-резонансную (МРТ) томографию позвоночника. При наличии признаков сдавления конского хвоста или иного прогрессирующего неврологического дефицита, а также при радикулопатии (в отсутствие эффекта после месячной пробной консервативной терапии), особенно при планировании операции или эпидурального введения стероидов, а также при наличии признаков поясничного стеноза предпочтительнее МРТ позвоночника [3, 13]. КТ лучше выявляет патологию костной ткани и позволяет диагностировать грыжу диска и стеноз позвоночного канала. МРТ более чувствительна к изменениям мягких тканей; в частности, она хорошо выявляет изменение структуры диска (по изменению интенсивности сигнала от него), локализацию и размеры грыжи диска, позволяет исследовать состояние спинного мозга и конского хвоста, область межпозвонкового отверстия и более чувствительна к инфекционным и опухолевым поражениям позвоночника, патологии оболочек спинного мозга. Визуализация необходима также при планировании мануальной терапии в любых ее разновидностях, но в ней нет необходимости в отсутствие «красных флажков», уменьшении боли после пробной терапии, а также в отсутствие изменения статуса после предшествующего болевого эпизода.
В подобных ситуациях (в отсутствие настораживающих анамнестических или клинических признаков) визуализация не улучшает прогноз, но увеличивает расходы и сопряжена с потенциально опасной лучевой нагрузкой. Выявленные изменения плохо коррелируют с клинической картиной и не только не изменяют подходы к лечению, но и могут вести к неоправданным инвазивным вмешательствам.
При интерпретации данных КТ и МРТ важно учитывать, что примерно у 2/3 лиц, никогда не испытывавших боли в спине, эти методы исследования выявляют дегенеративные изменения в пояснично-крестцовом отделе позвоночника, нередко на нескольких уровнях. Таким образом, обнаружение грыжи диска, проявлений спондилеза и стеноза позвоночного канала еще не означает, что именно они ответственны за имеющиеся у больного неврологические расстройства.
Обязательным условием диагностики того или иного варианта вертеброневрологической патологии является соответствие клинических и параклинических данных. Однако размеры грыжи диска в целом не коррелируют с интенсивностью боли. Анализ данных МРТ не позволяет дифференцировать грыжу диска, являющуюся асимптомной или служащую источником некорешковой боли, а также прогнозировать эффективность консервативного лечения. С радикулопатией четко коррелирует лишь экструзия диска, под которой понимают крайнюю степень его выпячивания, когда длина выпячивания превышает ширину его основания либо отсутствует связь между выпячиванием и основным веществом диска.

По показаниям проводят рентгенографию легких, ультразвуковое исследование органов брюшной полости и малого таза, забрюшинного пространства, экскреторную урографию, ректороманоскопию. Для женщин обязателен осмотр гинеколога. Комплекс обследования может включать также клинический анализ крови и общий анализ мочи, определение содержания сахара, электролитов, азота мочевины, креатинина, кальция, фосфора, мочевой кислоты, электрофорез белков сыворотки. Мужчинам проводят тест на ПСА (простатический специфический антиген).
Общие принципы лечения острой боли в спине
С учетом возможности спонтанного регресса боли анализ эффективности методов лечения боли в спине может быть основан только на данных плацебо-контролируемых исследований. Результаты подобного анализа приведены в табл. 4.
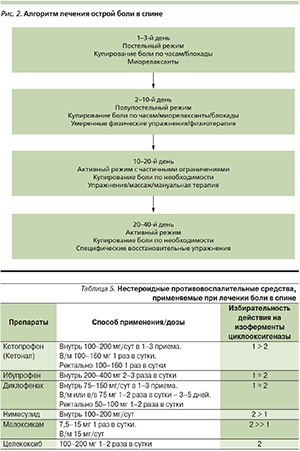
Ориентировочный алгоритм лечения острой боли в спине представлен на рис. 2.
При неосложненной острой люмбалгии и некорешковой люмбоишиалгии следует ожидать значительного уменьшения боли в течение 2–4 недель. В ряде контролируемых исследований показано, что постельный режим не только не ускоряет восстановления, но и, наоборот, может способствовать хронификации болевого синдрома. Поэтому при умеренной боли необходимости в постельном режиме нет, а при интенсивной боли его следует максимально ограничить. Затем режим расширяют, но рекомендуют на определенное время несколько ограничить физическую активность (в частности, избегать поднятия тяжести и длительного сидения). Больного следует научить, как правильно совершать движения, не увеличивая нагрузки на позвоночник. Раннее возвращение к привычному для больного уровню двигательной активности способствует более быстрому купированию боли [3, 13].
Адекватное медикаментозное купирование боли не только облегчает состояние в данный момент, но и позволяет ему быстрее вернуться к привычному для него уровню повседневной активности, что в большинстве случаев имеет критическое значение для разрешения обострения. В первые дни лечение предпочтительнее проводить профилактически – по часам, не дожидаясь усиления боли. Для облегчения боли применяют анальгетики (от парацетамола до трамадола и других наркотических средств) и/или нестероидные противовоспалительные средства (НПВС) внутрь, наружно, в виде ректальных свечей или внутримышечно (табл. 5).
НПВС являются основой консервативной терапии боли в спине, т. к. оказывают как анальгезирующее, так и важное с точки зрения механизмов развития болевого синдрома противовоспалительное действие [3, 5, 6]. Выбор препарата определяется соотношением эффективности и безопасности [3].
Для НПВС характерен относительно высокий риск таких побочных эффектов, как диспепсия, желудочно-кишечные кровотечения, нарушение функции печени, головная боль, дисфункция почек и т. д. Еще недавно представлялось, что недостатки традиционных НПВС могут устраняться путем создания препаратов с более селективным действием, в частности селективных ингибиторов циклооксигеназы 2-го типа (ЦОГ-2), однако при применении существующих препаратов этой группы риск желудочно-кишечных осложнений не устраняется полностью, а риск поражения почек остается таким же, как и у неселективных ингибиторов ЦОГ. Более того, для селективных ингибиторов ЦОГ-2 оказался свойствен более высокий риск кардиоваскулярных осложнений, а, согласно некоторым экспериментальным данным, противоболевой эффект от препаратов данной группы может быть ниже, чем от неселективных ингибиторов ЦОГ, т. к. для получения максимальной анальгезии необходима блокада обоих типов ЦОГ. С этой точки зрения неселективные НПВС, действующие на оба типа ЦОГ (например, кетопрофен), представляются препаратом выбора для лечения вертеброгенных болевых синдромов с учетом приемлемой частоты побочных эффектов [10, 11].
 Кетопрофен есть производное пропионовой кислоты. Особенность его действия не только в ингибировании синтеза простагландинов на уровне ЦОГ; он ингибирует и липооксигеназу, обладает антибрадикининовой активностью, стабилизирует лизосомальные мембраны. Благодаря высокой липофильности молекула кетопрофена проникает через гематоэнцефалический барьер, где реализует свое центральное действие: снижает синтез простагландинов и блокирует рецепторы возбуждающих аминокислот в спинном мозге [14].
Кетопрофен есть производное пропионовой кислоты. Особенность его действия не только в ингибировании синтеза простагландинов на уровне ЦОГ; он ингибирует и липооксигеназу, обладает антибрадикининовой активностью, стабилизирует лизосомальные мембраны. Благодаря высокой липофильности молекула кетопрофена проникает через гематоэнцефалический барьер, где реализует свое центральное действие: снижает синтез простагландинов и блокирует рецепторы возбуждающих аминокислот в спинном мозге [14].
Оптимальный обезболивающий эффект обеспечивается при быстром поступлении анальгетика в кровь с быстрым увеличением концентрации препарата и длительным поддержанием в крови его терапевтической концентрации. Относительно новая лекарственная форма кетопрофена с модифицированным высвобождением действующего вещества (Кетонал ДУО 150 мг) существенно повышает его эффективность и удобство применения. Капсулы c модифицированным высвобождением содержат два вида гранул – белые и желтые (покрытые оболочкой). Их количественное соотношение составляет 3 : 2. Белые гранулы растворяются и всасываются очень быстро, обеспечивая пиковую концентрацию (а значит, максимальный обезболивающий эффект) действующего вещества примерно полтора часа после перорального приема. Второй тип гранул всасывается постепенно, обеспечивая поддержание терапевтической концентрации кетопрофена в крови в течение суток [10, 11, 14].
Прием пищи не влияет на общую биодоступность кетопрофена, но уменьшает скорость всасывания. За счет того, что данная форма обеспечивает постепенное поступление кетопрофена в плазму и пиковая концентрация препарата не достигает значений, наблюдаемых при использовании других форм Кетонала, уменьшается риск развития нежелательных побочных эффектов (рис. 3).
Селективные ингибиторы ЦОГ-2 (например, целекоксиб) рекомендуют назначать лишь при плохой переносимости традиционных НПВС или высоком риске язвенной болезни желудка и двенадцатиперстной кишки. Следует отметить индивидуальную чувствительность больных к НПВС, в связи с этим при неэффективности оптимальных терапевтических доз одного из препаратов в течение 1–2 недель может быть испробован другой препарат. Для снижения риска гастродуоденопатии прием НПВС следует сочетать с приемом ингибитора протонных помп, а для снижения риска лекарственной энтеропатии – пробиотиков.
Воздействие на мышечно-тонический компонент боли предполагает применение миорелаксантов (например, клоназепама или тизанидина) обычно не дольше 1–2 недель. В последующем используют постизометрическую релаксацию, массаж и лечебную гимнастику, включающую упражнения на укрепление мышечного корсета или растяжение спазмированных мышц. При фасеточном синдроме паравертебрально проводят двустороннюю блокаду фасеточных суставов (иногда на нескольких смежных уровнях). Эти методы можно сочетать с рефлексотерапией, другими физиотерапевтическими процедурами. Воздействие на вертеброгенный компонент боли включает методы мануальной терапии и лечебной гимнастики, обеспечивающие восстановление подвижности позвоночника и тем самым снижающие риск рецидивирования болевого эпизода. Мануальная терапия в подострой стадии боли в спине может способствовать более быстрому восстановлению, однако в остром периоде грыжи диска, особенно при наличии признаков компрессии корешка, она противопоказана [3, 13].
 При радикулопатии прогнозируемые сроки восстановления удлиняются до 6–12 недель. С учетом смешанного характера болевого синдрома представляется перспективным воздействие не только на ноцицептивный (например, с помощью Кетонала), но и на нейропатический компонент боли – с помощью раннего применения антидепрессантов (например, амитриптилина или венлафаксина), антиконвульсантов (например, карбамазепина или габапентина), пластыря с лидокаином. Если больной лечится в стационаре, в остром периоде целесообразны эпидуральные блокады с кортикостероидами. Нет достаточных оснований к применению при вертеброгенной радикулопатии диуретиков или вазоактивных препаратов. Традиционно применявшаяся и до сих популярная тракция поясничного отдела оказалась неэффективной в контролируемых исследованиях. Более того, в ряде случаев она провоцирует ухудшение, т. к. вызывает растяжение непораженного заблокированного сегмента (и соответственно, декомпрессию корешка), а выше и ниже расположенных сегментов.
При радикулопатии прогнозируемые сроки восстановления удлиняются до 6–12 недель. С учетом смешанного характера болевого синдрома представляется перспективным воздействие не только на ноцицептивный (например, с помощью Кетонала), но и на нейропатический компонент боли – с помощью раннего применения антидепрессантов (например, амитриптилина или венлафаксина), антиконвульсантов (например, карбамазепина или габапентина), пластыря с лидокаином. Если больной лечится в стационаре, в остром периоде целесообразны эпидуральные блокады с кортикостероидами. Нет достаточных оснований к применению при вертеброгенной радикулопатии диуретиков или вазоактивных препаратов. Традиционно применявшаяся и до сих популярная тракция поясничного отдела оказалась неэффективной в контролируемых исследованиях. Более того, в ряде случаев она провоцирует ухудшение, т. к. вызывает растяжение непораженного заблокированного сегмента (и соответственно, декомпрессию корешка), а выше и ниже расположенных сегментов.
Абсолютным показанием к оперативному лечению остается сдавление корешков конского хвоста с парезом стопы, анестезией кожи промежности, нарушением функций тазовых органов. Показанием к операции может быть также нарастание неврологических симптомов, например слабости мышц. Что касается других случаев, то вопросы о целесообразности, оптимальном времени и оптимальном методе оперативного лечения остаются предметом дискуссии. Проспективные исследования показали достоверное спонтанное уменьшение экструзий и секвестраций дисков (в 75–100 % случаев) в течение года [9].
Недавние исследования показали, что хотя раннее оперативное лечение несомненно приводит к более быстрому ослаблению боли, спустя полгода, год и два года оно не имеет существенных преимуществ по основным показателям болевого синдрома и степени инвалидизации перед консервативной терапией. В связи с этим в неосложненных случаях вертеброгенной радикулопатии решение вопроса об оперативном лечении может быть отсрочено на 6–8 недель, в течение которых должна проводиться адекватная (!) консервативная терапия [7].
В последние годы наряду с традиционной дискэктомией применяют более щадящие методики оперативного вмешательства, такие как микродискэктомия, лазерная декомпрессия (вапоризация) или высокочастотная аблация диска. Малоинвазивность вмешательства расширяет круг показаний к нему. Тем не менее остается неизменным принцип, согласно которому оперативному вмешательству должна предшествовать оптимальная консервативная терапия в течение не менее 6–8 недель [8].
Большое значение имеет рациональная психотерапия, включающая коррекцию представлений о природе боли, объяснение плана лечебных мероприятий и важности каждого из компонентов терапии, разъяснение важности дозированной физической активности для ослабления боли, «настройка» ожиданий пациента.



