Основным принципом современной терапии является патогенетический подход, основанный на точном знан ии механизма развития болезни и целенаправленном воздействии на его основные звенья. Реализация этого подхода, ярким примером которого стало внедрение в клиническую практику генно-инженерных биологических препаратов, позволило добиться существенного прогресса в лечении многих хронических заболеваний человека. Однако достичь полного и быстрого терапевтического успеха, даже при использовании самых современных патогенетических средств, удается далеко не всегда. Поэтому столь большое значение имеет симптоматическая терапия, которая хотя и не оказывает существенного влияния на прогрессирование болезни, зато действенно улучшает качество жизни больных. Наибольшее значение здесь имеет, конечно, эффективное обезболивание. Ведь боль является наиболее тягостным проявлением болезни, определяющим тяжесть страданий, функциональные нарушения и ухудшение социального положения пациента [1–4].
Анальгетическая терапия особенно важна при мышечно-скелетных заболеваниях, таких как остеоартроз (ОА) и дорсалгия, являющихся наиболее частыми причинами развития хронической боли в современной популяции [2].
Хроническая боль, по современным представлениям, не просто неприятный симптом, а самостоятельная
и серьезная угроза жизни пациента. Стойкие болевые ощущения сопровождаются изменениями гомеостаза, опосредованными реакцией симпатоадреналовой системы: повышением артериального давления, частоты сердечных сокращений и активацией тромбоцитов. В целом это приводит к существенному нарастанию частоты осложнений со стороны сердечно-сосудистой системы (ССС), способных приводить к гибели пациента [3–5].
Так, при ОА и хронической боли в нижней части спины (БНЧС) – нозологических формах, не сопровождающихся висцеральной патологией, но характеризующихся выраженной, хронической болью, значительно повышается риск развития кардиоваскулярных катастроф [6–8].
В качестве доказательства данного положения можно привести известное исследование британских ученых N. Torrance и соавт., которые с 1996 г.в течение 10 лет наблюдали когорту из 6940 жителей Великобритании, оценивая связь между наличием хронической неонкологической боли и состоянием здоровья. После учета вли-яния социальных факторов и характера заболеваний, вызвавших боль,
исследователи пришли к выводу, что наличие длительного страдания однозначно влияет на выживаемость. Так, риск гибели пациентов с хронической болью оказался выше почти в 1,5 раза (отношение рисков [ОР] = 1,49; 1,21–1,84), причем в основном из-за кардиоваскулярных осложнений (ОР = 1,68;1,20–2,35) [9].
Важно отметить, что Всемирная организация здравоохранения декларирует эффективное устранение боли как одно из важнейших и неотъемлемых прав человека [10, 11]. Эта проблема имеет и сугубо практический аспект. Для врача важнейшей задачей является определение точного диагноза, что позволяет назначать этиотропную (если это возможно) или патогенетическую терапию. Но больные обращаются за медицинской помощью, надеясь в первую очередь на облегчение своих страданий, особенно если речь идет о выраженной боли. Поэтому первым действием врача должно быть
быстрое и максимально полное купирование основных симптомов болезни. Эффективное обезболивание – наиболее действенный способ завоевать доверие пациента и добиться его приверженности последующему патогенетическому лечению, которое может быть длительным и сложным. В этой ситуации чрезмерное увлечение диагностическими мероприятиями и
“базисными” средствами в ущерб простым и эффективным методам контроля боли может вызывать негативное отношение пациента к лечащему врачу и отвращать его от методов классической медицины [1–3].
Следует отметить, что завоевать доверие больного, испытывающего хроническую боль, совсем непросто. Это демонстрируют результаты исследования испанских ученых L. Arboleya и соавт., которые проанализировали мнение о результатах лечения 897 пациентов, страдавших ОА. Больные на протяжении не менее 6 месяцев получали анальгетики, наиболее часто – нестероидные противовоспалительные средства (НПВС): диклофенак, ацеклофенак и пироксикам. Оказалось, что почти половина (46 %) опрошенных были недовольны эффективностью назначенных лекарств, а
полностью удовлетворенными результатом обезболивающей терапии считал себя лишь 1 больной из 6 (!) [12].
Яркой иллюстрацией проблем, которые возникают при применении анальгетиков, стало исследование M. Gore и соавт., опубликованное в 2012 г. Авторы оценили практику применения анальгетиков (парацетамола, НПВС, трамадола, “слабых” и “сильных” опиоидов) пациентами с ОА и БНЧС в Великобритании. Оказалось, что в течение первого месяца лечения назначенные лекарства по разным
причинам – из-за неэффективности или побочных эффектов, отменялись примерно 90 % больных. От 30 до 60 % составили случаи замены терапии, до 15 % – ее усиление (использование различных комбинаций). Оказалось, что в большинстве случаев изначально рекомендованный врачом анальгетический препарат не оправдал надежд и не позволил решить проблему купирования боли [13].
Выбор оптимальной стратегии анальгетической терапии – непростая задача, поскольку развитие боли, особенно хронической, остается многофакторным, сложным патологическим процессом. Так, при заболеваниях опорно-двигательного аппарата в ее патогенезе принимают участие локальное воспаление, мышечный спазм, повреждение элементов связочного аппарата, биомеханические нарушения. Существенное значение придается дисфункции болевой системы, которая включает такие элементы, как периферическая и центральная сенситизация, “истощение” антиноцицептивных механизмов, деструктивная поведенческая реакция и др. [1–4, 14, 15]. Исходя из этого становится
очевидным, что монотерапия (даже наиболее “сильными” лекарствами) далеко не всегда приводит к терапевтическому успеху. Ключ к решению этой проблемы, вероятно, находится в комплексном подходе, предусматривающем совместное использование лекарственных препаратов и методов лечения, оказывающих влияние на различные элементы патогенеза боли.
Однако борьба с болью должна иметь основу – первый терапевтический инструмент, применив который и оценив полученные результаты, врач в дальнейшем будет выстраивать индивидуальную концепцию обезболивающей терапии для конкретного пациента, подключив новые препараты и
методы лечения. Поэтому в арсенале врача среди разнообразных анальгетиков должно быть средство, которое станет препаратом “первой линии”, – надежное, простое в использовании, обладающее очевидным механизмом действия.
К таким инструментам, разумеется, относятся нестероидные противовоспалительные средства (НПВС). Они обладают уникальным сочетанием обезболивающего, противовоспалительного и жаропонижающего действий, что обеспечивает эффективное купирование основных симптомов, связанных с патологией органов опорно-двигательного аппарата [1, 2, 4, 16].
Механизм фармакологического действия НПВС хорошо известен: он определяется блокадой фермента
циклооксигеназы-2 (ЦОГ-2), который образуется в очагах тканевого повреждения и отвечает за активный синтез простагландинов (ПГ), главнейших медиаторов боли и воспаления. Важно отметить, что анальгетическое действие НПВС реализуется не только путем снижения возбудимости
периферических болевых рецепторов. Вероятно, не меньшее значение имеет влияние НПВС и на центральные механизмы формирования боли – феномен “центральной сенситизации”, который также опосредован гиперпродукцией ПГ (“асептическое нейрональное воспаление”) и активацией глиальных клеток, возникающих в ответ на стойкое и мощное болевое раздражение структур ноцицептивной
системы [1–3].
Если в патогенезе острой или хронической боли важную роль играет процесс воспаления, даже субклинического, как при ОА и дорсалгии, то применение НПВС будет не только оправданным, но и совершенно необходимым. Более того, в этой ситуации, как показывают данные большого числа клинических исследований, НПВС своей терапевтической активностью однозначно выигрывают по
сравнению с другими анальгетиками –парацетамолом и опиоидами. Ведь последние не обладают противовоспалительными свойствами [1–3].
В настоящее время набор НПВС отличается исключительным разнообразием – на отечественном фармакологическом рынке присутствует 19 различных препаратов этой лекарственной группы. И речь идет о химических субстанциях, а не о конкретных коммерческих наименованиях, которых на порядок больше.
Казалось бы, такой богатый выбор удобен лечащему врачу – всегда можно найти индивидуальное средство конкретному пациенту, исходя из особенностей клинической ситуации. Но на практике это оборачивается серьезными сложностями. Ведь даже опытные специалисты не всегда могут определить четкие критерии, которые следует выделять при решении вопроса о преимуществах того или иного препарата этой группы. При этом ситуацию значительно усложняет активная (а порой агрессивная) реклама некоторых фирм-производителей, продвигающих свой продукт как “самый действенный и безопасный среди всех возможных”. Но, к сожалению, реальная практика показывает, что ни один из современных НПВС не может считаться совершенным. И если какой-либо препарат имеет преимущество по определенному параметру, скорее всего, у него будут и серьезные недостатки.
Основные параметры, на которые необходимо обратить внимание при выборе НПВС, – выраженность анальгетического и противовоспалительного действия, удобство применения, а также риск осложнений со стороны желудочно-кишечного тракта (ЖКТ) и ССС.
Большинство экспертов считают, что при условии их использования в терапевтических дозах эффективность всех НПВС практически одинакова. В целом если говорить о длительном терапевтическом курсе, это положение верно. Однако при кратковременном (или относительно кратковременном) применении этих лекарств, особенно в случае купирования острой боли, когда имеет значение не только выраженность, но и скорость наступления клинического эффекта, некоторые из представителей НПВС могут демонстрировать определенное преимущество благодаря своим фармакологическим особенностям.
Однако основным и наиболее явным различием между НПВС является их безопасность в отношении патологии со стороны ЖКТ и ССС.
Долгое время – по сути, от момента появления первых синтетических НПВС (конец XIX в.) и до 2004 г. (до недоброй памяти “кризиса коксибов”) – основной проблемой, ограничивающей использование этих лекарств, считалась опасность развития осложнений со стороны ЖКТ. Все “традиционные” НПВС являются неселективными ЦОГ-2 ингибиторами (нНПВС), т. е. помимо воздействия на свою основ-
ную фармакологическую мишень – ЦОГ-2, они в той или иной мере подавляют активность ее биохимического “двойника” ЦОГ-1, работа которой необходима для поддержания многих
жизненных функций. Прежде всего речь идет о защитных свойствах слизистой оболочки ЖКТ. Поэтому блокада ЦОГ-1 приводит к существенному повышению риска развития серьезной, угрожающей жизни патологии ЖКТ: т. н. НПВС-гастропатии и НПВС-энтеропатии [16].
Селективность в отношении ЦОГ-2, а следовательно, риск развития патологии ЖКТ стали основой разделения НПВС на две полярные группы: нНПВС и селективные ЦОГ-2-ингибиторы (сНПВС). При этом
сНПВС – т. н. коксибы, были созданы в конце 1990-х гг. именно как более безопасная в отношении ЖКТ альтернатива “традиционным” НПВС.
Но, как оказалось, коксибы имеют очень серьезный недостаток. Селективное подавление активности
ЦОГ-2 способно вызывать нарушение баланса факторов, влияющих на свертывание крови, – синтеза тромбоксана А2 и простациклина, что определяет протромботический эффект сНПВС. У пациентов с заболеваниями ССС это чревато повышением риска развития тромбоэмболических осложнений,
а следовательно, угрожающих жизни “кардиоваскулярных катастроф” – инфаркта миокарда и ишемического инсульта [16].
Таким образом, лечащий врач,назначая НПВС, сталкивается с дилеммой – использовать ли “традицион-
ные” препараты, способные вызывать побочные эффекты со стороны ЖКТ, или коксибы – лекарства, с появлением которых стойко ассоциируется проблема кардиоваскулярных осложнений? Ситуацию осложняет тот факт, что очень многие пациенты, нуждающиеся в активной анальгетической
терапии, имеют сочетание факторов, существенно увеличивающих риск развития патологии со стороны как ЖКТ, так и ССС.
Значение этой проблемы ярко иллюстрирует недавняя работа испанских ученых A. Lanas и соавт., которые провели одномоментную оценку наличия факторов риска у всех больных, страдающих ОА, обратившихся в медицинские учреждения Испании за одни день – 25 марта 2009 г., получив, таким
образом, истинный “срез” популяции. Эта блестяще выполненная работа удивляет как своим масштабом, так и результатами. Так, за один день к врачам обратились 17 105 больных (!), нуждающихся в обезболивающей терапии. Большинство из них имели высокий риск лекарственных осложнений: в частности, артериальная гипертензия была отмечена у 57,6 % (у 22,6 % –
неконтролируемая терапией), кардио-васкулярные осложнения в анамнезе – у 31,9 %, а высокий риск ЖКТ-осложнений – у 60,3 % пациентов. Самое неприятное, что у каждого четвертого (25,5 %) больного имело место сочетание серьезных факторов риска со стороны и ССС, и ЖКТ [17].
Следует отметить, что реальная клиническая практика нередко разрушает простые и, казалось бы, хорошо обоснованные теоретические положения. Так, было бы очень удобно свести
различие между НПВС к разделению на два класса: нНПВС (“опасные для желудка, но безопасные для сердца”) и сНПВС (“безопасные для желудка, но опасные для сердца”). Но, к сожалению, не все нНПВС одинаковы в отношении кардиоваскулярного риска.
Неприятным сюрпризом для практикующих врачей стали результаты ряда эпидемиологических исследований, показавших, что наиболее популярный – “традиционный” – НПВС диклофенак весьма небезопасен в отношении не только ЖКТ, но прежде всего ССС.
Наиболее крупной на сегодняшний день работой, в которой оценивается индивидуальный кардиоваскулярный риск для различных НПВС, является мета-анализ P. McGettigan и D. Henry
Его результаты были опубликованы в 2011 г. Авторы оценили данные 30 исследований случай–контроль, включивших 184 946 больных с кардиоваскулярными осложнениями, и 21 когортное исследование, в которое суммарно вошли > 2,7 млн человек. Согласно проведенным расчетам, риск
инфаркта миокарда при использовании диклофенака увеличивается примерно на 40 % (ОР = 1,4) [18].
Серьезную опасность развития осложнений со стороны ССС при использовании диклофенака четко
показывают данные E. Fosbøl и соавт., исследовавших когорту из 1 028 427 условно “здоровых” жителей Дании, которые за 5 лет до включения в анализ не госпитализировались по поводу
какого-либо заболевания. Почти половине из них с 1997 по 2005 г. хотя бы один раз назначали НПВС: 301 001 из них получал ибупрофен, 172 362 – диклофенак, 40 904 – напроксен,16 079 – рофекоксиб и 15 599 –целекоксиб. В наблюдаемой когорте от кардиоваскулярных осложнений суммарно погибли 2204 человека. Сопоставив частоту осложнений со стороны ССС и сведения об использовании НПВС,
ученые определили ОР развития данной патологии для различных представителей этой лекарственной группы. Так, суммарный риск гибели от кардиоваскулярных катастроф не был повышен для напроксена, ибупрофена и целекоксиба – 0,84, 1,08 и 0,92, но оказался существенно выше для рофекоксиба – 1,66, и особенно диклофенака – 1,91. При этом риск коронарной смерти и нефатального инфаркта миокарда был повышен для ибупрофена, диклофенака и обоих коксибов – 1,52, 1,82, 1,72 и 1,93 соответственно. Его не повышал лишь напроксен (ОР = 0,98). Зато при использовании того
препарата отчетливо нарастал риск развития фатального и нефатального инсульта – 1,91, даже больше, чем при использовании диклофенака, – 1,71; ибупрофен, рофекоксиб и целекоксиб выглядели в этом плане существенно менее опасными: ОР – 1,29, 1,14 и 1,2 соответственно. Как видно, согласно
результатам масштабного европейского эпидемиологического исследования, “старый добрый” диклофенак в наибольшей степени повышает опасность гибели от кардиоваскулярных осложнений, чем все другие НПВС! [19].
Таким образом, современный врач, назначая НПВС и думая о безопасности своих пациентов, в бóльшей степени беспокоится о возможных проблемах со стороны ССС. Ведь профилактика НПВС-гастропатии в конце концов проста и понятна. Это учет хорошо известных факторов риска (главные из которых – язвенный анамнез, сопутствующий прием антитромботических средств и пожилой возраст) и использование гастропротективных препаратов (ингибиторов протонной помпы), в тех случаях, когда вероятность развития патологии ЖКТ представляется достаточно высокой. А вот в отношении кардиоваскулярных осложнений методика профилактики, к сожалению, до настоящего времени не разработана. Единственный эффективный метод предупреждения тромбоэмболических осложнений, связанных с приемом НПВС, – назначение антитромботических средств, таких как низкие
дозы аспирина (НДА). Однако комби-нация НПВС и НДА резко повышает риск осложнений со стороны ЖКТ – т. е. решая одну проблему, врач тотчас создает другую [16].
Данная ситуация возродила интерес практикующих врачей к “традиционным” неселективным НПВС, использование которых ассоциируется с существенно меньшей опасностью тромбоэмболических осложнений. Но диклофенак – “золотой” стандарт анальгетической терапии 1980–1990-х гг., сегодня на эту роль, как было показано выше, уже не подходит.
Гораздо больший интерес в качестве средства “первой линии” для купирования острой или длительного лечения хронической боли, обладающего благоприятной переносимостью со стороны
ССС, представляет кетопрофен. Этот препарат, относящийся к “традиционным” (неселективным) НПВС, появился в Европе в 1971 г. и быстро завоевал репутацию эффективного и надежного анальгетика [20]. Сорок лет – весьма серьезный возраст для любого лекарства, однако за эти годы кето-профен нисколько не утратил своего значения. Итальянские авторы P. Sarzi-Puttini и соавт. подчеркивают этот факт в обзоре с весьма характерным названием: “Боль и кетопрофен: его роль в клинической практике”, который был опубликован в 2010 г. Так, они рассматривают этот препарат как наиболее удачное средство для системного и локального обезболивания, указывая на огромную базу доказательств его эффективности (превосходящей многие популярные НПВС), широкий спектр показаний – по сути, все патологические процессы, сопровождающиеся ноцицептивной болью,
и серьезную репутацию у врачей всех специальностей, занимающихся проблемой обезболивания [21].
Важным критерием преимуществ того или иного препарата является его коммерческий успех. Подъем интереса к использованию кетопрофена можно оценить по отчетливому росту его продаж в странах Европы. Так, M. Venegoni и соавт. показали, что на фоне небольшого, но явного снижения общих продаж основных “рецептурных” НПВС в Италии с 2006 по 2009 г. популярность кетопрофена выросла
почти в 2 раза (на 93 %). Если в 2006 г. кетопрофен приобрели 263 897 жителей этой страны, то в 2009 г. – уже 508 699 [22].
Многие эксперты связывают высокий анальгетический потенциал кетопрофена с особенностями его молекулы – ее липофильностью и относительно небольшими размерами [21, 23]. Эти свойства определяют способность кетопрофена легко проникать в воспаленную ткань (например, в синовиальную полость при артрите), накаливаясь там в высокой концентрации [20, 21, 23]. Большое значение также придается диффузии кетопрофена через гематоэнцефалический барьер и его способности оказывать влияние на центральные структуры болевой системы [24, 25]. Экспериментальные данные четко подтверждают равновесие между концентрацией несвязанной фракции кетопрофена в плазме крови и его концентрацией в цереброспинальной жидкости [24–26]. При этом центральный эффект этого препарата связывается не только с основным, класс-специфическим, действием НПВС (блокадой ЦОГ-2), но и с иными механизмами. В частности, обсуждается влияние S-стереоизомера кетопрофена на серотонинергическую антиноцицептивную систему на спинальном и супраспинальном уровнях [27].
Конечно, количество кетопрофена, проникающего в ткань спинного и головного мозга после перорального приема или парентерального введения, крайне мало. Ведь почти 99 % кетопрофена, попавшего в плазму крови, связывается с альбумином, а значит, теряет способность к диффузии через гематоэнцефалический барьер. В этом плане весьма показательны данные финских ученых A. Mannila и соавт., оценивших концентрацию кетопрофена в ликворе после внутривенного введения препарата 21 ребенку. Исследуемую группу в этой работе составили дети от года до 8 лет, которым выполнены хирургические операции на фоне спинального обезболивания. Кетопрофен использовали как средство для предоперационной анальгезии, а пробы ликвора забирали через 7–67 минут во время спинномозговой пункции – перед введением местного анестетика. Препарат был обнаружен в спинномозговой жидкости у всех пациентов, однако его концентрация была очень мала: не более 0,06 % от концентрации в плазме крови, где 98 % составила связанную фракцию [28].
Тем не менее один из участников данного исследования, H. Kokki, в своем обзоре (2010), посвященном
применению кетопрофена в педиатрической практике, отметил центральный анальгетический эффект как одно из важных достоинств этого препарата [23].
Кетопрофен обладает коротким периодом полужизни: он быстро метаболизируется и покидает организм человека. С одной стороны, это важный положительный момент, поскольку накопление токсичных метаболитов и кумуляция, свойственная препаратам с более длительной элиминацией,
являются одними из факторов, повышающих токсичность НПВС. С другой стороны, короткий период сохранения максимальной концентрации препарата в крови означает непродолжительное действие лекарства, что является очевидным недостатком. Ведь если клиническая ситуация требует длительного применения кетопрофена, то для сохранения стойкого обезболивающего эффекта будет необходим
многократный прием препарата в течение суток.
Решением этой проблемы стало создание лекарственной формы с контролируемым высвобождением действующего вещества. Представителем такого “улучшенного” кетопрофена на российском фармакологическом рынке является препарат Кетонал-Дуо 150 мг (Сандоз). Это капсула, которая
содержит два вида гранул. Первые из них растворяются и всасываются очень быстро, обеспечивая пиковую концентрацию действующего вещества, а значит, и выраженный обезболивающий эффект действующего вещества уже через 1,0–1,5 часа после перорального приема. Второй тип гранул растворяется и всасывается постепенно, обеспечивая сохранение терапевтической концентрации кетопрофена в плазме крови в течение суток. Эта терапевтическая система позволяет, с одной стороны, добиваться быстрого действия препарата, с другой обеспечивает наиболее удачную схему применения (1 капсула в сутки) [29].
Как было отмечено выше, клинический опыт использования кетопрофена включает все возможные заболевания и патологические состояния, при которых применение НПВС могло бы быть целесообразным. Это стало возможным благодаря наличию полного спектра лекарственных форм кетопрофена: раствора для внутривенного и внутримышечного введения, стандартных таблеток, капсул контролируемого высвобождения препарата, форм для местного применения (мазь), ректальных свечей, что существенно облегчает выбор метода лечения при различных клинических ситуациях.
Кетопрофен обладает высоким быстродействием, что делает его весьма удачным средством ургентной
анальгезии. В 2009 г. были опубликованы данные мета-анализа Cochrane, в котором была оценена эффективность однократного приема кетопрофена в дозе 25–100 мг при острой послеоперационной боли. Материалом для этой работы послужили данные 14 рандомизированных клинических исследований – РКИ (968 больных, получавших кетопрофен, 520 плацебо), а основным критерием оценки лечебного действия было снижение боли минимум на 50 % на срок от 4 до 6 часов. Исследователи использовали в своей работе индекс NNT (number need to treat), показывающий число пациентов, которых необходимо пролечить для достижения значимого отличия от плацебо. Этот индекс составил 2,4–3,3, что в целом показывает достаточно высокую эффективность препарата и подтверждает целесообразность его применения в качестве анальгетика [30].
Недавно были опубликованы данные крупного (n = 338) многоцентрового исследования, в котором изучалась сравнительная эффективность однократного внутривенного введения НПВС (парекоксиба 40 мг и кетопрофена 100 мг) для купирования острой почечной колики. Согласно полученным результатам, кетопрофен, выступивший в роли препарата сравнения, нисколько не уступал представителю коксибов. Так, снижение уровня боли (по ВАШ) через 30 минут после инъекции составило 33,8 ± 24,6 и 35,2 ± 26,0 мм, т. е. было несколько бóльшим в группе кетопрофена [31].
Работа S. Karvonen и соавт. являет собой пример успешного применения кетопрофена в хирургической практике. Здесь кетопрофен в дозе 300 мг/сут был использован 60 больными,
перенесшими “большие” ортопедические операции, такие как эндопротезирование крупного сустава. Контроль составили пациенты, получавшие плацебо или парацетамол в дозе 4 г/сут. Главным критерием эффективности кроме снижения выраженности болевых ощущений была оценка “опиоидсберегающего” действия, которое определяли путем сравнения необходимой для достижения стойкой анальгезии дозы наркотического анальгетика фентанила. Достоверный опиоидсберегающий эффект был отмечен лишь в группе больных, получавших кетопрофен: средняя доза фентанила
здесь оказалась на 22 % по сравнению с группой плацебо и на 28 % меньше по сравнению с группой
парацетамола [32].
Хорошие результаты отмечены при использовании кетопрофена больными, испытывающими боли после стоматологических манипуляций. N. Olson и соавт. провели исследование, в ходе которого 239 пациентам после удаления 3-го моляра – в качестве анальгетика были назначены кетопрофен
(причем в минимальной дозе – 25 мг), ибупрофен 400 мг или парацетамол 1000 мг; “пассивным” контролем стало плацебо. Главный метод определения лечебного действия анальгетиков – сравнение числа пациентов, у которых боль спустя 6 часов после экстракции зуба полностью отсутствовала. Этот
результат был достигнут практически всеми больными, получавшими кетопрофен, – 99 %; пациентами, получившими ибупрофен, – 96 % и 88 % – парацетамол (разница недостоверна). Все группы, в которых проведена активная терапия, превосходили по облегчению боли плацебо, на фоне приема
которого боль купировалась лишь у трети (33,6 %) пациентов. Как видно, даже минимальная доза кетопрофена дает столь же выраженное (и даже несколько большее) облегчение боли, как стандартные терапевтические дозы ибупрофена и парацетамола [33].
Кетопрофен показал себя в качестве действенного средства купирования острого приступа мигрени. Согласно результатам исследования M. Dib и соавт., он не уступал золмитриптану – представителю группы триптанов, важнейшего патогенетического средства лечения этого заболевания. В этой
работе 235 пациентов с мигренозной болью однократно принимали кетопрофен в дозе 75/150 мг или золмитриптан. Во всех группах отмечен практически одинаковый результат: через 2 часа боль прекратилась у 62,6, 61,6 и 66,8 % пациентов соответственно [34].
Необходимо отметить: кетопрофен помимо выраженного обезболивающего действия обладает хорошим противовоспалительным потенциалом. Это весьма ценное свойство, ведь при многих заболеваниях, особенно ревматических, появление боли тесно связано с локальным или системным воспалительным процессом. Наилучшей моделью оценки противовоспалительного эффекта НПВС является купирование острого подагрического артрита, при котором выраженная суставная боль
возникает на фоне острой воспалительной реакции. Поэтому “золотым” стандартом лечения этой патологии долгое время считался индометацин – представитель НПВС, обладающий выраженными противовоспалительными свойствами. Кетопрофен, как показали результаты исследования R. Altman и соавт., успешно прошел сравнение с индометацином в качестве средства купирования приступа пода-
гры. В ходе этой работы 59 пациентов с острым подагрическим артритом в течение 7 дней принимали кетопрофен 100 мг 3 раза в сутки или индометацин 50 мг 3 раза в сутки. При использовании кетопрофена значимое облегчение боли в первый же день лечения отметили 92 % больных. В контрольной группе их было ровно столько же – 91 %. Через неделю лечения приступ был полностью
купирован 24 и 22 % пациентов. Как видно, кетопрофен не уступал индометацину по эффективности. Но при этом он отчетливо превосходил его по безопасности – на фоне приема индометацина какие-либо побочные эффекты отмечены у 20 % больных, а в группе кетопрофена – лишь у 11 % [35].
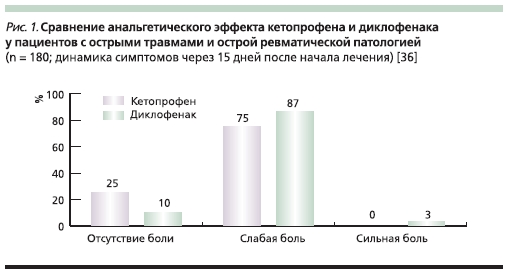
Удачной демонстрацией преимущества кетопрофена стала работа I. Jokhio и соавт. Они сравнили эффективность этого препарата и диклофенака в отношении 180 пациентов, испытывавших
выраженные боли (среднее значение по ВАШ ~ 70 мм) вследствие травмы или острой патологии мягких тканей ревматической природы. При этом была использована т. н. ступенчатая терапия: в первый день НПВС применяли в виде внутримышечных инъекций, а затем их назначали перорально. Соответственно, половина пациентов получили 2 инъекции кетопрофена по 100 мг, а затем принимали этот препарат по 100 мг 2 раза в сутки. Остальные получили по 2 инъекции диклофенака по 75 м, в дальнейшем – 3 раза в сутки принимали его по 50 мг 3 раза в сутки внутрь. Курс лечения составил 2 недели. К концу периода наблюдения в группе кетопрофена у 75 % пациентов интенсивность боли уменьшилась до умеренной или слабой, а у 25 % она полностью купировалась. В группе диклофенака результаты лечения были скромнее: сильная боль сохранялась у 3 %, умеренная или слабая – у 87 %, а отсутствие боли было отмечено лишь у 10 % пациентов. При этом 72 % больных, получавших кетопрофен, оценили его переносимость как “хорошую или отличную”; такую оценку диклофенаку дали лишь 50 % пациентов [36] (рис. 1).
Помимо экстренного обезболивания кетопрофен оказался очень удобным и эффективным средством длительного контроля боли у пациентов, страдающих хроническими заболеваниями опорновигательного аппарата. Важным доказательством терапевтических достоинств кетопрофена при хронической ревматической патологии служит европейское проспективное открытое исследование, охватившее около 20 тыс. человек с различной мышечно-суставной патологией, в основном ОА. Через месяц более 70 % пациентов, принимавших кетопрофен в дозе 200 мг/сут, отметили хороший или превосходный результат лечения; при этом ЖКТ-осложнения суммарно возникли у 13,5 %, а язвы и кровотечения – всего у 0,03 % [37].
Работа M. Schattenkirchner и соавт. показала хорошую переносимость кетопрофена при длительном использовании. В этом исследовании 823 больных ОА и ревматоидным артритом получали кетопрофен в течение года. На фоне лечения осложнения со стороны ЖКТ возникли у 28 % пациентов (лишь у 1,7 % серьезные), а со стороны ССС – у 3,2 %, что относительно немного с учетом преимущественно
пожилого возраста пациентов и тяжелого коморбидного фона [38].
Удачные результаты были получены при длительном использовании кетопрофена больными анкилозирующим спондилоартритом (АС). Эта нозологическая форма характеризуется интенсивными болями в позвоночнике воспалительного характера, и НПВС здесь играют роль основного терапевтического агента, позволяющего контролировать клинические проявления болезни. В исследовании M. Dougados и соавт. кетопрофен был препаратом сравнения для представителя коксибов – целекоксиба: в течение 6 недель 246 пациентов, страдающих АС, принимали целекоксиб 200 мг, кетопрофен 200 мг или плацебо. Согласно полученным данным, четкой разницы в обезболивающем действии обоих НПВС не было и оба препарата существенно превосходили плацебо. Особый интерес здесь представляет влияние активной терапии на такие симптомы, как ночная боль и
утренняя скованность, поскольку они в большей степени отражают противовоспалительный эффект. Действие кетопрофена и целекоксиба практически не различалось: уменьшение ночных болей составило в среднем 21 и 27 мм ВАШ (в группе плацебо увеличилось на 13 мм), утренняя скованность уменьшилась на 16 и 17 минут (в группе плацебо не изменилась). Таким образом, кетопрофен оказывает четкое противовоспалительное действие при болезни Бехтерева. Самое интересное, что число осложнений со стороны ЖКТ на фоне приема высокоселективного ЦОГ-2-ингибитора целекоксиба и кетопрофена не различалось – они были отмечены у 13 и 14 % больных (8 % на плацебо) [39]. Новым и весьма серьезным подтверждением эффективности кетопрофена стала работа итальянских ученых F. Atzeni и соавт., представленная на ежегодном конгрессе Американской
коллегии ревматологов (ACR – American College of Rheumatology), прошедшем в ноябре 2012 г. в Чикаго. Исследователи провели мета-анализ РКИ, в которых сравнивали обезболивающее действие кетопрофена 50–200 мг/сут с ибупрофеном 600–1800 мг/сут или диклофенаком 75–100 мг/сут.
В мировой литературе им удалось найти 13 исследований такого рода: 8 сравнений с ибупрофеном и 5 – с диклофенаком, суммарно – 898 участников. Препараты назначали больным ревматоидным артритом, ОА, АС, БНЧС и пациентам, страдающим болью в плече. Согласно полученным результатам, кетопрофен демонстрировал статистически достоверное превосходство над препаратами сравнения
в 9 из 13 РКИ. При этом вероятность достижения благоприятного эффекта при применении кетопрофена была почти в 2 раза выше (ОШ = 0,459: 0,33–0,58; p = 0,000) [40].
Говоря о безопасности кетопрофена, нельзя обойти вниманием тот факт, что ряд эпидемиологических исследований и их мета-анализ демонстрируют существенный риск ЖКТ-осложнений на фоне приема кетопрофена. В частности, это было продемонстрировано в известной работе D. Henry и соавт.,
выполненной в начале 1990-х гг.
Авторы провели мета-анализ 7 исследований, в которых оценивалась сравнительная частота желудочно-кишечных кровотечений для кетопрофена. Согласно полученным результатам, ОР при использовании этого препарата по сравнению с диклофенаком оказался существенно выше [41].
Современные данные также подтверждают высокий риск ЖКТ- осложнений при использовании
кетопрофена. В конце минувшего года была опубликована работа J. Castellsague и соавт., проведших
мета-анализ 28 эпидемиологических исследований, выполненных с января 1980 по май 2011 г. и оценивавших развитие ЖКТ-осложнений при использовании различных НПВС. Согласно полученным результатам, наименьший ОР был отмечен для целекоксиба (1,45) и ацеклофенака (1,4); умеренный – при использовании ибупрофена (1,84). Существенно выше опасность была при использовании диклофенака (3,34), мелоксикама (3,47) и нимесулида (3,83). Кетопрофен вошел в “тройку” препаратов, демонстрирующих наибольший риск, – 3,92, напроксен – 4,1 и индометацин – 4,14 [42].
С другой стороны, одно из наиболее крупных европейских популяционных исследований, проведенных в последние годы, показало для кетопрофена относительно низкий риск развития серьезных ЖКТ-осложнений. Эта работа финских ученых A. Helin-Salmivaara и соавт., основанная на оценке причин развития 9191 случая кровотечений, язв и перфорации, отмеченных в Финляндии с 2000 по
2004 г. Контроль составили 41 780 лиц,сопоставимых по полу и возрасту. Согласно полученным результатам, вероятность развития ЖКТ-осложнений при использовании кетопрофена была ниже, чем диклофенака: ОШ – 3,7 и 4,2 соответственно. Любопытно, что кетопрофен демонстрировал аналогичный или даже меньший, чем селективные НПВС (кроме целекоксиба), риск развития патологии ЖКТ. Так, ОШ для мелоксикама, нимесулида и эторикоксиба составил соответственно 3,4; 4,0 и 4,4 [43].
Следует отметить, что в России накоплен большой собственный опыт применения кетопрофена. В частности, в нашей стране был проведен ряд клинических исследований, результаты которых показали не только хороший терапевтический потенциал этого препарата, но и низкую частоту серьезных осложнений [44–48].
Среди них следует выделить работу Л.Б. Лазебника и соавт., в которой проводилось 3-месячное сравнение безопасности четырех НПВС: лорноксикама, нимесулида, целекоксиба и кетопрофена, для 132 больных ОА. Основным достоинством этой работы стало сопоставление и ЖКТ (по данным эндоскопического контроля), и кардиоваскулярной безопасности (по данным суточного мониторирования артериального давления). Согласно полученным результатам, кетопрофен демонстрировал превосходную переносимость. Так, число эрозивно-язвенных изменений при использовании лорноксикама составило 66 % (!), нимесулида – 13,5 %, кетопрофена – 13,0 %, целекоксиба – 8,3 %. Дестабилизация артериальной гипертензии (> 130/90 мм рт. ст.) была отмечена лишь у 2 % больных, получавших кетопрофен. Столь же благоприятной оказалась переносимость целекоксиба – артериальная гипертензия возникла лишь у 3 % пациентов. В отношении лорноксикама и нимесулида ситуация оказалась совсем иной – у пациентов, принимавших эти препараты, дестабилизация артериальной гипертензии была отмечена у 11 и 13 % соответственно [48]. Работа Л.Б. Лазебника демонстрирует одно из наиболее ценных преимуществ кетопрофена, которому в
последнее время придается столь больше значение, – относительно низкий риск осложнений со стороны ССС.
Связь между приемом кетопрофена и кардиоваскулярными катастрофами определялась в нескольких масштабных эпидемиологических исследованиях, проведенных учеными разных стран. Так, низкий риск развития инфаркта миокарда при использовании кетопрофена был показан американскими учеными G. Singh и соавт., для своего анализа использовавшими одну из крупнейших компьютерных систем США – California Medical Database. Проанализировав причины 15 343 эпизодов инфаркта миокарда (61 372 лица составили соответствующий контроль), авторы сопоставили частоту развития этого опасного осложнения для лиц, принимавших наиболее популярные НПВС. Согласно полученным результатам, кетопрофен ассоциировался с наименьшим риском инфаркта миокарда (ОШ = 0,88) – даже по сравнению с напроксеном (ОШ = 1,08), который традиционно считается наиболее безопасным в отношении ССС препаратом группы НПВС [49].
Близкие результаты были получены в эпидемиологическом исследовании M. Solomon и соавт. Эти ученые сравнили использование различных НПВС 4425 больными, у которых развился инфаркт миокарда, и 17 700 лицами без данного осложнения, основываясь на данных медицинской системы
штата Нью-Джерси, США. Согласно полученным данным, разницы по приему кетопрофена в этих группах не было: его получали 53 больных, у которых наблюдались кардиоваскулярные осложнения (1,2 %), и 190 лиц группы контроля (1,1 %). Таким образом, использование кетопрофена, по данным этого исследования, не повышало риска развития кардиоваскулярных катастроф [50].
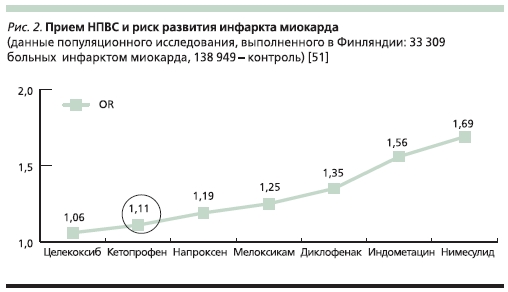
Подтверждают низкий кардиоваскулярный риск кетопрофена и результаты популяционного исследования финских ученых A. Helin-Salmivaara и соавт. Их работа была основана на сопоставлении данных о приеме НПВС 33 309 лицами, перенесшими острый инфаркт миокарда, и 138 949 здоровыми людьми. Оказалось, что прием кетопрофена фактически не увеличивал опасности развития кардиоваскулярных катастроф (ОШ = 1,11). Соответствующий уровень риска для многих других популярных НПВС был существенно выше – так, он составил для диклофенака 1,35, для мелоксикама – 1,25 и для нимесулида – 1,69 [51] (рис. 2).
Следует отметить, что пристальное внимание, которое медицинское сообщество уделяет в последние годы проблемам безопасности НПВС, существенно повысило интерес к использованию локальных форм этих препаратов. С одной стороны, это связано с успехами в разработке новых трансдермальных систем, позволяющих существенно увеличивать проникновение действующей субстанции в глубину
мягких тканей при накожном нанесении, тем самым повышая и результативность лечения. С другой стороны, опасность развития системных осложнений при использовании локальных форм НПВС сводится к минимуму. Это позволяет использовать их даже в той ситуации, когда высокий риск
осложнений со стороны ЖКТ и ССС становится непреодолимым препятствием к системному применению
НПВС [52, 53]. Кетопрофен в плане локального применения весьма перспективен. Его липофильная небольшая молекула достаточно легко проникает через кожные покровы, обеспечивая терапевтическую концентрацию действующего вещества в пораженных областях человеческого тела. По мнению экспертов, фармакологические особенности кетопрофена, используемого в качестве действующего начала местных обезболивающих препаратов, определяет его преимущество по сравнению с другими НПВС [54–56].
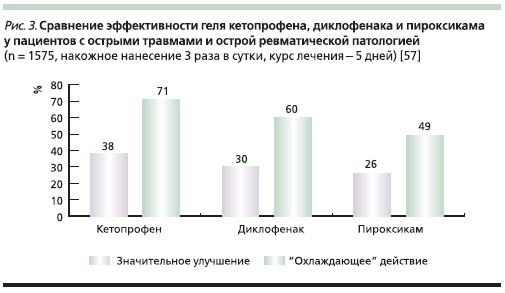
Четким доказательством эффективности локальной формы кетопрофена стало масштабное британское рандомизированное исследование R. Patel и соавт. В ходе этой работы 1575 больных
с острой травмой мягких тканей (вывихи, ушибы, перенапряжение мышц и др.) 3 раза в сутки на протяжении 5 дней получали гелевые формы кетопрофена (2,5 %), диклофенака (1 %) или пироксикама (0,5 %). Согласно полученным результатам, кетопрофен достоверно превзошел препараты контроля: так, “значительное улучшение” отметили 38, 30 и 26 % больных соответственно.
Аналогично бóльшая часть больных, получавших кетопрофен, отметили “охлаждающий” эффект геля по сравнению с контрольными средствами: 71, 60 и 49 % соответственно. Переносимость геля кетопрофена, по мнению авторов исследования, оказалась “превосходной” [57] (рис. 3).
Другим примером успешного использования локальной формы кетопрофена является работа F. Esparza
и соавт. В ходе этого исследования 223 пациента, перенесших острую спортивную травму, в течение 7 дней локально (в области повреждения мягких тканей) наносили трансдермальное средство с кетопрофеном или гель диклофенака. Через неделю число пациентов, у которых боль отсутствовала, у получавших кетопрофен составило 64 %, в то время как в контрольной группе – только 46 % (р = 0,001) [58]. Российский опыт использования локальных форм кетопрофена (в частности, Кетонала геля), также подтверждает хороший анальгетический и противовоспалительный потенциал этой лекарственной формы [59, 60].
В заключение следует отметить, что кетопрофен – удобный и эффективный анальгетик, который может с успехом использоваться как для купирования острой, так и для длительного контроля хронической боли. Благоприятные фармакологические свойства этого препарата определяют его преимущества по сравнению с другими популярными НПВС, в частности диклофенаком при ургентном
обезболивании, когда быстрота облегчения страданий имеет принципиальное значение. Наличие в арсенале врача полного спектра лекарственных форм существенно облегчает индивидуальный выбор стратегии обезболивающей терапии в конкретной клинической ситуации. Так, в некоторых случаях для получения максимально быстрого эффекта в дебюте терапии может быть оправданно применение
парентеральных форм кетопрофена с последующим быстрым переходом на пероральный прием, а при его невозможности – на использование ректальных свечей.
Системное применение кетопрофена может сочетаться с его локальным нанесением в виде геля. Локальные формы могут являться единственным возможным методом проведения терапии кетопрофеном в том случае, если его системное применение невозможно из-за высокого риска класспецифических побочных эффектов.
Конечно, кетопрофен не лишен недостатков; главный из них, свойственный всем “традиционным”
НПВС, – возможность развития патологии ЖКТ. Однако тщательный учет факторов риска и профилактическое назначение ингибиторов протонной помпы позволяют существенно уменьшать опасность развития серьезных осложнений со стороны верхних отделов ЖКТ при использовании этого
препарата.
Главное достоинство кетопрофена – низкий риск кардиоваскулярных осложнений; это преимущество
определяет возможность применения этого препарата (конечно, при соблюдении осторожности и должного контроля) пациентами с сопутствующей патологией ССС, которые, к сожалению, составляют большинство лиц, нуждающихся в эффективном обезболивании.



