Ингибиторы гидроксиметилг л у т а р и л - к о э н з и м А-редуктазы (ГМГ-КоА-редуктазы) являются приоритетными препаратами в лечении пациентов с гиперхолестеринемией вне зависимости от риска развития сердечнососудистых заболеваний (ССЗ). В соответствии с рекомендациями Европейского Общества кардиологов и Европейского Общества атеросклероза по лечению дислипидемий 2011 г.
[1] достижение целевого уровня холестерина (ХС) липопротеидов низкой плотности (ЛПНП) является основной задачей патогенетической терапии пациентов с ССЗ. При этом больным с очень высоким и высоким сердечно-сосудистым риском рекомендовано назначение статинов в максимально
переносимой дозе для достижения целевых значений ЛПНП. Кроме того, “пациентам с инфарктом миокарда (ИМ) статины необходимо назначать независимо от уровня ЛПНП” [1].
Последний мета-анализ результатов клинических исследований со статинами с участием > 170 тыс. пациентов, проведенный Объединенной группой исследователей лечения гиперхолестеринемий (CTT – Cholesterol Treatment Trialists̕ Collaborators), показал зависимость разных категорий пациентов от снижения частоты развития ССЗ при снижении уровня ЛПНП. К примеру, снижение уровня ЛПНП на 1 ммоль/л было ассоциировано примерно с 20 %-ным снижением смертности от частоты сердечно-сосудистых событий [2].
Одним из самых эффективных статинов в отношении снижения ЛПНП является розувастатин – синтетический статин ΙV поколения. Препарат Мертенил (розувастатин) компании “Гедеон Рихтер” был зарегистрирован в РФ в январе 2010 г. и активно используется в клинической практике.
По данным контролируемых клинических исследований международной программы GALAXY, включившей более 170 тыс. пациентов, при лечении розувастатином в дозе 10–40 мг/сут удается добиваться у 8 из 10 пациентов снижения уровня ЛПНП примерно на 50–60 % от исходных значений и достижения целевых уровней ЛПНП < 2,5 ммоль/л (EAS – European Atherosclerosis Society, 2007) [3, 4].
Цель данного открытого проспективного, без титрования доз исследования “40 × 40” состояла в оценке гиполипидемической эффективности, безопасности и переносимости постоянной терапии Мертенилом в фиксированной дозе 40 мг 40 больных* очень высокого риска с дислипидемиями, не достигавших целевого уровня ЛПНП < 1,8 ммоль/л [5] на фоне терапии статинами в повседнев-
ной клинической практике. Продолжительность исследования составила 24 недели.
Материал и методы
Исследование “40 × 40” проведено в лаборатории клинической липидологии отдела проблем атеросклероза ФГБУ РКНПК Минздрава РФ. После скрининга в исследование были включены 40 мужчин и женщин в возрасте от 30 до 80 лет с очень высоким риском ССЗ и первичной гиперлипидемией
IIа и IIб типов. Критерием включения пациента в исследование было отсутствие достижения целевых уровней ЛПНП < 1,8 ммоль/л при монотерапии статинами более 3 месяцев. В исследование не включали пациентов, принимавших максимальные разрешенные дозы аторвастатина 80 мг и розувастатина 40 мг, или у которых активность аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы
(АСТ) была более чем в 1,5 раза, а активность креатинфосфокиназы (КФК) – более чем в 2 раза выше верхних пределов нормы (ВПН). Кроме того, критериями исключения стали любые другие состояния, при которых участие больного в исследовании не рекомендовалось.
Поскольку пациенты исходно находились на постоянной терапии статинами, в данном исследовании эффективность терапии Мертенилом в дозе 40 мг/сут оценивали по дополнительному снижению (%) уровня ЛПНП и числу больных (%) с достижением целевого уровня ЛПНП, а переносимость и безопасность – по частоте нежелательных побочных эффектов и числу больных с повышением активности АСТ и АЛТ (более 3 ВПН), КФК (более 5 ВПН).
Дизайн исследования представлен на рис. 1.
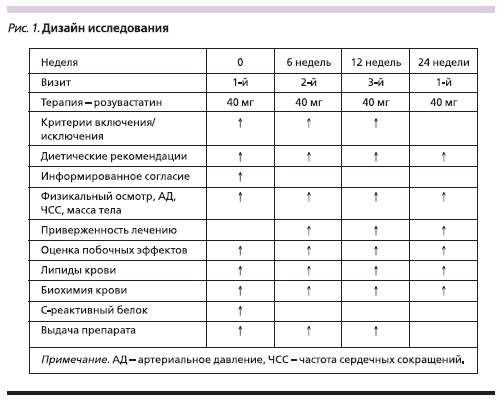
По результатам скрининга в исследование были включены 40 больных, соответствовавших критериям
включения–невключения (визит 1). Пациентам был выдан исследуемый препарат Мертенил (розувастатин, компании “Гедеон Рихтер”) и рекомендован его постоянный прием в дозе 40 мг/сут в течение последующих 24 недель. Контрольные визиты (2, 3 и 4) для оценки эффективности, безопасности и переносимости терапии были проведены через 6, 12 и 24 недели соответственно. В настоящей статье представлены данные наблюдения через 24 недели терапии (4-й визит).
Кровь на анализ брали из локтевой вены в 09.00–11.00 натощак (12 часов голодания). Концентрации (ммоль/л) общего ХС (ОХС) и триглицеридов (ТГ) измеряли ферментативным методом; липопротеидов высокой плотности (ЛПВП), ЛПНП – прямым фотометрическим методом; содержание С-реактивного белка – СРБ (мг/дл), аполипопротеинов (апо)А1 и апоВ100 (мг/дл) – методом иммунотурбидиметрии в лаборатории клинической диагностики НИИ кардиологии им. А.Л. Мясникова ФГБУ РКНПК.
Использовались следующие методы статистического анализа: определение необходимых объемов выборок при планировании исследования; проверка правильности распределения количественных признаков с использованием критерия Колмогорова–Смирнова с поправкой Лиллиефорса и критерия Шапиро–Уилка; анализ по t-критерию Стьюдента и критерию Вилкоксона. Определяли: М – среднее; SD – стандартное отклонение; медиану; (1q;uq) – интерквартильный размах; n – объем анализируемой подгруппы; р – достигнутый уровень значимости. Критическое значение уровня значимости принималось равным 0,05. Доля пропущенных значений составила 0,2 %. Анализ данных проведен с помощью программы Statistica (StatSoft, USА).
Результаты исследования
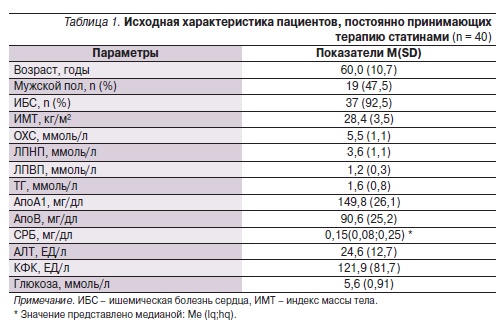
Исходная характеристика пациентов, включенных в исследование, представлена в табл. 1. Клинико-
демографические показатели и исходные биохимические данные больных были также приведены в статье “Предварительные результаты исследования 40 × 40” [6].
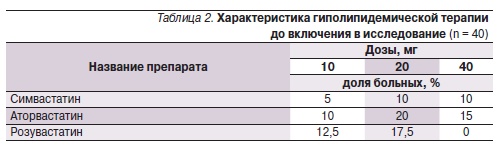
Характеристика (препарат, доза) постоянной терапии статинами пациентов до включения в исследование представлена в табл. 2.
Динамика показателей липидного профиля при изменении режима постоянной терапии: прием розувастатина 40 мг/сут (0–24 недели)
В исследовании “40 × 40” средний исходный уровень ЛПНП при терапии статинами составил 3,6 ± 1,1 ммоль/л, что вдвое превышало рекомендованный целевой уровень для пациентов данной категории риска. Средняя суточная доза статинов для пациентов, включенных в исследование, эквивалентная дозе розувастатина, составила 11,9 мг.
Изменение уровня липидов у пациентов с очень высоким риском развития ССЗ как следствие перехода с исходного режима гиполипидемической терапии (ГЛТ) на более “агрессивную” терапию розувастатином 40 мг/сут в течение 24 недель показано на рис. 2.
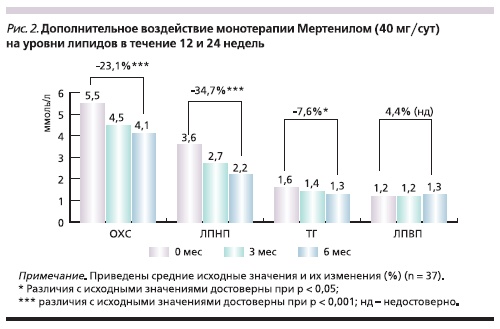
Воздействие монотерапии розувастатином привело через 24 недели терапии к дополнительному снижению уровней ОХС и ЛПНП – на 23,1 и 34,7 % соответственно (p < 0,001). При этом
статистически достоверное снижение уровня ТГ составило 7,6 %; уровень ЛПВП повысился на 4,4 % (р = 0,16).
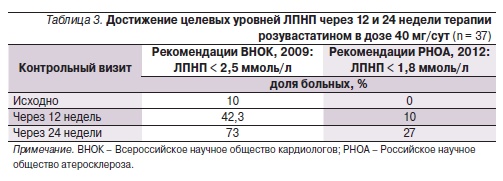
Следует напомнить, что одним из критериев включения в исследование было недостижение целевого уровня ЛПНП при текущей терапии статинами. Дополнительное снижение уровня ЛПНП через 24 недели терапии розувастатином (40 мг/сут) способствовало достижению целевого уровня ЛПНП <
1,8 ммоль/л у 10 из 37 больных, завершивших исследование (см. табл. 3). При этом уровень ЛПНП < 2,5 ммоль/л был достигнут остальными 27 пациентами. Что касается больных, которые не достигли целевого уровня ЛПНП при применении максимально разрешенной дозы розувастатина (40 мг/сут)
в течение 24 недель монотерапии, то им было рекомендовано начать комбинированную терапию розувастатином 40 мг/сут и эзетимибом 10 мг/сут.
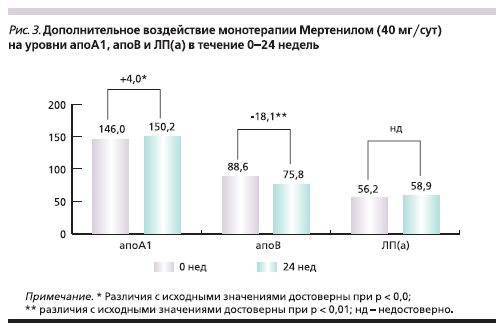
Кроме того, был проведен анализ дополнительного воздействия монотерапии розувастатином (40 мг/сут) на уровни таких дополнительных маркеров СС-риска, как апоА1, апоВ и липопротеин (а) – ЛП(а) (рис. 3). В течение 24 недель исследования средний уровень апоА1 дополнительно увеличился
на 4,1% (р = 0,047). Тогда как средний уровень апоВ достоверно снизился на 18,1 % и достиг рекомендуемого значения для пациентов с очень высоким СС-риском менее 80 мг/дл (75,8 мг/дл) [1, 5]. Медиана уровня ЛП(а) значимо не изменилась и составила через 24 недели терапии розувастатином 58,9 (9,9; 117,1) мг/дл. Следует отметить, что исходно примерно у половины (18 из 37) пациентов значение показателя ЛП(а) было выше нормы (норма – менее 30 мг/дл) [1, 5]. При этом достоверной корреляции уровня ЛП(а) с другими исследуемыми биохимическими показателями или клинической характеристикой пациентов в нашем исследовании выявлено не было.
Безопасность и переносимость терапии розувастатином в дозе 40 мг/сут (0–24 недели)
Показатели активности АСТ, АЛТ при монотерапии розувастатином в дозе 40 мг/сут через 24 недели терапии достоверно не отличались от исходных (табл. 4). В ходе заключительного визита у 2 пациентов была повышена активность АЛТ и у 3 – АСТ, однако значения не превышали 2 ВПН и были клинически незначимыми. Кроме того, у данных больных в анамнезе отмечено транзиторное повышение активности этих ферментов, что, возможно, было проявлением также ранее установленного диагноза неалкогольного стеатогепатоза. Бессимптомное повышение активности КФК во время 4-го визита было выявлено у 8 пациентов (не более 2 ВПН). Причем у 3 из 8 пациентов этот
показатель был исходно повышен. Стоит подчеркнуть, что во всех случаях повышение было клинически незначимым.
При терапии розувастатином не было отмечено достоверных изменений средних уровней билирубина,
глюкозы, креатинина и мочевой кислоты (табл. 4).
Таблица 4. Дополнительное воздействие монотерапии Мертенилом (40 мг/сут) на показатели безопасности терапии статинами и уровень СРБ в течение 0–24 недель (значения представлены в медиане Me (lq;hq) (n = 37).
В анализ не были включены данные трех пациентов. У двух пациентов выявлена низкая приверженность терапии (менее 80 %). Один пациент не смог явиться на заключительный (4-й) визит по немедицинским причинам. Побочные эффекты отмечены у 5 (12,5 %) из 40 пациентов: тяжесть в правом подреберье (2), горечь во рту (1), диарея (1), боли в суставах (1). Эти побочные эффекты не привели к изменению режима приема препарата. Причинно-следственной связи побочных эффектов с приемом препарата не выявлено.
Обсуждение
Одной из основных целей исследования “40 × 40” была оценка гиполипидемической эффективности препарата Мертенил в высшей дозе (40 мг/сут) для больных очень высокого СС-риска, не достигавших целевых уровней ЛПНП на фоне терапии статинами в условиях обычной амбулаторной практики. Согласно рекомендациям ЕОК/ЕОА 2011 г. и Российским рекомендациям по диагностике и лечению атеросклероза 2012 г., очень высокий СС-риск означает наличие у пациента документированного
ССЗ, сахарного диабета с повреждением органов-мишеней, хронического заболевания почек (скорость клубочковой фильтрации < 60 мл/мин/1,73 м2) или 10-летнего риска развития смерти от ИБС по шкале SCORE ≥ 10 % [1, 5].
В исследовании “40 × 40” на фоне терапии статинами средний уровень ЛПНП у пациентов исходно составлял 3,6 ммоль/л, что теоретически требовало его дополнительного снижения не менее чем на 1,8 ммоль/л, или примерно на 50 % в относительных значениях. В этой ситуации выбор розувастатина как наиболее эффективного (для снижения уровня ЛПНП) из применяемых в настоящее время в РФ статина в максимально разрешенной дозе 40 мг/сут был закономерен.
При анализе данных было установлено, что характеристики исходной терапии статинами (препараты,
дозы) при включении в исследование были схожими с таковыми крупных многоцентровых исследований ГЛТ в рутинной амбулаторной клинической практике РФ [7–9]. К примеру, в исследование DYSIS-Russia (n = 1586) также большинство (66,7 %) пациентов принимали синтетические статины: аторвастатин и розувастатин, однако примерно половина из них получали низкие дозы препаратов [7].
Как показано на рис. 2, перевод пациентов с текущей терапии статинами на лечение розувастатином
(40 мг/сут) в течение 24 недель способствовал дополнительному снижению уровня ЛПНП на 34,7 %. В результате почти треть (27 %) больных достигла уровня ЛПНП < 1,8 ммоль/л. При этом целевой уровень ЛПНП, по критериям рекомендаций ВНОК (2009), < 2,5 ммоль/л был у абсолютного большинства (73 %) пациентов. Это существенный прогресс по сравнению с данными исследования DYSIS-Russia, в котором уровень ЛПНП < 1,8 ммоль/л на фоне рутинной терапии статинами был достигнут только 12,2 % больных, а уровень ЛПНП < 2,5 ммоль/л был менее чем у половины пациентов [7]. По данным Международной программы клинических исследований GALAXY, розувастатин (в эквивалентных дозах) в ряде сравнительных исследований превосходил аторвастатин как по снижению уровня ЛПНП, так и по частоте (%) достижения целевых уровней ЛПНП [3, 10–16]. К примеру, в 6-недельном рандомизированном исследовании STELLAR (Statin Therapies for Elevated Lipid Levels
compared Across doses to Rosuvastatin) розувастатин в дозе 40 мг/сут снижал уровень ЛПНП на 55 %, уровень ТГ – на 34 % и повышал уровень ЛПВП на 10 %, превзойдя все другие статины по этим показателям [3]. И все-таки основной целью ГЛТ для пациентов с документированным ССЗ остается
замедление и обратное развитие процесса атеросклероза. В частности, эта задача была выполнена при проведении исследования ASTEROID (A Study To Evaluate the Effect of Rosuvastatin On Intravascular Ultrasound-Derived Coronary Atheroma Burden), в котором к больным атеросклерозом коронарных артерий применялась терапия розувастатином 40 мг/сут в течение 2 лет [17]. Результаты исследования
показали, что снижение уровня ЛПНП менее 1,8 ммоль/л с увеличением уровня ЛПВП (14,7 %) при терапии розувастатином привело к статистически значимому регрессу атеросклеротической бляшки.
Хороший профиль безопасности “агрессивной” ГЛТ в исследовании “40 × 40” соответствует данным контролируемых клинических исследований с применением длительной (не менее 2 лет) терапии розувастатином [4, 17]. Кроме того, следует учитывать, что вероятность возникновения нежелательных побочных эффектов в данном исследовании была невелика, т. к. при включении в исследование пациенты уже находились на постоянной терапии статинами.
Одной из задач нашего исследования было изучение воздействия монотерапии розувастатином 40 мг/
сут на уровни апоА1, апоВ-100, ЛП(а) и высокочувствительный СРБ (вч-СРБ). В настоящее время эти
лабораторные параметры активно изучаются в качестве дополнительных биохимических маркеров СС-риска [18–21].
В целом, по данным исследования “40 × 40”, были выявлены значимые дополнительные изменения среднего уровня апоА1 и апоВ100. Вследствие этих изменений к 24-й неделе терапии розувастатином 40 мг/сут средние уровни апоА1 и апоВ100 достигли нормальных значений, рекомендованных лицам с очень высоким СС-риском [1, 5].
Определение уровня ЛП(а) было проведено исходно и на 24-й неделе терапии розувастатином (4-й визит). При этом статистически достоверные различия могли отсутствовать из-за того, что плазменный уровень ЛП(а) в значительной степени генетически предопределен [20] (рис. 3). Уровень этого ЛП рекомендуется определять у пациентов группы высокого риска или у людей с наследственным анамнезом развития ранних атеротромботических заболеваний [21]. Как было отмечено ранее, корреляции уровня ЛП(а) с другими исследуемыми биохимическими показателями или клинической
характеристикой пациентов в нашем исследовании не было выявлено. Хотя диапазон значений этого показателя для больных был очень велик: от 1,5 до 165 мг/дл.
Статистически недостоверное снижение уровня вч-СРБ в ходе исследования можно объяснить особенностью изменений этого показателя (отсутствие дозозависимого эффекта) при постоянной терапии статинами. Кроме того, значение медианы уровня вч-СРБ у пациентов при включении в исследование было в пределах нормы.
Хотя в последнее время утверждены показания к определению дополнительных биохимических маркеров СС-риска в клинической практике, необходимы дополнительные клинические данные, чтобы иметь возможность лучше оценить риск ССО в рамках доказательной медицины. В 2012 г. в России было завершено несколько клинических исследований с препаратом Мертенил, в которых изучалось его применение в дозе 10–40 мг/сут [22–28]. В исследованиях были получены данные о высокой гиполипидемической эффективности, переносимости и безопасности этого статина для разных категорий больных, что позволяет рекомендовать его с целью более широкого клинического использования.
В настоящее время распространенность нарушений липидного обмена у пациентов, получающих статины в реальной клинической практике в РФ, изучается в международном эпидемиологическом исследовании DYSIS ΙΙ (результаты ожидаются в 2013 г.). Согласно опубликованным данным первой части этого многоцентрового исследования (2011), наименьший процент достижения целевого уровня ЛПНП характерен для пациентов очень высокого СС-риска. В то же время прогностическим фактором достижения целевого уровня ЛПНП служил прием более высоких доз статинов (отношение шансов = 0,44). На основании этих результатов и данных, полученных из исследования “40 × 40”, можно сделать вывод: коррекция липидного профиля у пациентов, получающих статины, должна проводиться c применением наиболее эффективных ингибиторов ГМГ- КоА-редуктазы за счет повышения доз этих препаратов. В итоге адекватная терапия статинами способствует основной цели – снижению частоты повторных сердечно-сосудистых осложнений у больных очень высокого СС-риска.


