Вступление
Изучение клинической эффективности новых методов лечения с экономической точки зрения в настоящее время является общепринятой практикой [1]. Экономическое бремя сахарного диабета (СД) для национальных систем здравоохранения в основном определяется следующими факторами: исходным риском развития в популяции, пожизненным характером заболевания, его неуклонным прогрессированием с развитием высокозатратных осложнений, представленных как специфическими диабетическими (нефро-, ретино- и невропатия), так и сердечно-сосудистыми (стенокардия, инфаркт миокарда, хроническая сердечная недостаточность, ишемический инсульт и др.) событиями. Для СД 2
типа (СД2) типичен высокий уровень непрямых медицинских затрат, связанных со снижением качества жизни, инвалидизацией пациентов и необходимостью постороннего ухода. При этом доля лекарственной терапии в структуре общих затрат, как правило, не превышает 10 %, прогрессивно снижаясь со временем. С учетом данного факта признано оправданным внедрение затратных методов лечения СД2 (включая новые лекарственные технологии), способных не только гарантировать лучшие результаты терапии, но и повышать качество жизни пациентов для обеспечения экономических преимуществ в последующем [2].
В Консенсусе Совета экспертов Российской ассоциации эндокринологов (РАЭ, 2012) данное положение подчеркнуто особо: “Приоритетом в выборе терапии должны стать безопасность и эффективность лечения”. По мнению экспертов РАЭ, эти параметры являются более важными, чем
стоимость препарата или длительность его использования в клинической практике. Следует ясно представлять, что стоимость сахароснижающих препаратов (ССП) представляет собой лишь небольшую часть всей стоимости лечения СД (включая средства самоконтроля, лечение острых и хронических осложнений, госпитализации и т. д.). Наибольшая часть расходов связана с лечением осложнений СД, развитие которых практически неизбежно в отсутствие адекватного гликемического контроля. Представленный алгоритм инициации и интенсификации сахароснижающей терапии СД2
является согласованным решением Совета экспертов РАЭ, основанным на обобщении отечественного и международного опыта и опирающимся на данные доказательной медицины. На сегодняшний день такой подход является единственным способом создать удобный в практическом использовании алгоритм, удовлетворяющий потребностям практического здравоохранения [3]. Поэтому как клиниче-
ская, так и экономическая целесообразность лечения СД2 определяется строгой стратификацией пациентов с индивидуализацией целевых значений гликированного гемоглобина (HbA1c)
[2, 3].
Представленная работа посвящена изучению экономических аспектов 2-го этапа терапии СД2, который требуется подавляющему числу больных при неэффективности монотерапии и необходимости добавления 2-го препарата к схеме лечения. Нередко причиной “клинической инертности” на
этом этапе является боязнь развития побочных явлений, таких как гипогликемические состояния и прибавка массы тела [1]. Препараты группы инкретинов в целом и ингибиторы дипептидилпептидазы-4 (ДПП-4) в частности в этой ситуации особо привлекательны. Нейтральный эффект ингибиторов ДПП-4 в отношении массы тела и низкий риск развития гипогликемий позволяют назначать указанные препараты практически на всех стадиях заболевания.
Для решения поставленной задачи нами был проведен сравнительный анализ результатов лечения СД2 с использованием классической схемы “глимепирид + метформин” и комбинации “вилдаглиптин + метформин” (Галвус Мет®).
Фармакоэкономический анализ Фармакоэкономическое исследование включило сравнение двух схем
использования пероральных ССП (ПССП) больными СД2: вилдаглиптин + метформин в составе фиксированной лекарственной комбинации (Галвус Мет 50/1000 мг) и комбинация двух препаратов – глимепирида (4 мг) и метформина (1000 мг). Суточная доза препаратов в двух группах составила:
для метформина – 2000 мг, глимепирида – 4 мг, вилдаглиптина – 100 мг. Данные по клинической эффективности препарата Галвус Мет® (группа Вилдаглиптин + Мет) были получены из наблюдательной программы “Эффективность препарата Галвус Мет в реальной клинической практике врача-эндокринолога”, начатой в сентябре 2010 г. в Москве [4].
Данные, используемые в отношении комбинации глимепирида и метформина (группа Глимепирид + Мет), основаны на результатах клинического наблюдения пациентов в соответствии со Стандартом первичной медико-санитарной помощи при инсулиннезависимом сахарном диабете [5]. Пациенты этой группы получали метформин 1000 мг 2 раза в сутки и глимепирид 4 мг утром. Возраст участников исследования колебался от 25 до 79 лет, значения HbA1c – от 7 до 11 %, показатели индекса массы тела (ИМТ) не превышали 40 кг/м2. Основные характеристики двух групп пациентов представлены
в табл. 1.
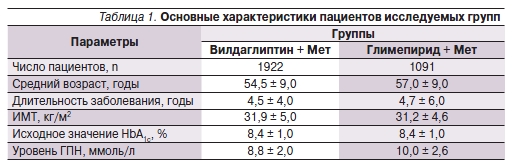
Как следует из табл. 1, пациенты обеих групп были сопоставимыми по возрасту, длительности заболевания, ИМТ, исходному значению HbA1c. Показатель глюкозы плазмы натощак (ГПН) был достоверно выше в группе Глимепирид + Мет (р = 0,04). В обеих группах не было зарегистрировано тяжелых инвалидизирующих осложнений СД2, таких как слепота, хроническая почечная или сердечная недостаточность, диабетическая стопа, ампутации конечностей.
В качестве критериев эффективности использовались:
• динамика HbA1c;
• доля пациентов, достигших уровня HbA1c < 7 %;
• изменение уровня ГПН.
В качестве критериев безопасности и побочных эффектов оценивали долю пациентов, имевших хотя бы один эпизод гипогликемии, и изменение массы тела от исходной (в %). В анализ включались только заявленные (репортируемые) гипогликемии.
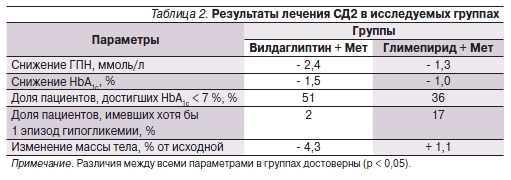
Результаты лечения СД2 в исследуемых группах представлены в табл. 2. Из данных табл. 2 видно, что в группе Вилдаглиптин + Мет наблюдалась большая эффективность лечения с точки зрения нормализации гликемического профиля пациентов. В то же время число пациентов с эпизодами гипогликемии было существенно выше в группе Глимепирид + Мет (17 %) по сравнению с группой Вилдаглиптин +Мет (2 %; p = 0,03). Тяжелых гипогликемических состояний в обеих группах на фоне лечения не отмечено.
Обе группы пациентов наблюдались в соответствии со Стандартом первичной медико-санитарной помощи при инсулиннезависимом сахарном диабете, утвержденным Министерством здравоохранения РФ. В течение года ни у одного из больных не было отмечено выраженного ухудшения течения как
СД2, так и выраженности сопутствующих заболеваний, требующих привлечения дополнительных медицинских услуг и/или госпитализации. Исходя из этого, общие расходы на ведение пациентов
складывались из прямых медицинских затрат (ПМЗ) на стандартные медицинские услуги и затрат на используемые лекарственные препараты. Источником данных о стоимости посещений специалистов и лабораторно-диагностических услуг являлись Тарифы на медицинские услуги Московского городского фонда обязательного медицинского страхования (МГФОМС), утвержденные приказом МГФОМС № 222 от 28.12.12 [6]. Цены на торговые наименования оригинальных лекарственных препаратов были получены на сайте www.medlux.ru по состоянию на 01.01.13. Все затраты оценивались из расчета на 1-го пациента.
Тактика амбулаторного ведения пациентов обеих групп не менялась в течение года. Затраты на медицинские услуги, используемые в соответствии со Стандартом ведения больных СД2,
составляют 12 456 руб. в год. В табл. 3 приводятся суммарные ПМЗ на ведение одного пациента в течение года с учетом используемых ПССП.
Таблица 3. ПМЗ на лечение 1 пациента в течение года в исследуемых группах (в руб.).
Из табл. 3 видно, что затраты на ПССП в группе Вилдаглиптин + Мет практически в 2 раза превосходят
таковые при лечении комбинацией Глимепирид + Мет (23 993 и 12 714 руб. соответственно). Доля затрат на ПССП в структуре ПМЗ на лечение составляет около 66 % для группы Вилдаглиптин + Мет и 50 % при лечении комбинацией глимепирида с метформином. Дополнительные затраты в случае перехода со схемы лечения Глимепирид + Мет на схему Вилдаглиптин + Мет равняются 11 279
руб. на 1 пациента в год.
После оценки общих затрат проведен анализы “затраты–эффективность”, “затраты–полезность” и “влияние на бюджет” для 1 пациента в год [1, 7–9].
Для оценки полезности рассчитывался показатель “годы качественной жизни” (QALY, quality adjusted life years) [10]. В ходе расчетов исходное значение показателя QALY у больных СД2 без инвалидизирующих осложнений заболевания предполагалось равным 0,885 (на основании данных исследования Health Survey for England с учетом параметров регресса EuroQol-5) [11, 12]. Дальнейшее снижение показателя QALY обусловлено осложнениями и побочными эффектами терапии СД2:
конкретно для данного исследования – гипогликемическими состояниями и увеличением массы тела. В исследовании, проведенном C.J. Currie и соавт., 1 эпизод репортируемой гипогликемии вызывал снижение QALY на 0,047, а повышение массы тела на 1 % – уменьшение на 0,014 от исходного [13, 14].
В дальнейшем для показателя “затраты–полезность” проведен анализ чувствительности в диапазоне ±
100 % цен на схемы лечения и его оценку с позиций “порога готовности платить” (ПГП) для РФ [15–18]. Фармакоэкономические расчеты осуществлены с использованием программы Microsoft Excel пакета Microsoft Office 2010 г.
В ходе анализа показателя “затраты–эффективность” был рассчитан объем затрат на достижение трех критериев эффективности [9]:
• достижение в результате лечения у одного больного уровня HbA1c < 7 % (CER HbA1c < 7 %, руб.) – основной критерий;
• снижение уровня HbA1c на 1 % у одного больного (CER 1 % HbA1c, руб.);
• снижение уровня ГПН на 1 ммоль/л у одного больного (CER ГПН, руб.).
Расчет проведен по формуле: CER = Z / Ef [23], где:
CER – коэффициент “затраты– эффективность”, руб.;
Z – величина затрат, руб.;
Ef – единица критерия эффективности.
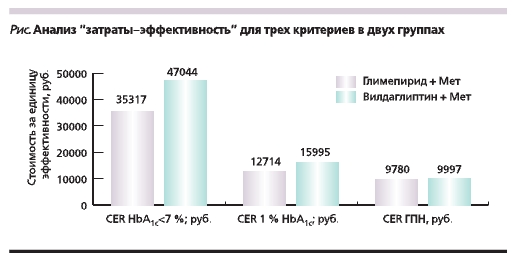
При расчете затрат на достижение одним больным HbA1c < 7 % оценивалась вероятность достижения данного показателя путем предварительного деления относительного числа больных (в %) на 100. Результаты анализа представлены на рисунке.
Из представленных на рисунке данных следует, что затраты на снижение уровня ГПН на 1 ммоль/л для групп Вилдаглиптин + Мет и Глимепирид + Мет оказались сопоставимыми, составив 9997 и 9780 руб. соответственно. Затраты для этих групп на снижение уровня HbA1c на 1 % составили 15 995 и
12 714 руб., а для 1 случая HbA1c < 7 % – 47 044 и 35 317 руб. соответственно. При этом затраты по двум последним критериям в группе Вилдаглиптин + Мет превышали таковые в группе Глимепирид + Мет на 26 и 33 % соответственно (р < 0,05).
Далее для каждой из схем фармакотерапии был рассчитан показатель QALY по формуле [10]:
QALY = QALYисх. – (0,047 × Vгипо) – (0,014 ×ΔM), где:
QALYисх. – исходное значение QALY, равное 0,885;
Vгипо – вероятность наступления любого репортируемого гипогликемического эпизода для 1 пациента в каждой из групп;
ΔM – прирост массы тела в % от исходного значения.
Поскольку в группе Вилдаглиптин +Мет прирост массы тела отсутствовал, последний показатель был приравнен к нулю.
Показатель QALY в группе Вилдаглиптин + Мет оказался выше,чем в группе Глимепирид + Мет
(0,8850 против 0,8696), и был равным исходному значению. Таким образом, назначение комбинации вилдаглиптин + метформин (Галвус Мет) за счет низкого риска гипогликемических состояний и нейтрального влияния на массу тела не способствует ухудшению качества жизни пациентов.
В настоящее время для фармакоэкономической оценки новой медицинской технологии существует
несколько методов, в частности анализы “затраты–эффективность” и “затраты–полезность”. Если первый из них позволяет оценивать затраты на достижение определенных целей в настоящем, то второй – на улучшение качества жизни в будущем. В отсутствие данных о долгосрочном влиянии инкретинов риск инвалидизирующих осложнений, частоту сердечно-сосудистых случаев и/или
течение самого СД2 применение анализа “затраты–эффективность” ограничено.
Показатель анализа “затраты–полезность” (ICUR) является величиной прогностической и виртуальной, оцениваемой только с позиций государства (как плательщика). Его значение определяет перспективность внедрения новой медицинской технологии (в т. ч. и нового лекарственного препарата) с позиций национального бюджета здравоохранения. Итогом анализа является получение денежного выражения понятия “год качественной жизни” при модификации алгоритмов лечения пациентов.
Поскольку на настоящий момент времени преимущества использования инкретинов доказаны только в отношении уменьшения числа гипогликемических состояний и нейтрального влияния на массу тела при
схожей с другими СПП эффективности, их оценку возможно проводить лишь с учетом показателей качества жизни. При получении результатов долгосрочных исследований расчеты и значения показателей могут быть другими.
Вычисление показателя ICUR проведено по формуле [10]:
ICUR = (ZВилдаглиптин + Мет – ZГлимепирид + Мет) / (QALYВилдаглиптин + Мет – QALYГлимепирид + Мет), где:
ZВилдаглиптин + Мет – общие затраты при схеме лечения Вилдаглиптин + Мет (Галвус Мет);
ZГлимепирид + Мет – общие затраты при схеме лечения Глимепирид + Мет;
QALYВилдаглиптин + Мет – показатель полезности (качества жизни) при схеме Вилдаглиптин + Мет;
QALYГлимепирид + Мет – показатель полезности (качества жизни) при схеме Глимепирид + Мет.
В итоге показатель “затраты–полезность” оказался следующим:ICUR = (23 993–12 714) / (0,8850–
0,8696) ≈ 732 403 руб.
Приемлемость полученных затрат оценивалась с учетом ПГП для усло-вий РФ [16]. Если внедрение в лечение новой технологии не требует дополнительных затрат, а наоборот, сокращает затраты, она является затратоэффективной (затратосберегающей). В случае же, когда необходимы дополнительные затраты на достижение выгоды от лечения, для оценки приемлемости новой технологии необходимо оценивать готовность населения платить за нее. Решение этой задачи обеспечивает анализ “порог готовности платить” (willingness-to-pay analysis). В зависимости от страны, методов определения и заболевания ПГП может различаться. Наличие в РФ списка жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП), а также программы “7 нозологий” определяет необходимость оценки дополнительных затрат с позиций государства (плательщика).
На сегодняшний день вилдаглиптин является единственным инкретиновым препаратом группы ингибиторов ДПП-4, включенным в список ЖВНЛП. Для РФ принято вычислять величину ПГП с учетом рекомендаций комиссии по макроэкономике ВОЗ путем умножения ВВП страны, рассчитанного на душу населения, на 3. В IV квартале 2011 г. ПГП для РФ составил 1,5 млн руб. на 1 год.
Вычисленный на основе анализа “затраты–полезность” показатель ICUR, равный 732 403 руб. на 1 год
дополнительной качественной жизни, оказался в 2 раза ниже верхней границы ПГП для РФ. Это указывает на то, что схема лечения больных СД2 комбинацией вилдаглиптин + метформин (Галвус Мет) в случае неэффективности монотерапии метформином является экономически выгодным терапевтическим подходом.
К ограничениям проведенного анализа относится невозможность учета по объективным причинам непосредственных затрат на осложнения СД [2, 3, 7]. Вследствие сходных параметров пациентов обеих групп предполагалось, что частота встречаемости осложнений СД2 будет одинаковой. С другой стороны, небольшая продолжительность наблюдения (1 год) не позволяет с уверенностью связать
частоту новых случаев развития осложнений непосредственно с лекарственной терапией. В большей степени онабудет обусловлена исходным статусом больных, который в свою очередь отражает эффективность ранее проведенной терапии и состояние углеводного обмена. Пока мы не можем в полной мере оценить клиническую эффективность инновационных препаратов с учетом таких серьезных осложнений СД, как инфаркт миокарда, инсульт, нефропатия, сердечная недостаточность, хроническая почечная недостаточность. Результатов долгосрочных исследований, посвященных изуче-
нию естественного течения диабета на фоне применения инкретинов, в отечественной и зарубежной литературе нет.
В настоящее время продолжаются 5 многоцентровых исследований длительного применения инкретинов пациентами с СД2 – EXSCEL (эксенатид-QW), LEADER (лираглутид), TECOS (ситаглиптин),
SAVOR-TIMI53 (саксаглиптин), VERIFY (вилдаглиптин) [19, 20]. Продолжительность исследований составит 5–6 лет, общее число пациентов – 8–12 тыс. Результаты данных работ позволят оценить дополнительные преимущества применения инкретинов, включая эффекты, не связанные со снижением гликемии. Использование новых данных позволит избежать недостатков ранее опубликованных исследований по моделированию исходов СД2 [12].
Выводы
1. Клиническая эффективность (HbA1c < 7 %) применения фиксированной комбинации вилдаглиптин + метформин (Галвус Мет) была сравнимой с таковой комбинации двух ПССП (глимепирид + метформин).
2. Применение схемы глимепирид + метформин сопровождалось большим числом гипогликемических
состояний и приростом массы тела.
3. Дополнительные затраты при переходе в лечении со схемы глимепирид + метформин на комбинацию вилдаглиптин + метформин (Галвус Мет) составили 11 279 руб. на 1 пациента в год и определялись исходной ценой на препараты. Затраты на снижение уровня глюкозы плазмы
натощак на 1 ммоль/л оказались сопоставимыми в обеих группах. Затраты на снижение уровня HbA1c
на 1 %, а также на достижение 1 случая снижения HbA1c < 7 % оказались выше при лечении комби-
нацией вилдаглиптин + метформин (Галвус Мет).
4. За счет лучшего профиля безопасности исходное значение показателя качества жизни (QALY) оказалось выше в группе Вилдаглиптин + Мет. Это определило значение показателя “затраты–полезность” (ICUR) при модификации схем терапии в пределах 732 тыс. руб. на достиже-
ние 1 года качественной жизни для 1 пациента, что в 2 раза ниже значения ICUR с позиций ПГП для РФ. Таким образом, фиксированная комбинация вилдаглиптин + метформин (Галвус Мет) является экономически приемлемой альтернативой классической схеме глимепирид + метформин в плане интенсификации лечения больных СД2.



