Дефицит железа (ДЖ) достаточно часто встречается среди пациентов с сердечно-сосудистыми заболеваниями (ССЗ). Так, например, недавно показана распространенность ДЖ у 10 % больных
ишемической болезнью сердца (ИБС) [1] и у 37 % больных хронической сердечной недостаточностью (ХСН) [2].
Современный подход оценки взаимосвязи изменения биохимического показателя с каким-либо заболеванием предполагает в первую очередь изучение следующих факторов:
• изменения прогноза заболевания в зависимости от изменения показателя;
• возможных патогенетических механизмов действия;
• точных критериев пороговых значений показателя;
• эффекта лечебных мероприятий по изменению уровня показателя.
Ухудшает ли прогноз пациента с ССз наличие ЖД вне зависимости от наличия анемии?
Факты ухудшения течения различных ССЗ на фоне анемии широко известны. Так, например, показано,
что анемия является фактором риска высокой смертности при остром коронарном синдроме [3] и ХСН [4, 5] (рис. 1).
![Влияние анемии на исход ХСН: результаты исследования CHARM [5]](https://lib.medvestnik.ru/apps/lib/assets/uploads/pharmateca/2012/17/pharm-17-2012-pic-1.jpg)
В связи с этим необходимо отметить, что для хронической ИБС в нескольких крупных исследованиях не выявлено влияния анемии на смертность и другие исходы при длительном наблюдении [6], однако в подгруппах пациентов с хронической болезнью почек и/или сахарным диабетом негативный
эффект наличия анемии четко прослеживается [7].
Если мы обратимся к вопросу прогностического влияния ДЖ, то можем проследить эволюцию взглядов от ранних исследований [8], в которых обсуждалась защитная роль недостатка железа относительно ИБС, до современных хорошо спланированных исследований, демонстрирующих отрицательное влияние снижения уровня железа на прогноз как при ХСН [2], так и у пациентов с ИБС и предстоящим аортокоронарным шунтированием [9]. В исследованиях 1980–1990-х гг. постулировалась связь высокой частоты ИБС и ее осложнений с наличием запасов железа в организме, которые у мужчин увеличиваются сразу после пубертатного возраста [10], а у женщин – только после менопаузы [11], а также наличие железо-индуцированного оксидативного стресса, приводящего к эндотелиальной дисфункции [12].
Следует отметить, что большинство исследований данного периода выполнено на недостаточном методологическом уровне с позиций современной доказательной медицины. Это послужило поводом к проведению новых, хорошо спланированных поисковых работ, показавших отрицательное влияние ДЖ на прогноз ССЗ вне зависимости от наличия или отсутствия анемии.
![Прогноз пациентов с ХСН в зависимости от наличия железодефицита [2]](https://lib.medvestnik.ru/apps/lib/assets/uploads/pharmateca/2012/17/pharm-17-2012-pic-2.jpg)
Одним из самых интересных исследований, проведенных на данную тему, является проспективное наблюдение 546 пациентов с ХСН в течение 3 лет (рис. 2) [2]. Группа пациентов с ДЖ показала значительно меньшую выживаемость по сравнению с пациентами с нормальным уровнем железа вне зависимости от наличия анемии, причем особую ценность этому исследованию придает тот факт, что у пациентов без анемии в 32 % случаев регистрировался ДЖ.
Какова роль железа в патогенезе ССз?
Железо играет основную роль в транспортировке кислорода (гемоглобин), накопления кислорода (миоглобин), окислительного метаболизма (в составе окислительных ферментов дыхательной цепи), а также участвует в синтезе и деградации липидов, углеводов, ДНК, РНК, коллагена, тирозина и
катехоламинов [13–15].
С учетом данных фактов можно констатировать, что наличие железа абсолютно необходимо для поддержания процессов выработки энергии в организме, особенно в клетках с высокими энергетическими потребностями – кардиомиоцитах и скелетных миоцитах. Соответственно, недостаток железа может приводить к серьезным нарушениям окислительного метаболизма и клеточных энергетических механизмов [16, 17] (рис. 3). Это отражается на уровне потребления кислорода и переносимости физических нагрузок – факторах, особенно важных для пациентов с ССЗ [18].
![Влияние дефицита железа на окислительный метаболизм [18]](https://lib.medvestnik.ru/apps/lib/assets/uploads/pharmateca/2012/17/pharm-17-2012-pic-3.jpg)
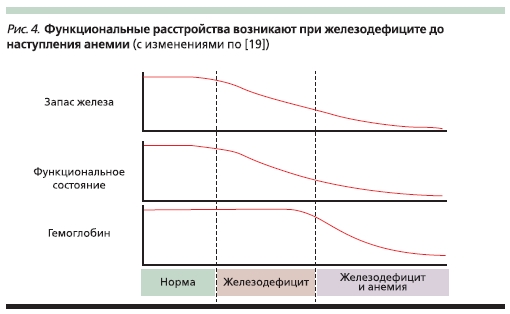
Временные взаимосвязи истощения запасов железа, возникновения анемии и функциональных расстройств (снижение иммунитета, переносимости физических нагрузок и неврологические нарушения) представлены на рис. 4 [19].
При обсуждении вопросов патогенеза необходимо упомянуть понятия абсолютного и функционального ДЖ. Абсолютный ДЖ – это общее снижение запасов железа в организме, определяемое при снижении ферритина сыворотки ниже 100 мкг/л, который в свою очередь может быть латентным или манифестированным в зависимости от отсутствия или наличия анемии. Функциональный ДЖ (ферритин > 100 мг/л, при этом насыщение трансферрина < 20 %) проявляется неспособностью обеспечить необходимым количеством железа пролиферирующие эритробласты, несмотря на достаточные запасы железа в организме.
Функциональный ДЖ является одним из звеньев патогенеза анемии хронических заболеваний, в основе которой лежит иммуноопосредованный механизм: цитокины и клетки ретикулоэндотелиальной системы вызывают изменения в гомеостазе железа, пролиферации эритроидных предшественников, продукции эритропоэтина и продолжительности жизни эритроцитов [20, 21].
Открытие железорегулирующего острофазового белка – гепцидина – позволило во многом прояснить связь между иммунным механизмом нарушения гомеостаза железа и развитием анемии хронических заболеваний. Через усиление синтеза в печени гепсидина под влиянием воспалительных стимулов (главным образом интерлейкина-6 и фактора некроза опухоли α) происходят снижение абсорбции
железа в кишечнике и блокирование высвобождения железа из макрофагов и гепатоцитов. Дизрегуляция гомеостаза железа ведет к последующей недостаточности доступного железа для эритроидных предшественников, ослаблению пролиферации этих клеток вследствие негативного влияния на них нарушения биосинтеза гема.
Анемия хронических заболеваний достаточно часто встречается среди больных ХСН и хронической почечной недостаточностью. Частое сочетание данных патологических состояний является в последние годы предметом многих исследований и даже привело к формулировке в 2003 г. группой исследователей под руководством Д. Сильверберга понятия о ”кардиоренальном анемическом
синдроме” (CRAS – cardio renal anemia syndrome) при ХСН, что способствовало некоторым изменениям в тактике лечения данных пациентов [22]. Этот синдром основывается на том факте, что каждое из трех составляющих – ХСН, хроническая почечная недостаточность и анемия – ухудшает течение
остальных двух.
В 2011 г., обобщив последние данные по этому вопросу, упомянутые ученые предложили расширить понятие и переименовать его в “синдром кардиоренальной анемии и железодефицита”(CRAID syndrome – the Cardio Renal Anemia Iron Deficiency Syndrome) [23].
Какие показатели используются для оценки железодефицита?
Согласно докладу Всемирной организации здравоохранения 2011 г. “Концентрации ферритина в сыворотке крови для оценки статуса железа и степени дефицита железа у населения” [24], для оценки абсолютного железодефицита устанавливается значение сывороточного ферритина < 15 мкг/л (для взрослых женщин и мужчин в странах с невысоким распространением воспалительных и инфекционных заболеваний).
В большинстве недавних исследований по данной проблематике для оценки наличия железодефицита к пациентам с ХСН и хронической почечной недостаточностью применялись следующие критерии: снижение ферритина сыворотки < 100 мкг/л для абсолютного дефицита и ферритина > 100 мг/л,
при этом насыщение трансферрина < 20 % для функционального дефицита. На основании этих критериев доказана достоверно более высокая смертность пациентов с железодефицитом вне
зависимости от наличия анемии [2]; кроме того, эти критерии служили точкой начала терапии во многих исследованиях, о которых речь пойдет ниже.
Какие терапевтические подходы к коррекции железодефицита у больных ССз изучены?
В конце 2011 г. был опубликован интересный систематический обзор “Лечение анемии у пациентов с ССЗ” [25], в котором проанализировано подавляющее большинство статей по указанной тематике. Строгий отбор клинических исследований для данного обзора прошли только три исследования пациентов с ХСН и ДЖ вне зависимости от наличия анемии – в одном применялся карбоксимальтозат железа (Феринжект 200 мг в неделю, фаза коррекции – до 8–12 недель, затем 200 мг в месяц, фаза поддержки –до 24–26 недель) [26], в двух других – гидроксид сахарозный комплекс железа (Венофер 200 мг в неделю – 5 недель) [27, 28]. Результатом этого анализа стали признание роли внутривенного железа в снижении функционального класса ХСН, улучшение переносимости физических нагрузок, функции почек и качества жизни, достоверное увеличение уровня гемоглобина, фракции выброса левого желудочка, снижение уровней натрийуретических пептидов, С-реактивного белка, а также уменьшение частоты госпитализаций в связи с декомпенсацией ХСН. При этом (несмотря на имеющиеся тенденции к улучшению прогноза) отсутствуют полноценные данные о влиянии монотерапии внутривенными препаратами железа на смертность и другие неблагоприятные исходы ХСН при долговременном наблюдении.
Стоит отметить, что в первом из представленных исследований применялся препарат железа для внутривенного введения нового поколения в виде карбоксимальтозатного комплекса (Феринжект), который обладает помимо уже упомянутого выше положительного действия на ХСН (переход в более низкий функциональный класс) и хроническую болезнь почек (увеличение скорости клубочковой
фильтрации) очень удобен в применении (200 мг железа можно вводить в одной внутривенной инъекции). Эта особенность существенно облегчает ведение данной категории больных на амбулаторном этапе – нет необходимости в капельном введении препарата и зачастую связанных с этим госпитализациях.
Более того, в подтверждение возможных “негемоглобиновых” механизмов действия препаратов железа у больных ХСН с ДЖ без анемии показано повышение функционального класса ХСН, потребления кислорода и общего состояния даже в отсутствие повышения уровня гемоглобина при
применении внутривенных препаратов железа [27]. В иных клинических ситуациях (ИБС и другие ССЗ), не вошедших в данных обзор, нам приходится опираться на отдельные медицинские публикации или экстраполировать подходы из них. Так, относительно применения препаратов перорального железа в кардиологической практике на сегодняшний день нет единого мнения. Однако при сравнении эффек-
тивности пероральных и внутривенных препаратов железа в нефрологической практике показан лучший ответ при меньшем количестве побочных эффектов в последнем случае [29, 30]. Более того, в одном исследовании пациентов с ХСН и анемией применение препаратов перорального железа
не привело к улучшению показателей гемоглобина и сердечной недостаточности [31]. Можно предположить, что эффективность препаратов перорального железа зависит от степени выраженности гепцидин-регулируемого угнетения всасывания железа в кишечнике (один из механизмов анемии хронических заболеваний), а также от сопутствующей патологии желудочнокишечного тракта.
В настоящий момент нет рекомендаций по коррекции железодефицита у пациентов с другой сердечно-сосудистой патологией, в частности ИБС. В силу этого возможны подходы, аналогичные лечению железодефицитных анемий, т. е. применение пероральных форм железа, а в случае отсутствия эффекта (отсутствует или недостаточный прирост гемоглобина, отсутствие ретикулоцитоза) – переход на внутривенную терапию; при выявлении признаков анемии хронических
заболеваний (функциональный дефицит железа) сразу назначение внутривенной терапии. Оптимальная тактика ведения в данной ситуации предполагает насыщающую и поддерживающую терапию препаратами железа. Длительность насыщающей терапии зависит от темпов прироста и сроков нормализации показателей гемоглобина, составляя в среднем 3–4 недели, при этом минимальная суточная доза свободного железа должна соответствовать 100–300 мг (оптимальная – 150– 200 мг). Поддерживающая терапия (до 6 месяцев) показана в тех ситуациях, когда сохраняется или трудно устранима причина ДЖ (меноррагии, беременность, патология кишечника и др.).
Заключение
Накопленные за последние годы данные позволяют сделать заключение о появлении новой терапевтической мишени – железодефицита вне зависимости от наличия анемии. Важность выявления и коррекции железодефицита у пациентов с ССЗ показана в различных хорошо спланированных исследованиях. Данные факты потребуют в ближайшее время внесения изменений в Национальные рекомендации по диагностике и лечению ХСН (в первую очередь) и других ССЗ – рутинного определения показателей железодефицита и назначения препаратов железа.
Наши австралийские коллеги уже прошли этот путь и в 2011 г. внесли дополнения в рекомендации по
ХСН: “Дефицит железа необходимо выявлять и лечить у пациентов с ХСН для улучшения клинической симптоматики, повышения переносимости физических нагрузок и улучшения качества жизни. (уровень рекомендаций В)” [32].
Следом за этим и в недавних Европейских рекомендациях по диагностике и лечению острой и
хронической сердечной недостаточности 2012 г. дано указание на выявление и лечение железодефицитных состояний у больных ХСН [33].



