Внастоящее время ишемическая болезнь сердца (ИБС) занимает ведущее место среди сердечно-сосудистых заболеваний как причина смертности и инвалидизации трудоспособного населения России [3]. Хирургический метод является наиболее эффективным методом лечения ИБС, улучшающим клиническое течение и прогноз болезни [1, 3]. Консервативное лечение пациентов с ИБС зачастую является малоэффективным, и хирургическая реваскуляризация миокарда остается единственным методом лечения, улучшающим качество жизни и прогноз. Однако многими авторами отмечена высокая частота периоперационных осложнений коронарного шунтирования (КШ) [3, 5, 7]. Особого внимания заслуживают цереброваскулярные осложнения. Проблема послеоперационных когнитивных расстройств (КР) приобретает особое значение, поскольку у большинства пациентов с ИБС нарушения в нейропсихологическом статусе имеют место еще до оперативного вмешательства [2, 4, 6].
Среди факторов, способствующих неблагоприятным когнитивным исходам после КШ, можно выделить продолжительное время искусственного кровообращения (ИК; более 120 минут), атероматоз аорты, наличие стенозов брахиоцефальных артерий, высокий класс хронической сердечной недостаточности и стенокардии, а также влияние анестетиков и наркотических анальгетиков, используемых во время операции [6]. Распространенность послеоперационных КР достигает 50–80% на момент выписки из стационара, 20–50% через 6 недель и 10–30% через 6 месяцев после операции КШ [7, 9].
К сожалению, исследованию когнитивного статуса больных, перенесших КШ, не придается должного значения и тестирование КР у таких пациентов чаще всего увязывается с диагностикой острого нарушения мозгового кровообращения в послеоперационном периоде. Кроме того, до настоящего времени остается малоизученной проблема вероятного влияния КР на функциональные возможности больных и эффективность реабилитационных мероприятий после КШ. КР ухудшают самочувствие и физическую работоспособность, а также снижают готовность к сотрудничеству и уверенность в успехе, могут значимо затруднять процесс реабилитации и негативно влиять на его эффективность у больных, перенесших кардиохирургическое вмешательство. Представления о нейропротекции в кардиохирургии развиваются на протяжении многих лет, однако в вопросе о том, как защищать головной мозг, единого мнения нет.
Предложены различные профилактические меры: от оптимизации самого анестезиологического пособия с использованием менее нейротоксичных анестетиков до интраоперационного применения средств церебральной протекции, таких как лидокаин, пропофол, барбитураты, простациклин, противовоспалительные средства. Однако ни одна из этих методик пока не получила убедительного подтверждения в клинических испытаниях [5, 8–10].
Целью нашего исследования явилось выявление когнитивного дефицита, развивающегося после КШ в ИК, с оценкой влияния цитиколина на состояние высших мозговых функций в ранний и более поздний периоды после перенесенного оперативного вмешательства.
Материал и методы
На базе Федерального центра сердечно-сосудистой хирургии (Красноярск) были обследованы 60 мужчин с диагнозом ИБС. Критериями включения в исследование служили возраст до 70 лет, планируемое КШ, согласие пациента на проведение исследования. Критерии исключения: хроническая обструктивная болезнь легких, хроническая почечная недостаточность, онкологические заболевания, сочетание ИБС с клапанными пороками сердца, сахарный диабет любого типа, фибрилляция предсердий, стеноокклюзирующее поражение брахиоцефальных артерий, эпизоды острого нарушения мозгового кровообращения в анамнезе. Кроме того, причиной исключения из исследования были предоперационные показатели <24 баллов по краткой шкале оценки психического статуса (Mini Mental State Examination – MMSE) и/или <11 баллов по группе тестов лобной дисфункции (Frontal Assessment Battery – FAB).
Пациенты были разделены на 2 равные группы (по 30 больных). В основной группе в качестве средства церебральной нейропротекции использовали препарат цитиколин (Цераксон): внутривенно за сутки до операции в дозе 1000 мг, растворенный в 200 мл 0,9% NaCl, затем в течение 7 суток после операции с последующим приемом препарата внутрь в дозе 900 мг/сут в течение 2 месяцев.

В группе сравнения в периоперационном периоде нейропротекция не проводилась. Средний возраст больных в 1-й группе составил 61,6±1,2 года, во 2-й – 57,6±1,1 года (р>0,05).
Всем пациентам выполнена операция КШ в условиях ИК. Анестезия и перфузия проведены по стандартной схеме. Длительность ИК в основной группе составила 76,6±3,8 минуты, время пережатия аорты – 51,30±4,89, в группе сравнения – 75,80±4,01 и 40,8±3,6 минуты соответственно (р>0,05).
Диагноз ИБС верифицировался на основании критериев ВОЗ, наличия ангинозных болей в грудной клетке или их эквивалента, данных анамнеза, инструментальных методов исследования. Оценка функционального класса (ФК) стенокардии проведена по классификации Канадской ассоциации сердца и сосудов (ССS,1976). Для оценки стадии сердечной недостаточности была использована классификация В.Х Василенко и Н.Д. Стражеско (1935). Оценка ФК сердечной недостаточности проведена по классификации Нью-Йоркской ассоциации сердца (NYHA,1964). Группы не различались по степени тяжести ИБС и сердечной недостаточности. Тяжесть стенокардии соответствовала II–III ФК в обеих группах.
Больные были обследованы с использованием стандартной схемы неврологического осмотра. Когнитивный дефицит выявлен по шкале MMSE, согласно которой количество баллов <28 свидетельствует о наличии умеренного КР. Состояние когнитивных функций оценено с помощью тестов FAB, теста рисования часов, исследования умственной работоспособности и психического темпа (таблицы Шульте), непосредственного и отсроченного воспроизведения слухового и зрительного материала, теста ассоциаций (семантическая речевая активность). Методика «Заучивание 10 слов» проводилась в несколько этапов: 1-й этап – с первого предъявления, 2-й – суммарное воспроизведение в 5 повторениях, 3 этап – отсроченное воспроизведение. Эмоциональное состояние больных оценивали с помощью госпитальной шкалы тревоги и депрессии (НADS).
В послеоперационном периоде проведены аналогичные обследования: общесоматическое, методы функциональной диагностики (эхокардиография, дуплексное сканирование брахиоцефальных артерий с цветовым допплеровским картированием), нейропсихологическое тестирование.
Всем пациентам проведено катамнестическое обследование через 6 месяцев после КШ.
Статистическая обработка полученных результатов проведена методами непараметрической статистики при помощи программы Statistica 6.0 (StatsoftRussia). В сравнительном анализе для проверки гипотезы о различии двух зависимых выборок использован критерий Вилкоксона, для независимых выборок – критерий Манна–Уитни. Для исследования взаимосвязи количественных признаков использован непараметрический корреляционный анализ Спирмена. Различия считались значимыми при р≤0,05.
Результаты исследования
При первичном неврологическом осмотре были выявлены изменения практически у всех включенных в исследование пациентов. Снижение работоспособности и субъективное ощущение общей слабости отмечены у 76,6%, головокружение, нарушение равновесия, шаткость походки – у 43,3% пациентов; реже встречались жалобы на головную боль (у 31,7%). Эти явления сопровождались хотя и легкими, но достаточно стойкими объективными неврологическими расстройствами в виде оживления сухожильных рефлексов, дискоординаторных явлений, симптомов орального автоматизма.
Снижение показателей на 20% от нормы в 2 и более тестах по результатам нейропсихологического тестирования расценивалось как когнитивный дефицит. Показатели когнитивных функций в группах в предоперационном периоде были сопоставимыми: в основной группе КР выявлены у 14 (46,7%), в группе сравнения – у 13 (43,3%) пациентов.
Корреляционный анализ показал, что с увеличением возраста ухудшаются результаты тестирования по шкалам MMSE (r=-0,53; p<0,05) и FAB (r=-0,58; p<0,05).
При нейропсихологическом тестировании (на 8–10-е сутки после операции) в основной группе признаки послеоперационной когнитивной дисфункции были выявлены у 11 (36,7%) пациентов, в группе сравнения – у 26 (86,7%; р>0,05).
В 1-й группе на фоне терапии Цераксоном в послеоперационном периоде (8–10-е сутки) отмечена положительная динамика при пробах на запоминание 10 слов, в тестах MMSE и FAB (табл. 1). Не было было статистически значимых различий по показателям внимания и беглости речи (латеральные и категориальные ассоциации) между результатами тестирования до и после операции. Терапия Цераксоном в послеоперационном периоде способствовала и регрессу выраженности субъективных неврологических симптомов. В большей степени эффект касался вестибулярных нарушений – жалобы на головокружение и неустойчивость при ходьбе встречались в группе сравнения значительно чаще, чем в основной (р<0,05).
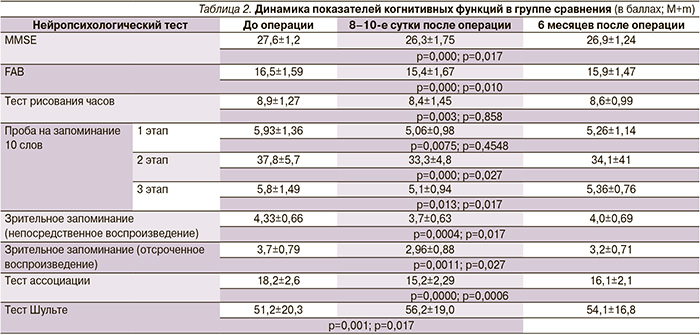
В группе сравнения, где нейропротекция не проводилась, на 8–10-е сутки после операции отмечено ухудшение по всем тестируемым функциям: беглость речи, нарушение динамического праксиса, непосредственное и отсроченное воспроизведение набора слов, снижение внимания (табл. 2). Мнестические нарушения носили неспецифический характер, не было избирательного поражения одной из сенсорных модальностей (слухоречевой, зрительной). В равной степени нарушались процессы запоминания и воспроизведения.
Степень снижения внимания коррелировала с выраженностью нарушения памяти как при непосредственном (r=-0,39; p<0,05), так и при отсроченном воспроизведении (r=-0,36; p<0,05). Выявлена обратная зависимость между длительностью ИК и результатами FAB (r=-0,42; р<0,05), что косвенно может указывать на появление или усиление дисфункции лобно-подкорковых систем. Отмечены выраженные колебания уровня непосредственного воспроизведения 10 слов (после 2–4 попыток), что говорит о флуктуации, снижении темпа интеллектуальной деятельности, характерной для поражения структур I функционального блока по А.Р. Лурия. Таким образом, во 2-й группе после операции отмечены КР в виде снижения и колебания уровня непосредственного воспроизведения, снижения отсроченного воспроизведения на фоне снижения уровня внимания и темпа психической деятельности.
В основной группе пациентов через 6 месяцев после КШ на фоне терапии цитиколином отмечена положительная динамика по всем тестам, но статистически значимые изменения когнитивных функций выявлены только по тестам MMSE (р=0,033) и шкале FAB (р=0,043), тесту Вилкоксона, в субтестах на «динамический праксис», а также при исследовании зрительной памяти на запоминание 5 слов (непосредственное воспроизведение; р=0,001). Результаты шестимесячного катамнестического наблюдения на фоне терапии цитиколином представлены в табл.1.
В группе сравнения через 6 месяцев наблюдения показатели когнитивных функций несколько улучшились, но не достигли дооперационного уровня. Отмечено достоверное улучшение слухоречевой памяти по показателям теста заучивания 10 слов при отсроченном воспроизведении (тест Вилкоксона; р=0,01), при общем количестве воспроизведений в 5 попытках (р=0,02), в то же время по сравнению с ранним послеоперационным периодом показатели непосредственного воспроизведения не претерпели статистически значимых изменений (р=0,45). При исследовании зрительной памяти выявлена положительная динамики при непосредственном (р=0,01) и отсроченном (р=0,02) воспроизведении по сравнению с 8–10 сутками после КШ. Отмечается достоверное улучшение по тестам FAB (р=0,01), MMSE (р=0,01), а также в отношении конструктивного праксиса «тест рисования часов» (р=0,08; табл. 2).
Проведена оценка взаимосвязи показателей нейропсихологического тестирования с уровнем тревоги: корреляционный анализ подтвердил отсутствие зависимости между выраженностью тревоги и качеством выполнения нейропсихологических тестов (r=0,02; р>0,05).
Таким образом, по данным проведенного исследования, не менее чем у 50% больных, направленных на кардиохирургические операции, исходно имелись КР в виде снижения объема долговременной и (в меньшей степени) оперативной памяти, а также падения уровня активного внимания. Мы провели оценку степени когнитивного снижения после КШ у пациентов, не получавших какой-либо нейропротективной терапии. У них отмечено значимое снижение исходного уровня когнитивных функций через 8–10 дней после КШ, которое сохранялось длительное время. Так, к шестому месяцу после оперативного вмешательства показатели нейропсихологического тестирования не вернулись к исходным значениям, что совпадает с результатами исследований других авторов [11, 12]. В нейропсихологическом статусе у значительной части пациентов были выявлены регуляторные и нейродинамические нарушения. Результаты тестирования указывали на преобладающую дисфункцию лобно-подкорковых структур.
Кроме того, в отличие от типичной картины сосудистых КР отмечалась заинтересованность височно-затылочных долей, что проявлялось сужением объема воспроизведения, вербальных ассоциаций, показателей зрительного запоминания.
В основной группе на фоне лечения цитиколином результаты тестирования показали сохранение дооперационного уровня когнитивного функционирования, отмечено даже улучшение показателей некоторых тестов, касающихся подкорково-лобной дисфункции. На наш взгляд, это происходит вследствие улучшения под влиянием цитиколина холинергической передачи, а также благодаря модулирующему действию препарата на глутамат- и дофаминергические нейротрансмиттерные системы [5, 8].
Полученные результаты позволяют рассматривать цитоколин (Цераксон) как протектор послеоперационной когнитивной дисфункции. Можно рекомендовать включение данного препарата в стандартную схему предоперационной подготовки, а также применять его в раннем послеоперационном периоде. Детали такой подготовки должны быть обсуждены совместно с кардиологами и неврологами.



