Запор является одним из самых частых симптомов среди населения различных географических регионов [1]. Так, в России запорами страдают до 20 % взрослого населения, их выявляют почти у 50 % беременных женщин, а по данным некоторых исследований, у 60 % детей [2]. Можно перечислить множество причин и факторов риска нарушения опорожнения кишечника, которые составляют предмет для специального рассмотрения. В настоящей статье мы сконцентрируемся на функциональном запоре (ФЗ), т. е. констипации без органической патологии толстой кишки или факторов, способствующих развитию запора как симптома – например, таких как особенности питания, прием медикаментов, сопутствующие заболевания [3].
Критерии диагноза ФЗ наряду с другими заболеваниями желудочно-кишечного тракта функциональной природы дает международная экспертная группа: они известны как Римские критерии-III. Функциональный запор – функциональное заболевание кишки, которое на протяжении длительного времени проявляет себя тугим, редким стулом и ощущением неполного опорожнения кишки, не отвечает критериям диагноза синдрома раздраженного кишечника [4].
Для постановки диагноза ФЗ следует установить у пациента два или более из следующих перечисленных признаков:
• напряжение (затруднение), по крайней мере при 25 % дефекаций;
• стул комками или твердый, по крайней мере при 25 % дефекаций;
• ощущение неполной эвакуации, по крайней мере при 25 % дефекаций;
• ощущение аноректального препятствия, по крайней мере при 25 % дефекаций;
• мануальная помощь, по крайней мере при 25 % дефекаций (например, “пальцевая” эвакуация, поддержка тазового дна);
• менее 3 дефекаций в неделю.
Характерным признаком ФЗ служит то, что послабление стула редко наступает без применения слабительных. В отличие от синдрома раздраженного кишечника при ФЗ нет рецидивирующей боли и дискомфорта в животе, связанных с дефекацией или изменением частоты и характера стула [4, 5]. Для того чтобы говорить о функциональном заболевании, следует ориентироваться на определенную продолжительность запора – не менее 3 месяцев в течение последнего полугодия.
Для установления диагноза ФЗ, как для любого синдрома функциональной природы, принципиально важно исключить его органическую причину. Важен дифференциальный диагноз с аноректальными расстройствами. Сложности возникают при оценке психологического статуса пациентов, предъявляющих жалобы на запор. Нет определенного психологического профиля, который был бы характерен или типичен для ФЗ. Следует помнить, что, например, при депрессии констипация встречается достаточно часто.
Римские критерии-III стали удобным и надежным инструментом диагностики функциональных заболеваний органов пищеварения. Их применение позволило существенно расширить число исследований, опирающихся на единый методологический подход к изучению ФЗ, в т. ч. их эпидемиологии. Так, в европейской популяции частота ФЗ оценена в соответствии с Римскими критериями-III как 2 % в обследованной группе населения, в то время как, по мнению самих опрошенных, частота запора составила 14 % [6]. Таким образом, имеет место тот факт, что врач и пациент вкладывают в термин “запор” разный смысл, и лишь единообразие диагностических критериев позволяет преодолевать эту проблему.
Ведение больных, страдающих запором, имеет ряд сложностей, некоторые из которых обусловлены мнениями, не доказанными результатами объективных исследований, но укоренившимися в сознании не только пациентов, но и врачей. Важным может быть просто профессиональное объяснение, что отсутствие стула в течение 2–3 дней не наносит вреда организму. Боязнь “самоотравления”, “задержки вредных веществ в организме” при запоре, так часто высказываемая пациентами, с научной точки зрения беспочвенна. Традиционно считается, что первоначально следует помочь пациенту с помощью модификации образа жизни и характера питания, по возможности не прибегая к медикаментозным средствам. Однако рекомендации по активизации двигательной активности и повышению количества выпиваемой жидкости не продемонстрировали доказанной эффективности [7, 8].
Важнейшим шагом в коррекции питания пациента служит увеличение потребления пищевых волокон. Уместно напомнить, что пищевые волокна – это съедобные компоненты растительного происхождения, которые не перевариваются и не абсорбируются в тонкой кишке, но полностью или частично ферментируются бактериями толстой кишки. Хотя некоторые исследования показали, что пищевые волокна увеличивают массу стула, другие не подтвердили этого предположения. Было обнаружено отсутствие корреляции между употреблением большого количества клетчатки и временем кишечного транзита. Слабительное действие пищевых волокон является комплексным и полностью не изучено. Вероятно, их воздействие связано с механическим растяжением стенки кишки неперевариваемой клетчаткой, “удержанием” воды, стимуляцией рецепторов слизистой оболочки кишки твердыми частицами. Таким образом, следует рекомендовать больным включение в рацион продуктов, содержащих большое количество пищевых волокон (это определенные злаки, корнеплоды, бобовые, фрукты, овощи), в первую очередь пшеничных отрубей [3, 9]. Целесообразно отметить, что препараты семян подорожника (psyllium) служат источником пищевых волокон, чем обусловлена их эффективность. Эти средства иногда называют “балластными слабительными”.
При ФЗ назначают слабительные средства и других групп, отличающихся их механизмом действия. К осмотическим препаратам относят солевые слабительные (сульфат магния и натрия, гидроксид магния), спирты (сорбитол), дисахариды (лактулоза), полиэтиленгликоль (макрогол). Их действие основано на повышении осмотического давления в просвете кишки, а “удержание” воды в просвете кишечника ведет к увеличению объема и размягчению каловых масс [8, 9].
Для лечения запоров предложены лекарственные средства, мишенью действия которых служат определенные молекулярные структуры, например серотониновые рецепторы: перспективным для лечения хронических запоров является агонист 5-НТ4-рецепторов прукалоприд. Активаторы хлоридных каналов (любипростон) и синтетические аналоги гуанилатциклазы (линаклотид) находятся на стадии клинического изучения [2].
Давнюю историю применения в медицине имеют стимулирующие слабительные средства, первоначально представленные препаратами растительного происхождения (например, сенна). Современные представители этого класса – бисакодил (Дульколакс®) и натрия пикосульфат (Гутталакс®) – в течение недавнего времени стали предметом широкомасштабных клинических исследований, позволивших дать объективную оценку их эффективности и безопасности с позиций медицины, основанной на доказательствах.
Название группы стимулирующих слабительных обусловлено тем, что их послабляющий эффект достигается путем раздражения рецепторного аппарата слизистой оболочки толстой кишки. Бисакодил превращается в активный метаболит бис-(р-гидроксифенил)-пиридил-2 метан (БГПМ) под действием определенного фермента (деацитилазы) колоноцитов толстой кишки, а натрия пикосульфат (сульфатный эфир бисакодила) – после расщепления его бактериями толстой кишки (см. рисунок). БГПМ стимулирует миоэлектрическую и моторную активность толстой кишки и секрецию воды и электролитов в просвет толстого кишечника; таким образом транзит по толстой кишке ускоряется и количество жидкости в стуле увеличивается [10, 11]. В качестве более “тонких” эффектов бисакодила продемонстрирована его способность стимулировать NO-синтазу, секрецию слизи и увеличивать проницаемость слизистой оболочки [11–13].
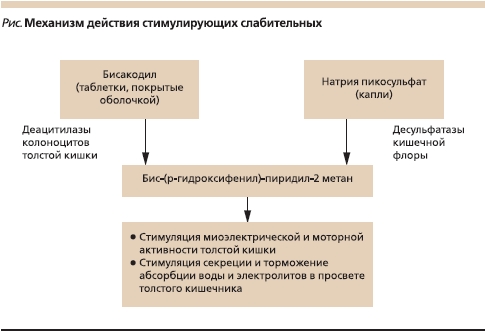
Для того чтобы целевой эффект БГПМ развивался именно в толстой кишке, препарат Дульколакс® выпускается в виде таблеток в кишечнорастворимой оболочке, которая растворяется при определенном значении рН. Гутталакс® не подвергается изменениям до толстой кишки – места его трансформации бактериями, что сделало возможным создание его жидкой лекарственной формы. Одним из достоинств капель натрия пикосульфата является возможность точного и легкого дозирования препарата. Крайне незначительное количество бисакодила и натрия пикосульфата подвергается системной абсорбции. Слабительный эффект не зависит от уровня БГМП в плазме, т. к. он проявляет именно местную активность. Послабляющий эффект наступает спустя 6–12 часов после перорального приема и через 20 минут после применения бисакодила в свечах.
Эффективность бисакодила была изучена в многоцентровом двойном слепом плацебо-контролируемом исследовании, опубликованном в 2011 г. [14]. Диагноз ФЗ устанавливали в соответствии с Римскими критериями III. После двух недель предварительной фазы исследования, в течение которой пациенты начинали ведение электронного дневника, были выделены две параллельные группы (рандомизация – 2 : 1): в одной группе (n = 247) применяли бисакодил в дозе 10 мг/сут в течение 4 недель, в другой (n = 121) – плацебо. В качестве основной оценки эффективности было принято среднее число (в неделю) самостоятельных дефекаций с чувством полного опорожнения кишечника. До лечения оно составляло 1,1 ± 0,1; на фоне лечения бисакодилом – 5,2 ± 0,3 по сравнению с группой плацебо 1,9 ± 0,3 (p < 0,0001). Следует обратить внимание на тот факт, что такой эффект по частоте дефекаций, сопровождавшихся ощущением полного опорожнения кишечника, был достигнут уже в первую неделю лечения и сохранялся в течение последующих трех недель исследования. Это особенно важно в связи с существующим предубеждением, что к стимулирующим слабительным быстро наступает “привыкание”: якобы назначенная доза быстро перестает вызывать послабление стула, что влечет за собой потребность в увеличении дозы лекарственного средства. Особенностью применения бисакодила в данном исследование было разрешение пациентам снижать дозу препарата (соответственно, и плацебо) с 2 таблеток по 5 мг/сут до 1 таблетки по 5 мг/сут в зависимости от эффективности и переносимости. Средняя недельная доза бисакодила снизилась с 56,4 за первую неделю до 48,4 мг – за вторую и 44,9 мг – за четвертую неделю (следовательно, средняя недельная доза плацебо составила 71,2, 65,0 и 65,0 мг соответственно). Таким образом, в течение четырех недель лечения эффективность бисакодила была постоянной, не было “привыкания”, более того, пациенты могли снижать дозу до комфортной. Эффективность бисакодила по сравнению с плацебо доказана и при анализе такого показателя, как среднее число самостоятельных дефекаций с чувством полного опорожнения кишечника больше 3 в неделю: на фоне бисакодила это было достигнуто в 67,4 % случаев, а на фоне плацебо – в 27,4 % (p < 0,001) [14].
Время наступления стула после начала приема назначенного препарата или плацебо было выверено с помощью электронного дневника: дефекация наступала в среднем через 12 часов (11–12 часов) после приема первой дозы бисакодила и через 19 часов (16–25 часов) после плацебо (p < 0,001). Общая оценка пациентами также оказалась в пользу бисакодила: 79,5 % больных отметили эффективность бисакодила как “ хорошую” или “удовлетворительную” по сравнению с 49,6 % при приеме плацебо; общая оценка врачами-исследователями – 90 % против 53,8 % соответственно [14].
Хорошая эффективность терапии бисакодилом и пикосульфатом натрия в дозе 5–10 мг/сут (в течение 4 недель) продемонстрирована в рандомизированном открытом исследовании в параллельных группах [15]. Существенно и статистически значимо улучшились такие показатели больных хроническим запором, как частота стула, его консистенция и необходимость в натуживании. По общей оценке врачей-исследователей существенное улучшение достигнуто в 74,6 % случаев при приеме бисакодила и в 79,2 % – при приеме натрия пикосульфата.
Специальное двойное слепое плацебо-контролируемое исследование было предпринято для оценки эффективности и безопасности натрия пикосульфата при ФЗ [16]. Диагноз ФЗ установлен в соответствии с Римскими критериями-III. Больные получали капли натрия пикосульфата (18 кап/сут, что соответствует 10 мг) (n = 233) или плацебо (n = 134) в течение 4 недель. В случае отсутствия стула в течение 72 часов была разрешена свеча бисакодила. Среднее число самостоятельных дефекаций с чувством полного опорожнения кишечника в неделю до лечения составило 0,9 ± 0,1; после лечения каплями натрия пикосульфата – 3,4 ± 0,2 по сравнению с плацебо 1,7 ± 0,1 (р < 0,0001). Процент пациентов с увеличением частоты стула при приеме стимулирующего слабительного составил 65,5 % (32,3 % в группе плацебо, разница статистически достоверна, р < 0,0001). Процент больных, у которых в результате лечения частота стула установилась 3 и более дефекаций в неделю, при приеме натрия пикосульфата составил 51,1 по сравнению с 18,0 в группе плацебо (р < 0,0001). Возможность снижения дозы натрия пикосульфата без ущерба для эффективности лечения была доказана половиной (!) больных [16].
Часто врачи опасаются назначать стимулирующие слабительные из-за распространенного мнения о негативных особенностях этих препаратов – “привыкании” к стимулирующим слабительным, с одной стороны, и их плохой переносимостью, с другой. Рассмотрим вопросы безопасности Дульколакса® и Гутталакса® на основании данных клинических исследований.
В работе M.A. Kamm и соавт. [14] нежелательные явления (НЯ) отмечены в 37 % случаев при приеме плацебо и в 72 % – при приеме бисакодила. Наиболее часто возникали диарея, боль в животе и головная боль (которая одинаково часто наблюдалась в обеих группах). Диарею пациентов, получавших бисакодил, расценили как “незначительную” в 18 % случаев, “умеренную” – в 32 % и “выраженную” – 4 %.
Принципиально важным наблюдением служит такой факт: по мнению врачей-исследователей, частота НЯ, связанных с приемом лекарственных средств, существенно снижалась после первой недели лечения. Так, при приеме бисакодила процент пациентов с НЯ с 56,9 % в первую неделю упал до 6,5, 5,4 и 4,7 % соответственно во вторую, третью и четвертую недели. При приеме плацебо 5,1 % больных доложили о НЯ в первую неделю участия в исследовании, а в четвертую неделю НЯ не было.
Лабораторные тесты показали, что лишь для одного больного в группе бисакодила снижение уровня натрия и двух больных в группе плацебо повышение гамма-глутамилтранспептидазы могли быть клинически значимыми. Гипокалиемия, развития которой часто опасаются при применении бисакодила, ни в одном случае не была зарегистрирована.
Общая оценка переносимости как “хорошая” в группе плацебо была 64,1 %, по мнению исследователей, и 32,5 %, по мнению пациентов; в группе бисакодила – 35,6 и 52,3 % соответственно. Статистическая обработка этих результатов (тест ранговой суммы Вилкоксона) привела к интересному выводу: переносимость, по мнению врачей, оказалась лучшей в группе плацебо (р < 0,0001), однако, по мнению пациентов, переносимость была лучше на фоне бисакодила (р = 0,0058). Возможно, что врачи вкладывали в понятие переносимости полное отсутствие НЯ. Пациенты же испытывали меньший дискомфорт при появлении жидкого стула, нежели при наличии запора. С учетом снижения частоты НЯ, которые исследователи связывали с приемом слабительных, с 57 % в первую неделю лечения до 5 % в четвертую следует сделать вывод, что как только пациенты подбирали для себя комфортную дозу бисакодила, переносимость лечения становилась вполне удовлетворительной.
Так же тщательно были освещены вопросы переносимости и безопасности бисакодила и натрия пикосульфата в контролируемых исследованиях S. Kienzle-Horn и соавт. [15] и S. Mueller-Lissner и соавт. [16]. S. Kienzle-Horn и соавт. показали, что 4-недельный курс бисакодила или натрия пикосульфата не оказал влияния на уровень электролитов сыворотки крови. Несколько меньшее количество НЯ было зарегистрировано при приеме бисакодила по сравнению с пикосульфатом натрия [15].
S. Mueller-Lissner и соавт. [16] отметили, что различные НЯ одинаково часто наблюдались в группах натрия пикосульфата и плацебо, за исключением диареи и абдоминальной боли. В группе плацебо “незначительная” диарея отмечена в 2,2 % случаев, “умеренная” – также в 2,2 %; в группе натрия пикосульфата “незначительная” диарея зафиксирована в 15,0 % случаев, “умеренная” – в 15,9, “выраженная” – в 5,6 %. Абдоминальная боль наблюдалась в 2,2 % случаев при приеме плацебо и в 5,6 % при приеме натрия пикосульфата. Как и в исследовании бисакодила, удалось объективно показать, что при приеме натрия пикосульфата частота НЯ, зафиксированная в течение первой недели, уменьшается при продолжении лечения: на второй, третьей и четвертой неделях терапии она была одинаковой с таковой группы плацебо. Значимых изменений в лабораторных показателях выявлено не было [16].
Современные слабительные Дульколакс® и Гутталакс® отличаются безопасностью применения и удовлетворительной переносимостью. Надо учитывать возможность послабления стула или появления боли в животе, однако эти проблемы могут быть успешно преодолены при правильном подборе дозы и уходят при продолжении курса лечения. Подбор нужной дозы не составит труда благодаря разнообразным формам выпуска, так, Дульколакс® представлен таблетками по 5 и 10 мг, ректальными свечами 10 мг, а Гутталакс® – каплями для приема внутрь, что дает возможность легко подобрать индивидуальную дозировку. “Привыкания” к этим препаратам не наступает, необходимости в неадекватном повышении дозы и их бесконтрольном приеме не возникает; наоборот, продолжение лечения без ущерба для комфортной дефекации может происходить со снижением дозы этих стимулирующих слабительных. Дульколакс® и Гутталакс® – безрецептурные средства, что возможно в т. ч. благодаря их доказанной безопасности. Однако важно помнить, что нельзя рекомендовать эти препараты на длительный срок для регулярного приема. Следует контролировать употребление пациентами стимулирующих слабительных и не допускать их неоправданного приема. Представленные данные по безопасности получены на фоне 4-х-недельного курса, и их нельзя экстраполировать на более длительное лечение.
Отрицательное влияние на репутацию бисакодила имело мнение о возможности провоцирования рака толстой кишки при злоупотреблении слабительными, в т. ч. стимулирующими. Это мнение также оказалось беспочвенным. Так, один из последних обзоров литературы показал, что длительное применение сеннозидов не связано с риском колоректального рака или других опухолей органов пищеварения; препараты сенны не вызывают структурных или функциональных нарушений нервных окончаний или гладкой мускулатуры толстой кишки и не имеют генотоксических свойств [17].
Безопасность бисакодила и натрия пикосульфата изучена в интересном и важном аспекте: поставлена задача исследования грудного молока молодых женщин в послеродовом периоде, принимающих эти слабительные. С помощью жидкостной хроматографии и масс-спектрометрии анализировали сыворотку, мочу и грудное молоко участниц исследования. Активный компонент бисакодила или натрия пикосульфата (БГПМ) и их глюкурониды не выделяются в грудное молоко здоровых кормящих женщин. Таким образом, бисакодил и натрия пикосульфат могут быть назначены женщинам в период лактации для коррекции запора [18]. При беременности НЯ на фоне бисакодила описано не было. Однако из-за отсутствия специальных исследований применение этого слабительного при беременности рекомендовано только в случаях, когда потенциальная польза для матери превышает возможный риск для плода.
Благодаря контролируемым исследованиям с плацебо [14, 16] бисакодил и натрия пикосульфат вошли в мета-анализ эффективности слабительных различных классов. Эффективность слабительных была представлена как отношение риска (ОР) отсутствия ответа на лечение по сравнению с плацебо. Из 11 077 литературных источников было отобрано лишь 49, ответивших требованиям качества исследований, из которых в дальнейшем по тем или иным причинам было исключено еще 29 работ. Восемь рандомизированных контролируемых исследований были посвящены осмотическим или стимулирующим слабительным, 7 – прукалоприду, по 3 – любипростону и линаклотиду. Исследования стимулирующих слабительных (бисакодила и натрия пикосульфата) включили 735 больных. Их эффективность доказана: ОР составил 0,54 (0,42–0,69), а число больных, которых необходимо лечить, – 3 (2–3,5). Исследования прукалоприда включили 2639 больных; ОР = 0,82 (0,76–0,88); любипростона – 610 больных; ОР = 0,67 (0,56–0,80), линаклотида – 1582 больных; ОР = 0,84 (0,80–0,87) [19]. Таким образом, мета-анализ доказал эффективность применения слабительных разных фармакологических групп, в т. ч. “классических” стимулирующих слабительных в лечении хронического запора и их превосходство над плацебо.
Функциональный запор существенно снижает качество жизни больных, а проблемы со стулом, скорее всего, будут иметь долговременный характер. Ведение пациентов с ФЗ включает комплекс разнообразных мер, но, как правило, без слабительных средств обойтись невозможно. Врачу принадлежит весьма важная роль в консультировании пациентов по вопросам выбора оптимального для определенного периода слабительного из их богатого арсенала и правильного подбора дозировки.
Бисакодил как слабительное применяется в медицине с 1950 г. (натрия пикосульфат – с 1960-го). Его многолетняя история и безрецептурный отпуск из аптек создали бисакодилу репутацию широко известного лекарственного средства. Сейчас благодаря рандомизированным контролируемым исследованиям бисакодил и пикосульфат натрия получили весомые доказательства эффективности и безопасности, что позволило им занять свое место среди препаратов с доказанной эффективностью, что безусловно повысит их рейтинг в рекомендациях по ведению пациентов с ФЗ.



