В клинической картине многих заболеваний нервной системы ведущим является болевой синдром, которому в последние годы уделяется пристальное внимание как за рубежом, так и в России [1, 2]. Болевая диабетическая полиневропатия (ДПН) – безусловно самый частый вариант синдрома периферической невропатической боли, наряду с постгерпетической невралгией относится к классическим формам невропатической боли [3]. В России и США ДПН наблюдается среди более чем 50 % больных сахарным диабетом (СД), причем болевой синдром отмечается у 25 % больных ДПН, а доминирует боль в клинической картине у 18 % [4, 5, 6]. В России около миллиона больных СД имеют болевой синдром при ДПН, что делает проблему диагностики и лечения болевого синдрома значимой с социальной и медико-экономической точек зрения.
Болевой синдром развивается у больных ДПН постепенно – в течение месяцев (хроническая форма) или нескольких дней/недель (острая форма) и локализуется в дистальных отделах ног [7]. В клинической практике наиболее часто встречается хронический болевой синдром, который характеризуется спонтанными болями с преобладанием в ночное время. Он может сохраняться десятилетиями. Острая полиневропатия малых волокон (синдром Элленберга) помимо интенсивных спонтанных болей сопровождается потерей массы тела (более чем на 25 % от исходной), депрессией, а у мужчин – импотенцией [8]. Длительность болевого синдрома в этом случае ограничивается годом. Для острой гипергликемической полиневропатии характерно возникновение боли в ногах на фоне высокого уровня глюкозы в крови с полным исчезновением болей при достижении нормогликемии. Продолжительность болевого синдрома колеблется от нескольких дней до 2–3 недель. Начало лечения больных СД инсулином с быстрым достижением нормогликемии может сопровождаться формированием острой болевой полиневропатии, напоминающей синдром Элленберга. Спонтанные боли при ДПН наиболее часто стреляющие, жгучие, могут сопровождаться динамической и статической гипералгезией (стимулозависимые боли), онемением, парестезиями, зябкостью, зудом (позитивные невропатические симптомы), а также нарушениями чувствительности всех модальностей – температурной, болевой, проприоцептивной [9].
Патогенез ДПН
Болевой феномен у больных ДПН имеет невропатический характер, что подразумевает его возникновение из-за поражения соматосенсорной (чувствительной) нервной системы. Ведущим механизмом развития боли при ДПН являются спонтанные эктопические разряды в зонах демиелинизации и ремиелинизации тонких Аδ- и С-волокон и из участков реиннервационного ветвления (спраутинга) аксонов. Большую роль играет повышение возбудимости (сенситизация) периферических ноцицепторов вследствие действия веществ (гистамин, серотонин, простациклин, субстанция Р, нейрокинин А), образующихся в поврежденных волокнах, и сенситизации ноцицептивных нейронов заднего рога, таламуса и соматосенсорной коры, приводящей к возрастанию их импульсной активности и появлению боли. Тормозное действие на ноцицептивные нейроны заднего рога оказывают нисходящее влияние центральной антиноцицептивной системы (ядра ретикулярной формации, серое вещество вокруг желудочков и сильвиевого водопровода) и проприоцептивная афферентация (система воротного контроля боли). Активность нисходящей центральной антиноцециптивной системы зависит от серотонинергических и норадренергических механизмов [10].
Поражение клеток и тканей при СД обусловлено метаболическими нарушениями, возникающими вследствие гипергликемии [11]. Известно, что декомпенсация СД может приводить к появлению болей в ногах. Описана клиническая картина только т. н. гипергликемической невропатии, когда различные сенсорные симптомы (парестезии, боли) возникают в дистальных отделах ног – обычно в икроножных мышцах, при высоком уровне глюкозы крови. Нормализация углеводного обмена приводит к исчезновению сенсорных ощущений. У больных декомпенсированным СД может снижаться скорость проведения возбуждения по нервам, причем она быстро увеличивается при коррекции гипергликемии [12]. В эксперименте с эндотелиальными клетками артерий человека показано, что 6- и 12-часовые транзиторные гипергликемии могут вызывать долгодлящиеся (до 6 дней) активирующие изменения в промоутере субъединицы р65 NF κB (ядерный фактор каппа В) [13]. Возможно, это кратковременное, но значительное повышение уровня гликемии влияет на состояние периферических нервов. Вместе с тем в настоящее время нет убедительных данных, что кратковременные колебания уровня глюкозы могут оказывать быстрое влияние на клиническую картину ДПН. Не отмечено взаимосвязи позитивной невропатической симптоматики и уровня HbA1c в момент обследования больных, а также зависимости между состоянием компенсации СД (по величине HbA1c) в момент обследования больных и неврологическим дефицитом (показатель тяжести ДПН) [28]. В исследовании, проведенном в 2142 городах США (GOAL A1c Study), также не обнаружено взаимосвязи между уровнем HbA1c и ДПН у 7892 больных СД 2 типа [14]. Однако не вызывает сомнений, что эндокринологи должны принимать активное участие в лечении больных с болевой ДПН, добиваясь максимально возможной компенсации СД.
Лечение болевого синдрома при ДПН
Лечение болевого синдрома при ДПН проводится врачами-эндокринологами с подключением при необходимости врачей-неврологов.
Рассматривая различные предложенные схемы лечения болевого синдрома при ДПН, можно выделить три основных компонента терапевтических воздействий:
1. Оптимизация контроля СД с целью минимизировать воздействие гипергликемии на периферические нервы.
2. Улучшение сосудистого обеспечения и метаболизма периферических нервов (патогенетическая терапия).
3. Блокирование боли на периферическом уровне, уровне заднего рога и в центральной нервной системе (симптоматическая терапия) [15, 16].
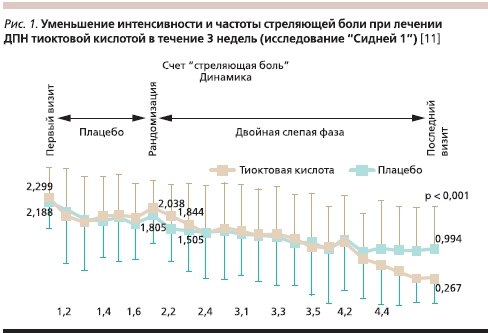
Основным недостатком предложенных схем лечения являются, во-первых, отсутствие связи между наблюдаемыми клиническими проявлениями боли с показаниями к применению того или иного препарата, т. е. определенная “обезличенность” лечения. Во-вторых, остается непонятным, в каких комбинациях следует использовать препараты, т. к. при рассмотрении их эффективности речь идет в основном о монотерапии. В-третьих, практически не рассматривается вопрос об эффективности тех или иных препаратов при острых и хронических болевых формах ДПН. Способность препарата уменьшать боль оценивают только на основании контролируемых исследований из-за большой плацебозависимости боли. Известно, что более 30 % больных с невропатическими болями реагируют уменьшением болей на введение плацебо [17]. Применение патогенетического лечения с помощью лекарственных средств, уменьшающих оксидантный стресс (тиоктовая кислота – тиогамма, депротеинизированный гемодериват крови телят), достоверно снижает выраженность боли при хронических болевых ДПН, но только на 3-й неделе терапии (рис. 1) [18, 19]. При лечении острых болевых форм ДПН патогенетическая терапия не приводит к значительному уменьшению болевого синдрома, она неэффективна. Вместе с тем, с нашей точки зрения, применение тиоктовой кислоты или депротеинизированного гемодеривата крови телят при болевой форме ДПН целесообразно из-за необходимости улучшить функциональное состояние периферических нервов. В этой ситуации может увеличиваться эффективность симптоматической терапии боли (антидепрессанты, антиконвульсанты), кроме того, создаются предпосылки к более быстрой отмене симптоматического лечения без возобновления болевого синдрома.
Для блокирования боли на уровне периферического нерва используют местные анестетики. Лидокаин в виде внутривенных инфузий или специального накожного пластыря успешно использовали для купирования боли при ДПН [20]. Прямым показанием к применению накожного пластыря является аллодиния, когда болевые ощущения возникают при неболевом стимуле (ватковая, кисточковая аллодинии). Больные аллодинией часто жалуются на то, что прикосновение постельного белья к коже ног вызывает появление жгучей боли, нарушающей сон.
Быстрое уменьшение выраженности болевого синдрома (в течение нескольких дней) достигается при хронических и острых болевых формах ДПН после назначения трициклических антидепрессантов (амитриптилин), действие которых определяется повышением уровня серотонина и норадреналина в синапсах центральной антиноцицептивной системы и усилением нисходящих тормозных влияний [21, 22]. Стандартная доза амитриптилина, с которой начинают лечение, – 25 мг; обычный терапевтический диапазон препарата – 75–150 мг. Трициклические антидепрессанты ограничены в использовании при невропатической боли, особенно пожилыми пациентами, из-за многочисленных и иногда тяжелых побочных эффектов. Амитриптилин имеет широкий круг побочных эффектов (тахикардия, задержка мочеиспускания, повышение внутриглазного давления – у пожилых людей; снижение либидо и эректильная дисфункция – у молодых людей), что ограничивает его использование, особенно в больших дозах. Ортостатическая гипотония, задержка мочи, запоры, тахикардия, “сухой синдром” могут возникать не только у пожилых людей. Наличие глаукомы и аденомы предстательной железы являются противопоказанием к назначению трициклических антидепрессантов. Кроме того, показано, что длительное применение трициклических антидепрессантов в 2,2 раза увеличивает риск развития инфаркта миокарда [3]. К дополнительным недостаткам амитриптилина можно отнести нелинейность фармакокинетики: например, при приеме небольших доз концентрация вещества в плазме может быть больше, чем при приеме больших доз. В последнее время активно разрабатываются т. н. сбалансированные ингибиторы обратного захвата норадреналина и серотонина, имеющие меньше побочных эффектов. Препарат этой группы дулоксетин используется в качестве лечения невропатической боли при ДПН, однако он уступает амитриптилину в эффективности уменьшения невропатической боли. Избирательные ингибиторы обратного захвата серотонина имеют меньше побочных эффектов, однако недостаточно эффективны [23].
Перспективным направлением в лечение болевых ДПН является применение антиконвульсантов, способных блокировать патологическую импульсную активность, модулируя работу ионных каналов ноцицептивных нейронов. Антиконвульсанты применяют для лечения болевых синдромов с 1940-х гг., когда была показана эффективность фенитоина при лечении тригеминальной невралгии.
В 1990-е гг. проведено изучение механизмов действия и клинической эффективности при невропатической боли нового поколения антиконвульсантов (габапентиноиды – габапентин и прегабалин). Наиболее большой клинический опыт накоплен для препаратов габапентина. По своей структуре габапентин близок к гамма-аминомасляной кислоте (ГАМК), однако показано, что препарат не взаимодействует с рецепторами к ГАМК. Габапентин уменьшает сенситизацию центральных ноцицепторов – в основном за счет связывания с α2-δ-субъединицей потенциалзависимых кальциевых каналов мембраны ноцицептивных нейронов, что приводит к блокированию проведения через каналы ионов кальция, уменьшению возбудимости нейронов и уменьшению боли [24]. Кроме того, габапентин обладает блокирующим действием на натриевые каналы и дополнительно имеет стимулирующее влияние на синтез и выделение ГАМК. Результаты экспериментальных исследований свидетельствуют также об ингибирующем эффекте габапентина на выделение специфического альгогена – субстанции Р из тонковолоконных первичных афферентов [25]. Побочных эффектов у габапентина немного, и, как показано в исследовании, включившем 2216 пациентов, к основным относятся сонливость (15,2 %), головокружение (10,9 %) и атаксия (6,0 %), однако тяжесть побочных эффектов незначительна, а их длительность не превышает 2–3 недель даже при продолжении приема препарата [26]. Препарат не метаболизируется в печени и выводится в виде целой молекулы через почки, поэтому он не взаимодействует с другими препаратами, но его следует с осторожностью использовать больным с нарушением функции почек. Детальное исследование, проведенное в клинике “Мэйо” на 729 больных с поражением почек, получавших габапентин, показало, что токсичность габапентина (накопление избыточного содержания вещества в крови) обнаружена только среди 5,6 % пациентов с выраженным нарушением фильтрационной способности почек и 77,8 % пациентов, находившихся на диализе, причем повышение дозы препарата редко проявлялось клинически. Таким образом, препарат может назначаться больным с поражением почек, но при этом необходимо использовать меньшие дозы и по возможности контролировать его концентрацию в крови.
Для уменьшения частоты и выраженности побочных эффектов используют систему титрования дозы препарата. Прием габапентина (габагамма) начинают с дозы 300 мг в сутки (вечером, на ночь), затем дозу увеличивают до 600 мг (один прием днем – 300 мг и один прием вечером – 300 мг), и наконец дозу увеличивают до приема 300 мг 3 раза в сутки. На фоне приема 900 мг в сутки анализируют динамику болевого синдрома и в отсутствие эффекта дозу повышают до 1800 мг в сутки (увеличивая по 300 мг в сутки). Максимальные дозы габапентина в некоторых исследованиях, где была показана высокая эффективность препарата при лечении невропатической боли, достигали 2700 или 3600 мг. При этом большинство исследователей отмечали уменьшение болевого синдрома при различных вариантах невропатической боли уже на первой неделе лечения габапентином.
Габапентин имеет высокую биодоступность (более 60 %), концентрация в плазме достигает максимума через 2–3 часа после приема препарата. Прием пищи не влияет на фармакодинамику габапентина.
В России используют препараты габапентина, выпускаемые несколькими фирмами. В последние годы наиболее широко в различных регионах России применяется препарат Габагамма фирмы “Вёрваг Фарма” (Германия). Эффективность габапентина показана в двойных слепых плацебо-контролируемых исследованиях в случаях невропатической боли у больных ДПН, постгерпетической невралгией, тригеминальной невралгией, рассеянным склерозом. В этих исследованиях габапентин назначался мужчинам и женщинам в возрасте от 20 до 90 лет при широком спектре синдромов невропатической боли, обусловленных различными заболеваниями и поражениями периферической и центральной нервной системы, показал свою эффективность и хорошую переносимость при минимальности побочных эффектов.
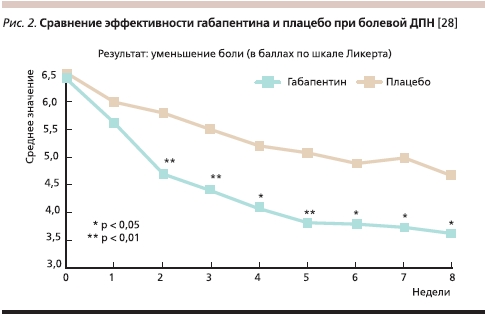
В рандомизированном двойном слепом плацебо-контролируемом исследовании анализировали эффективность лечения габапентином невропатической боли у пациентов с ДПН (84 пациента) по сравнению с плацебо (81 пациент) [27]. Исследование проводилось в амбулаторных условиях в 20 различных медицинских центрах. Препарат или плацебо назначались больным в течение 8 недель. Титрование препарата осуществлялось в течение 4 недель (первая неделя – 900 мг/сут, вторая – 1800, третья – 2400 и четвертая – 3600 мг/сут), причем ограничение дозы зависело только от побочных эффектов, но не от исчезновения боли. Интенсивность боли оценивалась по визуально-аналоговой шкале. Уже через 2 недели отмечено достоверное различие в интенсивности боли между группами, а через 5 недель в группе габапентина интенсивность боли уменьшилась с 6,4 до 3,9 см по шкале, в то время как в группе плацебо – с 6,5 до 5,1 см (p < 0,001) (рис. 2).
В двойном слепом плацебо-контролируемом исследовании по изучению эффективности габапентина при болевой ДПН были использованы меньшие дозы препарата – 1200 мг, но в течение 3 месяцев [26]. У 14 из 17 (82,4 %) больных болевой формой ДПН, получавших габапентин, боль значительно уменьшилась по интенсивности, а при использовании плацебо – только у 2 из 15 (13,3 %) пациентов (p < 0,001).
В рандомизированном двойном слепом плацебо-контролируемом исследовании в 16 центрах США изучали эффективность габапентина при постгерпетической невралгии у 225 пациентов. Сто девять пациентов получали габапентин и 116 – плацебо в течение 8 недель. Максимальная доза габапентина составила 3600 мг. Показана достоверно более высокая эффективность габапентина по сравнению с плацебо (p < 0,01).
Появление габапентина значительно расширило возможности врачей-эндокринологов и неврологов при лечении синдрома невропатической боли, что связано с купированием болей при назначении препарата у большинства больных, быстрым эффектом препарата, отсутствием значительных побочных явлений, а также с возможностью при необходимости принимать габапентин длительное время.
Интересно, что в последние годы исследуется эффективность лечения габапентином самых различных неврологических заболеваний помимо эпилепсии и классических вариантов невропатической боли.
Сообщалось об эффективном применении габапентина при послеоперационных болях, что уменьшает потребность в опиатах, при радикулярных болях у больных патологией межпозвонковых дисков и стенозом позвоночного канала. Габапентин (габагамма) как лекарственное средство переживает пору расцвета, и его потенциал в лечении различных вариантов невропатической боли еще не раскрыт.
Европейские и мировые рекомендации по лечению невропатической боли подчеркивают факт высокой эффективности габапентина при лечении болевых полиневропатий, в т. ч. диабетической, и относят его к препаратам первой линии терапии [28, 29].
Анализ данных литературы и наш собственный опыт позволяют сделать вывод о том, что оптимальной формой лечения болевого синдрома при ДПН является сочетание патогенетической терапии с симптоматическим лечением боли (местные анестетики, антидепрессанты, антиконвульсанты), выбор которых зависит от характера и выраженности болевого синдрома, а также индивидуальных особенностей пациента.
Особое внимание следует обратить на необходимость междисциплинарного подхода к лечению болевого синдрома при ДПН. Необходимы совместные усилия врача-эндокринолога и невролога для купирования болевого синдрома у больных ДПН.



