Развитие воспалительных заболеваний чаще всего обусловлено нарушением иммунитета, которое ведет к разрушению биоценоза микрофлоры нашего организма, прежде всего к дисбалансу микроорганизмов слизистых оболочек с превалированием патогенной флоры. В связи с тем, что у детей еще не сформировались иммунитет и биоценоз, в детском возрасте частота заболеваний ЛОР-органов значительно выше, чем у взрослых. Для поддержания иммунной системы необходимы здоровая пища, физические нагрузки, отсутствие стрессов, экологических проблем и хорошее состояние эмоциональной сферы.
Без бактерий, входящих в биоценоз, человеческий организм не смог бы существовать, т. к. находится с ними в гармоничном состоянии. Становление его совершалось путем эволюционных воздействий и в процессе филогенеза, онтогенез также влияет на формирование индивидуального биоценоза. На формирование биоценоза воздействует и прием некоторых препаратов, чаще – антибактериальной направленности.
Острый воспалительный процесс верхних дыхательных путей (ВДП), как правило, вызывает вирусная инфекция, что является лишь первой фазой заболевания, “прокладывающей путь” бактериальной инфекции. Вирусная инфекция является наиболее частой, но, конечно, не единственной предпосылкой развития бактериального воспаления (чаще 1– штамма) в слизистой оболочке ВДП. К этому могут приводить самые различные заболевания, сопровождающиеся снижением местной и общей сопротивляемости организма (первичные и приобретенные иммунодефицитные состояния, муковисцидоз, синдром неподвижных ресничек, эндокринные заболевания и др.). В настоящее время ведущую роль в этиологии гнойно-воспалительных процессах играют полиантибиотикорезистентные штаммы условно-патогенных бактерий различных таксономических групп [1, 6, 13].
Развитие науки постоянно предоставляет врачу новые данные, что позволяет корректировать курсы терапии воспалительных заболеваний. Так, в последние годы получена информация о том, что бактериальные популяции представляют собой биопленки –полимикробные фиксированные сообщества микроорганизмов, внедренные в синтезированный ими полимерный матрикс. Такая форма существования предоставляет бактериям массу преимуществ в условиях воздействия неблагоприятных факторов внешней среды и организма хозяина. Полученные представления о биопленках, подтвержденные с помощью современных методов визуализации, изменили взгляды на инфекционные заболевания. Новые данные свидетельствуют о том, что хронические инфекции принципиально отличаются от острых, а существование биопленок при хронических инфекциях требует совершенно новых подходов к их диагностике и лечению [2, 15, 19, 21]. Существующие в виде биопленок популяции бактерий усиливают свою защиту от фагоцитоза, ультрафиолетового излучения, вирусов и дегидратации, а также от антибиотиков и факторов иммунной защиты макроорганизма. Сами бактерии составляют 5–35 % массы биопленки, остальная часть – межклеточный матрикс. Биопленки оказались способными выдерживать концентрации антибиотиков, в 100–1000 раз более высокие, чем подавляющие планктонные клетки [13, 15]. Аналогичным образом фагоциты макроорганизма не способны поглощать биопленки в отличие от отдельных бактериальных клеток. Повышает устойчивость биопленок к вредным факторам присущее им генетическое и фенотипическое разнообразие, которое позволяет им переносить большинство терапевтических воздействий [19, 20].
Современные возможности микробиологии в нашей стране не всегда дают возможность подобрать этиопатогенетическую терапию воспалительного заболевания ЛОР-органов. Ограниченные возможности культуральных методов как при острых, так и при хронических заболеваниях в ряде случаев приводят к ошибочному или неполному диагнозу. Особенно это относится к хронической патологии, т. к., например, при хроническом риносинусите в 28,6 % случаев выявляют наличие биопленок [20]. В такой ситуации лечение, действующее на структуру или функции биопленок при хронических заболеваниях, может оказаться более эффективным, чем стандартная антибактериальная терапия.
В настоящее время в оториноларингологии преобладают тенденции использования топической терапии, особенно в детском возрасте. Это обусловлено высокой аллергизацией населения большинства стран, ростом резистентности микроорганизмов, значительной частотой побочных явлений системных препаратов и их невысоким эффектом в отношении воспалительных заболеваний. Известно, что начинать применение местных антимикробных препаратов следует как можно раньше: не позднее, чем на 2–3-и сутки заболевания респираторной инфекцией, т. е. в период становления бактериального процесса [4].
Кроме того, системное назначение антибиотиков при инфекциях ВДП зачастую не имеет смысла из-за вирусной либо иной этиологии заболевания. Это особенно важно в детском возрасте, когда детям из группы часто болеющих при очередном эпизоде простуды сразу назначают системные антибиотики. В этой ситуации становится обоснованным назначение местной терапии.
Основным компонентом лечения острых воспалительных заболеваний ВДП, вызванных бактериями, является эмпирическая антибиотикотерапия. В тех случаях, когда удается выявить возбудителя и его чувствительность к антибиотикам, назначают индивидуальный курс системной антибактериальной терапии. Необходимо помнить, что антибиотики целесообразны лишь при наличии симптомов общей интоксикации (повышение температуры тела, слабость, повышенная утомляемость, воспалительные изменения в анализе периферической крови и др.).
При назначении эмпирической антибактериальной терапии следует учитывать чувствительность основных респираторных возбудителей, поэтому преимущество имеют защищенные аминопенициллины (амоксициллин/ клавуланат, амоксициллин/сульбактам). При непереносимости этой группы антибиотиков показаны защищенные цефалоспорины 2-го поколения (цефуроксим и др.) [8, 11, 16, 24]. В случаях невозможности использовать перечисленные группы антибактериальных препаратов следует использовать макролиды (рокситромицин, кларитромицин и др.). Результаты исследования возбудителей и их чувствительности к антимикробным агентам in vitro далеко не всегда совпадают с клиническими данными. Так, при риносинусите результаты бактериологического исследования могут сильно варьироваться в зависимости от способа забора материала (из полости носа, пазухи или из среднего носового хода), от примеси “путевой” микрофлоры, а также от самих методов исследования [17, 20, 24].
Другой важный фактор, влияющий на выбор адекватной эмпирической терапии, – растущее количество резистентных штаммов основных респираторных возбудителей – “вечного трио”: Streptococcuspneumoniae, Haemophilusinfluenzaeи Moraxellacatarrhalis. В связи с этим во многих странах амоксициллин, долгое время считавшийся антибиотиком выбора в лечении риносинуситов, в последнее десятилетие практически утратил свое значение в терапии этого заболевания.
Короткие курсы антибиотикотерапии, необоснованно используемые некоторыми врачами или же при самолечении, особенно в детском возрасте, спустя непродолжительное время вновь приводят к рецидивам заболевания, сопровождаются развитием грибковой инфекции, которая в свою очередь является причиной возникновения серьезных осложнений [6, 19, 23, 24]. Эти факторы, а также тотальное использование антибиотиков в сельском хозяйстве для предупреждения развития заболеваний, способных передаваться человеку через продукты питания, приводят к крайне быстрому развитию резистентных микроорганизмов. Иногда устойчивый микроорганизм, освобожденный от “конкуренции”, развивается до такой степени, что становится опасным, приводя к возникновению инфекций, трудно поддающихся терапии.
В случае острых воспалительных заболеваний глотки важнейшую роль при выборе антимикробной химиотерапии играет присутствие β-гемолитического стрептококка группы А (БГСА). Этот микроорганизм, требующий немедленного назначения системной антибиотикотерапии, в частности пенициллинов, высевается из глотки менее чем у трети больных острым фарингитом и тонзиллитом.
Проблема рациональной терапии острых заболеваний глотки вследствие широкого распространения становится все более актуальной.
При этом необходимо учитывать следующие моменты:
- Лишь у 30–0 % людей обнаружение БГСА в посеве из глотки коррелирует с клиническими проявлениями.
- В 30–50 % случаев возбудитель не высевается при микробиологическом исследовании (ложноотрицательный результат).
- Большое количество носителей патогенной микрофлоры, в частности БГСА (ложноположительный результат).
- Невозможность исследования микрофлоры у всех пациентов.
- Исследование занимает 2–3 суток;
- Лабораторное выявление антител к БГСА в сыворотке крови и экспресс-диагностика антигенов в мазке из глотки зева не получили широкого распространения [18].
В состав топических антибактериальных препаратов, направленных на лечение воспалительных заболеваний глотки, обычно входит одно или несколько антисептических средств (хлоргексидин, гексетидин, бензидамин, тимол и его производные, спирты, препараты йода и др.), антибиотики (фузафунжин, фрамицетин, полимиксин), нередко в сочетании с местными анестетиками (лидокаином, тетракаином, ментолом), гемостатическими и дезодорирующими средствами, реже – с кортикостероидами. В состав этих препаратов также могут входить природные антисептики (экстракты растений, продукты пчеловодства), синтезированные факторы неспецифической защиты слизистой оболочки, обладающие еще и противовирусным действием (лизоцим, интерферон), витамины (аскорбиновая кислота).
Местные антимикробные препараты могут назначаться в виде полосканий, инсуфляций, ингаляций, а также таблеток и леденцов для рассасывания.
Главными требованиями к наносимым на слизистую оболочку препаратам являются:
- Широкий спектр антимикробного действия, желательно включающий противовирусную и антимикробную активность.
- Отсутствие токсического эффекта и низкая скорость абсорбции со слизистых оболочек.
- Низкая аллергенность.
- Отсутствие раздражающего действия на слизистую оболочку и угнетающего действия на мукоцилиарный транспорт.
Наиболее широкое использование топических препаратов имеет место в детском возрасте.
Следует помнить о токсичности хлоргексидина, входящего в состав многих препаратов, и не допускать их неограниченного бесконтрольного приема пациентами (особенно детьми).
К группе НПВП относят препарат кетопрофен (ОКИ), обладающий противовоспалительным, жаропонижающим и болеутоляющим действиями. Средство выпускают в виде суппозиториев, гранулята, раствора для полосканий и во флаконе с дозатором-впрыскивателем. Противопоказан он при гиперчувствительности к НПВП, пептической язве в активной форме, хронической диспепсии, гастрите, лейкопении, тромбоцитопении и у детей до 6 лет. Суппозитории, содержащие 30 мг кетопрофена лизиновой соли, рекомендованы детям массой менее 30 кг, более старшим детям и взрослым назначают суппозитории, содержащие 60 мг лекарственного вещества, по одному 2–3 раза в сутки. Гранулят назначают во время еды детям массой до 40 кг по 40 мг, взрослым – по 80 мг 3 раза в сутки. Раствор для полоскания готовят путем разведения 10 мл кетопрофена в 100 мл питьевой воды. При использовании дозатора-впрыскивателя взрослым назначают по 5, а детям – по 3 дозы препарата. В отдельную группу следует выделить средства, предназначенные для терапии пациентов с заболеваниями глотки, содержащие лизоцим.
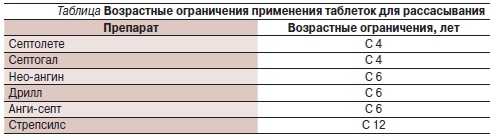
Несмотря на кажущуюся безобидность топических препаратов, их компоненты могут вызывать нежелательные воздействия на организм, особенно растущий. Поэтому существуют возрастные ограничения по их использованию (см. таблицу).
Хорошие перспективы в качестве антимикробной терапии имеют бактериофаги. Одной из причин этого является возрастание этиологической роли микроорганизмов, резистентных к большинству антибиотиков [3, 5, 7, 23]. Бактериофаги представляют собой бактериальные вирусы, антибактериальный эффект которых обусловлен специфическим лизисом бактерий (ферментативным гидролизом цитоплазматической мембраны) в очаге воспаления. По признаку специфичности выделяют поливалентные бактериофаги, лизирующие культуры одного семейства или рода бактерий; моновалентные (монофаги), лизирующие культуры только одного вида бактерий, а также отличающиеся наиболее высокой специфичностью типовые бактериофаги, способные вызывать гибель лишь определенных типов бактериальной культуры внутри вида бактерий [9, 10, 22].
Бактериофаги изначально применяли местно, перорально, вводили в полости, внутримышечно, подкожно и внутривенно [9, 10]. Используют монофаги (стафилококковый, стрептококковый, коли, протейный, псевдомонадный, клебсиеллезный) и комбинированные бактериофаги, содержащие фаголизаты от 2 до 8 бактерий.
Современные лечебно-профилактические препараты бактериофагов составлены из поливалентных вирулентных бактериофагов широкого диапазона действия, активных и в отношении бактерий, устойчивых к антибиотикам. Фаготерапия может успешно сочетаться с антибиотикотерапией [9, 10, 22].
Бактериофагам присуще почти полное отсутствие побочных эффектов, что позволяет назначать эти препараты пациентам различных возрастных групп, включая детей и беременных женщин, и применять поливалентные бактериофаги до получения результатов бактериологического исследования. Доказана возможность использования бактериофагов в комплексном лечении совместно с синбиотиками и пробиотиками [5, 7, 12, 22].
Терапевтическая эффективность фаготерапии показана при лечении заболеваний, вызванных условно-патогенными бактериями, включая дисбактериозы кишечника, гнойные поражения кожи, ЛОР-органов, опорно-двигательного аппарата, респираторного и урогенитального трактов [18, 22]. Нередко перечисленные заболевания протекают одновременно (особенно ЛОР-патология и дисбиоз кишечника у детей), и в этой ситуации целесообразность назначения фагов значительно возрастает. Установленная активность в отношении антибиотикоустойчивых штаммов позволяет отнести фаги к средствам этиотропной терапии.
Так, активностью в отношении синегнойной палочки обладают бактериофаг псевдомонадный жидкий (бактериофаг псвдомонас аэругиноза); пиобактериофаг комбинированный жидкий, пиополифаг в таблетках; пиобактериофаг поливалентный очищенный жидкий или Секстафаг; интести-бактериофаг жидкий. В отношении стрептококков активность имеют бактериофаг стрептококковый жидкий; пиобактериофаг комбинированный жидкий; пиополифаг в таблетках; пиобактериофаг поливалентный очищенный жидкий или Секстафаг. При выявлении клебсиеллы можно рекомендовать бактериофаг клебсиелл пневмонии; пиобактериофаг поливалентный очищенный жидкий или Секстафаг; бактериофаг клебсиелл поливалентный.
Жидкие препараты фагов представляют собой стерильные фильтраты бактериальных фаголизатов. Их целесообразно вводить в полости после их освобождения от гноя (например, в полость уха, пазух). Достоинством бактериофагов является способность поражать как чувствительные, так и полиантибиотикорезистентные клетки возбудителя; каскадная способность к повторному избирательному лизису остающихся в очаге воспаления клеток возбудителя до полной их элиминации без нарушения нормального микробиоценоза. Результативность использования бактериофагов можно прогнозировать на основании предварительного определения фагочувствительности возбудителя. Так, в течение последних лет отмечена высокая (98,7 %) лизабельность стафилококков.
Препарат Секстафаг (пиобактериофаг поливалентный) обладает способностью специфически лизировать стафилококки, стрептококки (в т. ч. энтерококки), кишечную палочку, протея, синегнойную палочку и клебсиеллу пневмонии. Его используют для профилактики и лечения различных форм гнойно-воспалительных и энтеральных заболеваний: гнойно-воспалительных заболеваний уха, горла, носа, дыхательных путей, легких и плевры; хирургических, урогенитальных и энтеральных инфекций; генерализированных септических заболеваний, в т. ч. гнойносептических заболеваний новорожденных и детей грудного возраста. Его можно применять в зависимости от характера очага инфекции: местно – в виде полосканий, орошений, для введения в полость ран, абсцессов, обкалывания флегмон, для введения в полость носа, пазух носа, полость среднего уха и т. п. Кроме того, препарат рекомендован для приема через рот, его можно вводить через зонд. Длительность курса лечения поливалентным пиобактериофагом составляет от 5 до 15 дней при условии применения 1–3 раза в день. Количество препарата, используемое в лечении, определяется индивидуально. Возможно проведение повторных курсов лечения. При инфекциях ЛОР-органов Пиобактериофаг поливалентный рекомендован для внутриполостного введения по 2–20 мл 1–3 раза в день.
В настоящее время альтернативой системной антибиотикотерапии при лечении больных с заболеваниями ВДП, в частности глотки, являются топические препараты. При обнаружении антибиотикоустойчивых форм возбудителей можно рекомендовать использование комплексных бактериофагов с высокой специфической литической активностью, способных элиминировать возбудителей гнойно-воспалительных процессов различной локализации.
Информация об авторе:
Тарасова Галина Дмитриевна – доктор медицинских наук, ФГУ “Научно-клинический центр
оториноларингологии” ФМБА России.
E-mail: gtarasova@yandex.ru



