Введение
С момента открытия микробов Антони ван Левенгуком, т.е. почти 350 лет назад, основным объектом их изучения были и в значительной степени остаются изолированные клетки микроорганизмов. Активно изучаются их морфологические, биохимические, генетические свойства, кроме того, в отношении изолированных микроорганизмов определяется чувствительность к различным антимикробным препаратам. Именно эти научные данные составляют базу современных микробиологии и фармакологии. Все умозаключения и прогнозы по течению патологического инфекционного процесса и направления этиотропной антимикробной терапии базируются на представлениях, будто основной причиной инфекционного процесса и заболевания служит множество одинаковых и самостоятельных микроорганизмов.
Однако уже более 30 лет назад была сформулирована концепция микробных сообществ, получивших название «биопленки» (англ. – biofilms), которая является одним из наиболее важных достижений микробиологии и в целом медицины последних лет [1]. Жизнь микробов в составе сообществ биопленок столь же принципиально отличается от этих давно сформировавшихся представлений, как жизнь охотника-одиночки, от существования огромного мегаполиса [2, 3]. Сегодня уже достоверно установлено, что и в естественных условиях, и в организме человека и животных, и в условиях производств все микробы не существуют как самостоятельные и изолированные клетки, а находятся в составе биопленок [4, 5]. В организме человека микробные сообщества образуют все представители нормальной микрофлоры и возбудители болезней. Формирование и распространение биопленок в организме играют важнейшую роль в развитии патологического процесса [6, 7].
В последние годы на основании данных Центра по контролю и профилактике заболеваний США (CDC) доказано, что более 70% инфекционных заболеваний человека сопровождаются образованием биопленок [8]. К ним относят основные инфекционные болезни всех систем и органов, включая и т.н. терапевтические инфекции (например, Helicobacter pylori). При том что инфекционные заболевания остаются ведущей причиной смертей во всем мире, очевидно, что именно применение антибиотиков служат основой этиотропной терапии большинства болезней. Появление в арсенале лекарственной терапии антибиотиков позволило за последние 70 лет резко снизить смертность и значительно повысило продолжительность жизни людей. Однако рост антиботикорезистентности (АБР) в последние годы привлек внимание исследователей к феномену биопленок как одной из ведущих причин АБР [7–11].
Большой и постоянно растущий интерес исследователей к этой проблеме подчеркивается и количеством публикаций на тему биопленок; например, ресурс PubMed отражает наличие более 38 тыс. публикаций на эту тему, статистика по годам приведена на рис. 1.
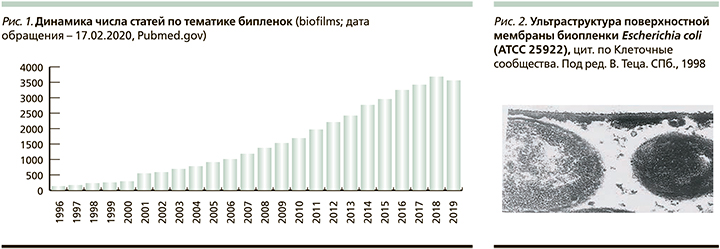
Биопленки
Явление образования биопленок открыто в середине 1980-х гг. [12–13]. Первоначально биопленки микроорганизмов рассматривались как механизм, позволяющий выживать бактериям в сложных условиях. Но дальнейшее изучение позволило понять, что биопленки служат естественной формой существования микробов, в то время как планктонные (свободноживущие) формы представляют лишь одну из стадий развития микробного сообщества [6, 14–15].
В течение последующих лет исследований биопленок было доказано, что биопленкообразование присуще массе патогенных и условно-патогенных микроорганизмов [16–17], а механизм образования биопленок расценивается как фактор патогенности [6, 7, 16].
Строение биопленок
Микробные биопленки – это сообщества, образованные родственными и неродственными бактериями, отграниченными от внешней среды, внутри которых клетки имеют специализацию и контактируют между собой.
Ключевыми особенностями биопленок считают:
- изоляцию от окружающей среды оболочкой;
- образование внеклеточного матрикса;
- наличие межбактериальных контактов и взаимодействия;
- кооперацию клеток, образующих биопленку и наличие у них дифференциации признаков.
Все представители нормальной микрофлоры в организме человека существуют в составе биопленок. Биопленки представляют собой сообщества микробов, поддерживающих свой состав и расселяющихся за счет клеток, которые периодически высвобождаются и мигрируют, способствуя распространению инфекции. Биопленки разных микробов имеют сходный принцип строения. Все они содержат бактерии и межклеточный матрикс, в котором выделяют поверхностную оболочку, отграничивающую сообщество от окружающей среды [8, 11, 18–19]. В состав поверхностной оболочки и матрикса биопленок входят полисахариды в количестве от 40 до 95% (в т.ч. декстран, гиалуроновая кислота, целлюлоза и др.). Концентрация прочих химических компонентов сильно варьируется. Доля белков может составлять до 60%, липидов до 40% и нуклеиновых кислот (внеклеточной ДНК и РНК) 1–20%. Данные соединения находятся в гидратированном состоянии, т.к. 80–90% объема биопленки занимает вода [8, 13]. Известно, что внеклеточная ДНК и белки бактериальных биопленок играют важную роль в морфогенезе и функциональных изменениях биопленок, необходимых для их сохранения [20–21]. Поверхностная мембрана состоит из компонентов клеточных мембран участников сообщества и обладает схожими свойствами (рис. 2).
Существование бактерий внутри изолированных биопленок обеспечивает им много преимуществ по сравнению с изолированными клетками. Для практической медицины особенно важно, что бактерии в биопленках характеризуются повышенной выживаемостью в присутствии агрессивных веществ, факторов иммунной защиты и антибиотиков. Бактерии в биопленках выживают в присутствии антибиотиков, добавленных в количестве, в 500-1000 раз большем, чем их минимальная подавляющая концентрация [10, 16]. В настоящее время идет интенсивное изучение причин такой удивительной устойчивости к антибиотикам у бактерий биопленок. Установлено, что в основе повышенной выживаемости лежат свойства клеток и внеклеточного матрикса (табл. 1).

Фазы развития и строение биопленок
Формирование биопленки проходит несколько значимых этапов: адгезия, размножение, созревание, выход планктонных форм (рис. 3).
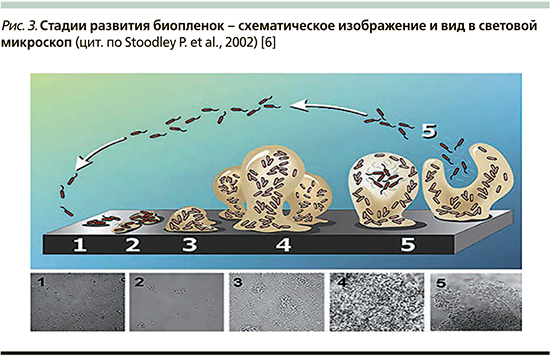
Рис. 4 представляет многообразие внутренней среды колоний: помимо собственно клеток с признаками дифференциации матрикс содержит белки и полисахариды, жирные кислоты и другие продукты жизнедеятельности; фрагменты ДНК, а также массу низкомолекулярных веществ, имеющих регуляторную функцию т.н. сигнальных молекул.
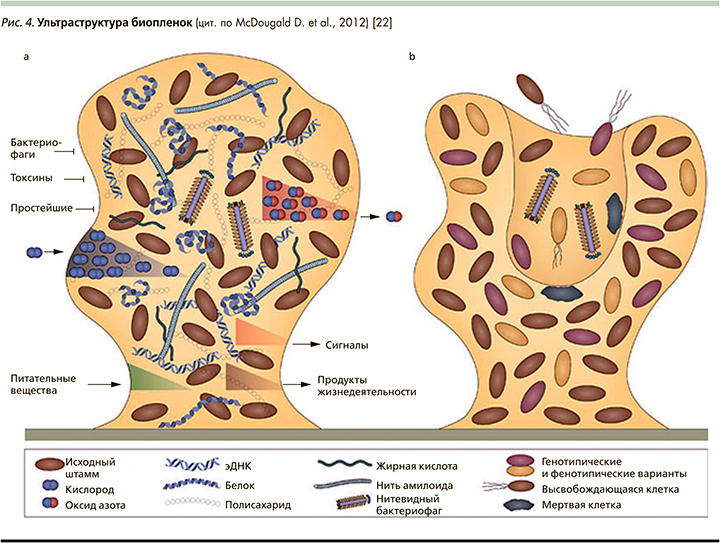
Матрикс, внеклеточная полимерная субстанция (extracellular polymeric substances), внутренняя среда сообществ биопленок, имеет огромное значение в жизни микробного сообщества: он формирует внутреннюю среду, может связывать или не пропускать, и/или инактивировать антибиотики; обеспечивает циркуляцию питательных веществ и жидкостей, транспорт токсинов, метаболитов, газов, сигнальных молекул и т.п. [20–23].
Компоненты биопленки как факторы АБР
Для обособленных (небиопленочных или планктонных) микробных клеток классическими признаны пять типов устойчивости к антибиотикам: модификация мишени, инактивация антибиотика, активное выведение антибиотика из микробной клетки (эффлюкс), нарушение проницаемости внешних структур микробной клетки, формирование метаболического шунта [24]. Накопленная научная информация позволяет утверждать, что у микробов в биопленках присутствуют почти все типы «планктонной» резистентности (табл. 2).

Эффективность проникновения антибиотиков в значительной степени связана с их способностью преодолевать поверхностную оболочку и межклеточный матрикс биопленок.
В составе последних содержится значительное количество различных липидов, по качественному составу аналогичных мембранным [25, 26].
Установлено, например, что в биопленки Klebsiella pneumoniae плохо проникает ампициллин, а в сообщества Enterococcus faecalis – ампициллин, ко-тримаксозол и ванкомицин [27, 28]. В биопленки ряда микробов по тем же механизмам затруднено проникновение амоксициллина [29].
Однако в биопленках существуют еще и особые, присущие только им формы устойчивости, которые могут быть связаны по крайней мере с тремя или даже более типами механизмов [34, 35]. Первым из них следует считать формирование клеток-персистеров. Персистеры – это фенотипический вариант клеток с обычным для данного штамма генотипом, но с сильно заторможенным метаболизмом. Состояние метаболической инертности клеток с выключением многих биохимических процессов образно называют бактериальным анабиозом [36]. Именно поэтому персистеры устойчивы практически ко всем препаратам [36–38].
По разным данным и в разных популяциях доля персистеров сильно различается, составляя от 15 до 85%, при этом отмечается, что в неблагоприятных условиях она значимо возрастает [38–40].
Внутри как мономикробных, так и неродственных (полимикробных) сообществ резистентность может быть связана с фильтрующей способностью матрикса. Наблюдения in vitro показали, что матрикс бактериальных биопленок состоит из различных биополимеров – полисахаридов, белков и даже ДНК [41]. Матрикс образовывает внутреннюю среду сообщества, пространственно и функционально связывая клетки в единую структуру, заполняет все межклеточные пространства, образуя трехмерную сложнейшую систему, созревающую вместе с сообществом. Все это позволяет считать поверхностную мембрану и матрикс своеобразным «молекулярным фильтром» и выделять фильтрацию поступающих веществ в качестве одной из важнейших функций биопленки [20, 42]. Опубликованы работы, в которых наблюдали замедленную диффузию антибиотиков внутрь биопленок. Например, было описано затруднение пенетрации ципрофлоксацина внутрь биопленки, сформированной P. aeruginosa [43]. Показано, что поверхностно (по отношению к мембране биопленки) расположенные бактерии подвержены воздействию антибиотика сильнее, чем глубоко расположенные клетки [44]. Механизмом этих эффектов может быть как связывание антибактериальных агентов, так и их инактивация.
Предложена 3-уровневая систематизация устойчивости бактерий к антибиотикам, учитывающая наличие биопленок [45]. Связанный с биопленками надклеточный уровень устойчивости называют толерантностью, она определяется трудностями преодоления антибиотиками поверхностной оболочки биопленки и матрикса, а также неэффективностью действия на часть клеток (персистеры), находящихся в не доступном для антибиотиков состоянии [46]. Второй уровень устойчивости определяется свойствами клеточной стенки, мембраны бактерий и наличием выкачивающих помп, обеспечивающих резистентность к противомикробным препаратам. Третий уровень – цитоплазматический, ассоциированный с изменением свойств мишени и регуляцией генов. Также отмечается, что спорообразующие бактерии имеют дополнительный четвертый уровень, связанный с устойчивостью бактериальных спор к действию антибиотиков и антисептиков/дезинфектантов [35, 47].
Кворум-сенсинг
Еще одной ключевой особенностью биопленок является феномен Quorum sensing (QS), дословно – чувство кворума. QS – это процесс коллективной регуляции посредством координации экспрессии генов в популяции бактерий, опосредующий специфическое поведение клеток. Впервые явление межклеточной коммуникации обнаружено и описано у симбиотической морской бактерии Vibrio fischeri [48]. Формирование, рост, дифференциация планктонных и биопленочных фенотипов клеток в биопленках регулируются на уровне популяции посредством механизмов межклеточной коммуникации, формируясь при достижении некоей критической массы/количества бактерий-участниц [49]. Установлено, что клеточно-клеточные взаимосвязи влияют и на экспрессию генов вирулентности, регулируют ростовые процессы, характер и направление подвижности (таксис), а также бактериальный апоптоз и токсинообразование [34, 35, 49].
Функция QS аналогична гормональной регуляции различных органов и тканей в многоклеточном организме. Разные микробы используют различные сигнальные системы и разные химические передатчики сигналов: 7–8-членные пептиды и циклопептиды характерны для грамположительных, а разнообразные ацилгомосерин лактоны (AHL) – для грамотрицательных микроорганизмов [8]. QS на основе AHL обнаружен у многих грамотрицательных бактерий: Aeromonas, Acinetobacter, Brucella, Burkholderia, Chromobacterium, Enterobacter, Erwinia, Hafnia, Serratia, Vibrio, Yersinia и др. [50]. Именно за счет реакций QS осуществляются «социальные» отношения внутри популяции, образуется «коммуникационная сеть», при этом такое «общение» возможно и среди неродственных микроорганизмов.
К интересным и важным следует отнести и обнаруженный феномен «читинга» (от англ. cheating – обман, мошенничество), который заключается в следующем: даже дефектные по способности синтезировать биопленочный матрикс и формировать самостоятельные биопленки микроорганизмы могут участвовать в биопленкообразовании, используя компоненты биопленок, продуцируемые другими микробами [20, 51]. В данном контексте само понятие «небиопленкообразующие микроорганизмы» теряет свой смысл.
Роль микробных биопленок в развитии гинекологической патологии
Нормальный биотоп влагалища также представлен в виде биопленок, выстилающих поверхность слизистой оболочки. При нарушении вагинального микробиоценоза происходит элиминация лактобацилл, сопровождающаяся колонизацией влагалища анаэробами: Fusobacterium, Mobiluncus, Peptostreptococcus, Gardnerella vaginalis. Именно последней, G. vaginalis, факультативно-анаэробной грамотрицательной палочке, отдается ключевая роль в развитии бактериального вагиноза (БВ) [52]. Он чаще всего характеризуется полимикробной этиологией, однако основным запускающим процесс патогеном является именно G. vaginalis. Биопленка G. vaginalis притягивает к себе другие микроорганизмы, образуя конгломерат бактерий, в большинстве своем обладающих патогенным для макроорганизма эффектом. Биопленки, как было установлено, состоят в основном из G. vaginalis, в то время как Atopobium vaginae присутствует в 80% случаев и составляет 40% от массы биопленки. Другие бактерии встречаются намного реже, в т.ч. бактерии, принадлежащие к родам Bacteroides, Corynebacterium, Lactobacillus, Veillonella, Ruminococcus и Streptococcus [52–54].
Вагинальные биопсии у женщин без нарушений вагинального микробиоценоза показали в основном свободно распределенные молочнокислые бактерии, в т.ч. Lactobacillus, Streptococcus, и Enterococcus.
Основные постулаты концепции биопленок:
- G. vaginalis может присутствовать во влагалище в свободном состоянии или в формате биопленки.
- Наличие планктонных или ассоциированных в биофильме G. vaginalis может быть надежно установлено в осадках мочи и у женщин, и у мужчин.
- Существует абсолютная конкордантность в переносе биопленки, образованной G. vaginalis между женщиной с БВ и ее партнером.
- G. vaginalis, по-видимому, является первым видом, прикрепляющимся к вагинальному эпителию, а затем становится местом адгезии других патогенов.
- Нет достаточно надежной in vitro модели биопленки БВ в настоящее время, что препятствует поиску новых терапевтических агентов [52].
Далее было обнаружено, что G. vaginalis представлена в двух различных состояниях, т.е. слущенные клетки существуют либо как диспергированные Gardnerella в виде свободно циркулирующих клеток, указывающих на планктонный рост, либо как сцепленные со слизистой оболочкой бактерии, состоящие из кластеров клеток с адгезией на эпителии, что свидетельствует о присутствии Gardnerella в виде биопленки [53]. Доказано, что G. vaginalis обладает наибольшей способностью к адгезии и цитотоксичностью в отношении клеток вагинального эпителия. При этом G. vaginalis формирует биопленку, значительно более массивную, чем другие БВ-ассоциированные анаэробы [54]. Перенос биопленки и заражение БВ, как правило, происходят половым путем [55, 56].
По образному сравнению A. Swidsinski: «Биопленка при бактериальном вагинозе –это густой лес, где высокие, могучие деревья – гарднереллы. Они создают условия для жизни птиц – Atopobium vaginae, зверей – Mobiluncus spp. и прочих обитателей» [55, 57]. Недавно установлено, что при БВ преобладает массивные структурированные полимикробные биопленки с доминированием G. vaginalis. Такие биопленки окутаны десквамированными вагинальными/препуциальными эпителиальными клетками и секретируются с мочой и спермой. Таким образом, GV-биопленка представляется своеобразным инфекционным агентом, как правило, заражающим партнера другого пола. Сборка отдельных компонентов биопленки является не каждодневным процессом, но, вероятно, эволюционным событием с долгой историей роста, размножения и отбора жизнеспособности и возможности изменить окружающую среду. Монотерапия метронидазолом, моксифлоксацином или местными антисептиками подавляет, но не всегда элиминирует эти биопленки [57].
Канадские авторы провели исследование, в ходе которого изучалось появление плотной бактериальной биопленки, состоящей из лактобацилл в сочетании с другими условно-патогенными микроорганизмами, и влияние метронидазола на биопленки. Исследователи выяснили, что метронидазол не уничтожает условно-патогенные бактерии, формирующие бактериальную биопленку, но способствует образованию в ней отверстий [58]. Уже давно развеян миф о стерильности слизистого слоя матки и маточных труб. Профессор A. Swidsinski установил, что микробные биопленки организуются не только во влагалище, но и в эндометрии и маточных трубах [59]. Причем их обнаружили в соскобах как у беременных, так и у пациенток, обратившихся по поводу других гинекологических заболеваний, потребовавших кюретаж. В результате у 76% женщин в полученном соскобе определялись бактерии. Важно отметить, что у половины женщин, имеющих биопленки во влагалище, биопленки формируются также в эндометрии. Бактерии в матке приобретают особый тропизм: прикрепляются к клеткам просветной поверхности эндометрия, а также адгезируются глубже к ткани желез, богатой питательными веществами секрета. Доказана возможность формирования микробных биопленок и в маточных трубах [60]. Женщины с БВ имеют повышенный риск бактериальной колонизации эндометрия и фаллопиевых труб с отношением шансов 5,7 (95% доверительный интервал – 1,8–18,3; р=0.002). К сожалению, нет уверенности, что нормализация флоры во влагалище как-либо поспособствует ликвидации патологических микробных биопленок в маточных трубах.
Подходы к терапии
Понимание того факта, что микроорганизмы в составе биопленок обретают новые свойства, предполагающие существенное снижение чувствительности к стандартным методам этиотропной терапии, включающей антибиотики, заставляет исследовать все новые способы воздействия. Кратное увеличение дозировок антибактериальных средств малоэффективно, ибо достижение эффективных концентраций в условиях in vivo недостижимо по понятным причинам. Поэтому рассматривается масса подходов, оказывающих влияние на компоненты биопленок с целью снижения уровня их резистентности/целостности с использованием сочетания антибактериальных препаратов [61], антисептиков [62–64], органических кислот [64, 65], солей металлов [66], микробных метаболитов и бактериофагов [67–68], ферментов различного происхождения [69–71]. Перспективными признаются способы воздействия на компоненты матрикса, сигнальные молекулы, факторы адгезии [72].
Использование в качестве адъювантов антимикробной терапии ферментов насчитывает не одно десятилетие [10, 73]. Показана возможность влияния на формирующиеся биопленки с помощью лизоцима, альгинатлиазы, целлюлазы [71], различных протеиназ и их комбинаций [69–70], ДНКазы [74], гиалуронидазы [75]. Примени-тельно к гиалуронидазе (бовгиалуронидазе азоксимеру) использование высокомолекулярного носителя позволило увеличить срок пребывания активного фермента в биологических средах, защитить его от действия антипротеиназ и ингибиторов с сохранением биологической активности [75].
Показано, что 2 часа инкубации бовгиалуронидазы азоксимер в концентрации 750–1500 МЕ/мл вызывает двукратное снижение биомассы матрикса зрелых биопленок E. faecalis и E. coli и на 60% – S. аureus, не влияя на процессы образования бактериальных биопленок. При сочетанном применении с антибактериальными средствами препарат повышает их эффективность в отношении бактерий в составе биопленок. Например, концентрация ципрофлоксацина и амоксициллина, необходимая для уменьшения количества E. faecalis в биопленке на 3 порядка, в присутствии бовгиалуронидазы азоксимера снижается в 16 раз (p<0,05). В присутствии фермента для снижения количества КОЕ на 3 порядка в биопленке E. coli достаточны в 16 раз меньшие концентрации цефуроксима, фосфомицина, ципрофлоксацина и амикацина (p<0,05). Цефуроксим оказывал бактерицидное действие на клетки в биопленке S. aureus в достоверно меньшей концентрации при сочетанном применении с бовгиалуронидазой, чем при моноприменении (p<0,05). Очевидно, что бовгиалуронидаза азоксимер увеличивает проникновение антибактериальных средств к клеткам бактерий в биопленке, что обеспечивает потенцирование их антибактериального эффекта. Такое действие ферментного препарата позволяет снижать дозу и повышать безопасность антибактериальных средств при сохранении их эффективности. Ранее подобные результаты были показаны и при клинической оценке эффективности сочетанного применения бовгиалуронидазы азоксимера с антибиотиками [76–79].
Заключение
Бактериальные биопленки – это сообщества микроорганизмов, встроенных в матрикс внеклеточных полимерных веществ (субстанций), которые продуцируются самими бактериями биопленки и включают белки, полисахариды, нуклеотиды в разных соотношениях. Состав внеклеточных полимерных веществ видоспецифичен, а также варьируется в зависимости от условий формирования биопленки. Биопленка должна рассматриваться как защитная структура, которая благодаря свойствам матрикса позволяет клеткам пережить неблагоприятные условия. Наличие биопленок является одним из главных факторов развития антибиотикорезистентности.
Пути преодоления устойчивости в биопленке направлены, во-первых, на предотвращение адгезии (подавление чувства кворума), во-вторых, на предотвращение перехода к образованию биопленки и подавление роста (антибиотики, биоциды), в-третьих, на разрушение сформированной биопленки (ферментативный гидролиз, медиаторы чувства кворума, ферментные препараты).



