Исторические, социологические и экономические аспекты нарушений питания
Здоровье человека в значительной степени определяется его пищевым статусом, т. е. степенью обеспеченности организма энергией и всем комплексом пищевых и биологически активных веществ. Любое отклонение от т. н. формулы сбалансированного питания приводит к определенному нарушению функций организма, особенно если эти отклонения достаточно выражены и продолжительны. Поэтому рациональное, адекватное возрасту, профессиональной деятельности, состоянию здоровья питание рассматривается как важный фактор в профилактической и клинической медицине [1].
Сложившийся десятилетиями “западный” тип питания принципиально отличается от оптимального. Он характеризуется употреблением чрезмерного количества жиров, холестерина, насыщенных и тугоплавких жирных кислот, простых сахаров, а также высокоочищенных продуктов и катастрофически малым потреблением полезных микронутриентов. Основная масса пищевых продуктов подвергается технологической переработке, консервированию, транспортировке, длительному хранению, что неизбежно приводит к снижению их пищевой ценности [2].
В то же время, несмотря на существенное увеличение мировых запасов продовольствия, голод является одним из важнейших факторов, определяющих уровень заболеваемости и смертности.
При употреблении алкоголя происходит увеличение экскреции магния, калия и других веществ, увеличение их эвакуации, разрушение запасов питательных веществ в организме и ухудшение их утилизации. Питание человека, злоупотребляющего алкоголем, особенно скудно и дефицитно по всем жизненно важным пищевым веществам. Кроме того, алкоголь и токсические продукты его окисления в организме, в частности ацетальдегид, разрушают многие витамины, чем еще более усугубляют их нехватку.
В наше время организм человека перегружен ксенобиотиками. Прежде всего речь идет о многочисленных непищевых веществах, токсичных для организма, поступающих различными путями в пищевые продукты и, соответственно, в организм человека, в т. ч. для консервации, улучшения вкуса, цвета, внешнего вида, отрицательное действие которых на организм многообразно и часто до конца не изучено.
Дефицит микро- и макронутриентов как причинный фактор развития и усугубления течения хронического панкреатита
В подавляющем большинстве работ постулируется, что дефицит питательных веществ у больных хроническим панкреатитом (ХП) обусловлен синдромом внешнесекреторной недостаточности поджелудочной железы (ПЖ), приводящим к синдрому мальдигестии ряда микро- и макронутриентов, реже упоминается возможность нарушения нутритивного статуса вследствие назначения больным ХП-диеты, ограниченной в ряде нутриентов, их повышенного расхода. Однако только в немногих работах обсуждается возможность исходного нарушения нутритивного статуса как одного из факторов возникновения и/или усугубления заболевания вследствие указанных выше причин. Кроме того, не вызывает сомнения, что нормализация статуса макро- и микронутриентов у больных острым панкреатитом (ОП) и ХП способствует улучшению состояния таких больных. Это является косвенным признаком дефицита данных веществ и также требует анализа работ, в которых изучались риск развития и течение панкреатита при применении макро- и микронутриентов [3, 4].
Хорошо известны результаты исследования, в котором сравнивались обычные диеты пациентов с идиопатическим ХП, больных эпилепсией, получавших антиконвульсанты, и здоровых лиц. В этой работе идентифицировали потребность пациентов только в трех субстанциях (метионин, витамин C и селен), которые в совокупности поддерживают уровень панкреатических метильных и тиоловых групп [5]. О низких концентрациях в сыворотке/плазме этих микронутриентов сообщили ряд исследователей [6–8]. Авторы предполагают, что причиной этого являются увеличение окисления антиоксидантов вследствие их использования в процессе заболевания и оксидативного стресса, синдрома мальабсорбции.
Подобные результаты стали побудительным мотивом для изучения эффекта использования микронутриентов (селен, метионин, витамин С, β-каротин) в лечении больных ХП и позволили сделать ряд выводов [9]:
- Назначение комплекса данных микронутриентов во время атаки панкреатита способствует более выраженному снижению интенсивности болевого абдоминального синдрома (БАС), уровня маркеров электрофильного стресса и повышению содержания глутатиона в эритроцитах по сравнению с контрольной группой независимо от этиологии ХП.
- Недавнее рандомизированное исследование [10] демонстрирует, что профили антиоксидантов крови у больных ХП улучшаются в течение месяца и боль редуцируется в течение 3 месяцев, что соответствует данным исследований, проведенных в Манчестере [8] и Белфасте [11], в которых боль редуцировалась в течение 10 недель.
- Исследование P. Dite и соавт. показывает, что степень электрофильного стресса является самой высокой у пациентов с самыми большими нарушениями функции паренхимы [12].
- Исследование общего антиоксидантного статуса не позволяет контролировать эффективность микронутриентной терапии.
- На первый взгляд кажется сомнительным, что монотерапия витамином C, как в исследовании P. Dite и соавт. у больных алкогольным ХП, может быть эффективной (витамин Е давали больным, но его уровни на фоне лечения не улучшались) [12]. Однако этот клинический эффект подтверждают экспериментальные данные. Так, аскорбиновая кислота уменьшила степень повреждения ПЖ дибутилина дихлоридом [13] и секреторную блокаду, вызванную мощным оксидантом тертбутилгидроксипероксидом [14].
Опубликован ряд других экспериментальных, эпидемиологических и клинико-биохимических исследований, доказывающих существенно низкие статусы других антиоксидантов и питательных веществ у больных ОП и ХП, причем положительный клинический эффект их применения свидетельствует о множественных дефицитах у данных больных.
В University Departments of Surgery and Biochemistry, Glasgow Royal Infirmary (Великобритания) обследованы 13 больных с неблагоприятным прогнозом течения ОП и 26 здоровых лиц. Пациенты имели существенно более низкие уровни антиоксидантов, чем здоровые (р < 0,017). Выявлена существенная обратная корреляция между пиком концентрации С-реактивного протеина и уровнями антиоксидантов в крови (р < 0,01). При умеренной тяжести ОП концентрация β-каротина была выше, чем при неблагоприятном течении заболевания (р < 0,05) [15]. Сотрудники Department of Surgery, University Hospital of Wales, Health Park (Великобритания) наблюдали больных ХП (n = 27), ОП (n = 11) и 19 здоровых лиц. Больные ХП имели существенно более низкие концентрации β-каротина, ксантина, β-криптоксантина и ликопина в плазме по сравнению с контрольной группой и больными ОП (p < 0,05) [7].
В проспективном индийском исследовании наблюдался 101 пациент с ХП (34 с алкогольным и 67 с тропическим панкреатитом). Содержание цинка было значительно ниже у пациентов с тропическим и алкогольным ХП по сравнению со здоровыми лицами (26,5 ± 9,5 против 38,0 ± 6,6 мг/г Hb; р < 0,001). Выявлена положительная корреляционная связь уровня цинка в эритроцитах и уровня фекальной эластазы-1 (r = 0,587; р < 0,001) [16].
Описаны результаты наблюдения за 12 пациентами с ХП с БАС или перенесшими атаку панкреатита за год перед началом лечения комплексом, содержащим L-метионин, β-каротин, витамин C, витамин E и органический селен. Интенсивность БАС была значительно уменьшена у 9 больных, полностью боль исчезла у 3 пациентов c достоверным снижением частоты госпитализаций (соответственно 1,5 ± 1,62 и 0,25 ± 0,45; p = 0,03) [17].
Сотрудники Department of Medical Gastroenterology, Manchester Royal Infirmary (Великобритания) опубликовали результаты 20-недельного двойного слепого перекрестного исследования, в котором пациенты с заболеваниями ПЖ получали 2 таблетки в день, содержавшие в целом 600 мкг органического селена, 9000 МЕ β-каротина, 0,54 г витамина С, 270 МЕ витамина Е и 2 г метионина. Двадцать больных завершили протокол (8 с идиопатическим ХП, 7 с алкогольным ХП, 5 с острым идиопатическим панкреатитом). Двадцать человек обследованы в качестве контрольной группы. У 6 пациентов регистрировались атаки панкреатита во время приема плацебо, в то время как при приеме комплекса атаки не было ни в одном случае (p = 0,032). Количественный анализ выраженности БАС продемонстрировал существенный положительный эффект комплекса по сравнению с плацебо (исходный уровень и плацебо, p = 0,073; комплекс и исходный уровень, p < 0,001; комплекс и плацебо, p = 0,049). Исходный уровень маркеров свободных радикалов (9-цис, 11-транс-изомеров линолевой кислоты) незначительно снизился у пациентов, получавших плацебо, и существенно уменьшился на фоне назначения антиоксидантов [5, 6].
В течение 9 лет – начиная с 1985 г. Manchester pancreato-biliary team наблюдались 106 пациентов с болевой формой ХП (в 42 % случаев этиология панкреатита была алкогольной, в 28 % – смешанной, в остальных случаях панкреатит относился к идиопатическому). На фоне назначения описанной выше комбинации антиоксидантов у 73 % пациентов отмечено полное прекращение болевого синдрома, сохранение стойкой ремиссии; 26 % больных сообщили об уменьшении выраженности боли. В хирургическом лечении нуждались только 7 пациентов, у 6 проведен дренаж псевдокист и у 1 – холецистэктомия по поводу желчнокаменной болезни [18]. Опубликованы результаты плацебо-контролируемого исследования, следующего за кросс-секционным ретроспективным наблюдением, в которое вошли 94 больных ХП. В течение 30 месяцев они получали метионин, витамин С и селен. Назначение данной комбинации приводило к значительному снижению выраженности БАС [19].
Сотрудники Department of Surgery, Royal Victoria Hospital, Belfast, Northern Ireland (Великобритания) опубликовали результаты двойного слепого плацебо-контролируемого перекрестного исследования, длившегося 20 недель. Тридцать шесть пациентов с ХП получали либо комплекс BioAntox, содержавший 75 мг селена, 3 мг β-каротина, 47 мг α-токоферола ацетата, 150 мг витамина С и 400 мг метионина 4 раза в день или плацебо. По результатам анализа данных опросника SF-36 прием комплекса способствовал значительному улучшению качества жизни за счет уменьшения выраженности БАС (+17 среди принимавших комплекс и -7 среди принимавших плацебо), повышения физической активности (соответственно +9 и -3) и социальной активности (соответственно +8 и -7), улучшения показателей общего восприятия состояния здоровья (соответственно +10 и -3), ощущения улучшения состояния здоровья (соответственно +14 и -2) [11]. Исследователи из Internal Medicine Department, Cardarelli Hospital (Италия) проводили наблюдение в течение 2 лет за 3 молодыми пациентами с наследственным панкреатитом. Два года были разделены на четыре периода по шесть месяцев каждый. В 1-м и 3-м периодах пациенты получали только оральные анальгетики по требованию; во 2-м и 4-м периодах была добавлена пероральная антиоксидантная формула. Она содержала сульфаденозилметионин (800 мг в день), витамин C (180 мг в день), витамин E (30 мг в день), витамин А (2,4 мкг в день) и селен (75 мкг в день). Назначение комплекса привело к сокращению (p < 0,05) числа дней с болевым синдромом у всех 3 пациентов в течение обоих периодов лечения, причем потребление анальгетиков в эти периоды было более низким [20].
В плацебо-контролируемом двойном слепом индийском исследовании пациенты-мужчины (35 с алкогольным ХП и 92 с идиопатическим) были рандомизированы в группы, в которых они получали плацебо (n = 56) или антиоксидантный комплекс (n = 71), содержавший аскорбиновую кислоту, β-каротин, токоферол, метионин, селен в течение 6 месяцев. После 6 месяцев количество дней без БАС в месяц, сокращение числа таблеток анальгетиков в месяц были значительно выше в группе, получавшей комплекс, по сравнению с группой плацебо (7,4 ± 6,8 и 3,2 ± 4,0 соответственно; р < 0,001; 95 % доверительный интервал [ДИ] – 2,07 6,23); (10,5 ± 11,8 и 4,4 ± 5,8 соответственно; р = 0,001; 95 % ДИ – 2,65–9,65). Полное прекращение болевого синдрома зарегистрировано у 32 и 13 % пациентов соответственно (р = 0,009). Отмечено снижение уровня TBARS (3,5 ± -2,7 и 1,2 ± 2,7 нмоль/мл соответственно; р = 0,001; 95 % ДИ – 0,96–3,55) [10].
Полученные в вышеописанных исследованиях данные позволяют сделать вывод о дефиците антиоксидантных микронутриентов у больных ХП и, соответственно, положительном эффекте их дополнительного назначения, проявившемся повышением качества жизни, уменьшением выраженности БАС, улучшением антиоксидантной защиты и снижением маркеров тяжести ХП. Так, при внешнесекреторной недостаточности ПЖ назначение аскорбиновой, никотиновой кислот способствует нарастанию концентрации амилазы, трипсина и липазы в дуоденальном содержимом.
При тяжелой стеаторее, обусловленной поражением ПЖ с развитием экзокринной недостаточности, в целом при синдроме мальассимиляции различной этиологии проводят заместительную терапию витаминами A, D, Е, К, группы В, фолиевой кислотой и препаратами железа [21]. В рекомендациях по лечению метаболических нарушений при синдроме нарушенного всасывания включена схема коррекции витаминной недостаточности: 1-й день – витамины В12 и С, 2-й день – В6, 3-й день – В1 и витамин РР. Одновременно внутрь назначают рибофлавин по 0,01 г, фолиевую кислоту по 0,003 г 3 раза в день, витамин А по 1 драже 3 раза в день, витамин D3 в каплях по 10–20 капель в сутки. Никотинамид или никотиновую кислоту назначают внутримышечно: начинают с 0,5 мл, прибавляя по 0,5 мл по следующей схеме: 2 мл – 2 дня, 3 мл – 3 дня и т. д. до 5 мл, а затем дозу уменьшают в той же последовательности. Для лечения анемии – препараты железа по 2 мл внутримышечно на протяжении 10–12 дней, затем длительный прием препаратов железа внутрь [22].
ХП связан с различными этиологическими факторами и способствует увеличению риска развития рака ПЖ (РПЖ). За исключением наследственного панкреатита, у большинства пациентов с ХП не развивается РПЖ, несмотря на его повышенный риск. Это вызывает вопрос: есть ли дополнительные провоцирующие факторы, которые позволят нам определять, у каких пациентов с ХП возможно развитие РПЖ?
Нутритивный статус и РПЖ
Результаты ряда экспериментальных, клинико-биохимических и эпидемиологических исследований позволяют предположить, что наряду с обсуждаемыми механизмами канцерогенеза ПЖ определенную роль играют нарушения питания, являющиеся фактором риска развития панкреатита, а также скрытые и явные изменения нутритивного статуса, формирующиеся при ХП.
На модели химически-индуцированной аденокарциномы ПЖ у сирийского хомяка выявлено, что частота РПЖ была уменьшена при приеме витамина А до 64,3 % по сравнению с контрольной группой (100 %, р < 0,05) [23].
Витамин D – жирорастворимый, поэтому заболевания, связанные с синдромом мальдигестии жиров, в т. ч. с панкреатической экскреторной недостаточностью, характеризуются дефицитом витамина D [3–6]. Кроме того, нарушение статуса витамина D обусловлено использованием больными ХП редуцированного рациона, который содержит низкое количество жиров, что затрудняет усвоение витамина D, которое и без того снижено в рационе [24].
Выявлена значимая корреляция между степенью обострения ХП, показателями фекальной эластазы-1 и сниженным уровнем циркулирующего в крови витамина D3 [25]. В Чехии получены данные о том, что частота снижения статуса витамина D у больных ХП алкогольной этиологии достигает 77 %. В клинико-биохимическом исследовании, проведенном в ЦНИИ гастроэнтерологии Департамента здравоохранения Москвы, включившем 100 больных ХП, частота дефицита 25 (ОН)D3 среди больных ХП с экзокринной недостаточностью ПЖ составила 50 %, у пациентов без экзокринной недостаточности – 22 %. Частота дефицита 1,25 (ОН)2D3 составила 20 и 24 % соответственно [26].
Рецепторы к витамину D содержатся в 35 органах и тканях [24]. Причем на ПЖ витамин 1,25(OH)2D3 оказывает двойной эффект [27]:
- воздействуя на β-клетки, способствует увеличению синтеза и секреции инсулина;
- воздействуя на раковые клетки, в т. ч. аденокарциномы ПЖ, оказывает антипролиферативный эффект, способствует индукции дифференциации.
Соответственно, дефицит витамина D, часто встречающийся у больных ХП, по системе “порочного круга” может становиться одним из звеньев канцерогенеза ПЖ. В эксперименте доказано, что аналоги витамина D обладают ингибирующим действием на клетки опухоли ПЖ. В исследовании Department of Oncology, Gastroenterology, Endocrinology and Metabolism, St Georgecs Hospital Medical School (Великобритания) изучены эффекты 9-cis-ретиноевой кислоты (9cRA), аналогов витамина D EB1089 и CB1093 на линии клеток аденокарциномы ПЖ. Все вещества вызвали подавление роста in vivo, но аналоги витамина D были более мощными как при монотерапии, так и в комбинации с 9cRA. Апоптоз был вызван во всех трех линиях за счет 9cRA, принимая во внимание, что ни EB1089, ни CB1093 не имели этого эффекта, а добавление EB1089 или CB1093 к 9cRA приводило к существенному снижению апоптоза. Данные результаты свидетельствуют, что ретиноевая кислота и аналоги витамина D обладают ингибирующим действием на клетки опухоли ПЖ, но механизмы их действия различны [28].
Крайне интересными представляются данные 2 проспективных исследований, проведенных в США в когорте из 46 771 мужчины 40–75 лет с 1986 по 1990 г. в рамках the Health Professionals Follow-up Study и 75 427 женщин 38–65 лет с 1984 по 1990 г. в рамках the Nursesc Health Study. По сравнению с людьми с самым низким потреблением витамина D (менее 150 МЕ в день) относительный риск РПЖ был 0,78 (95 % ДИ – 0,59–1,01) при потреблении 150–299 МЕ в день, 0,57 (95 % ДИ – 0,40–0,83) при потреблении 300–449 МЕ в день, 0,56 (95 % ДИ 0,36 0,87) при потреблении 450–599 МЕ в день и 0,59 (95 % ДИ – 0,40–0,88) при потреблении 600 МЕ и более в день (р = 0,01). Эти ассоциации более сильные у мужчин, чем у женщин. Полученные данные укрепили мнение, что низкое потребление витамина D связано с увеличением риска РПЖ [29].
Неожиданные результаты были получены при проведении проспективного исследования случай–контроль в рамках когорты Alpha-Tocopherol, Beta-Carotene Cancer Prevention study, включившей финских мужчинкурильщиков в возрасте от 50 до 69 лет. Вопреки ожиданиям, лица с более высоким исходным статусом витамина D отличались повышенным риском РПЖ от лиц с более низким статусом. Так, в квинтиле с самым высоким уровнем витамина D относительный риск составил 2,2 по сравнению с лицами из квинтиля с самым низким уровнем витамина [30]. Необходимо отметить, что в данном исследовании в условиях выраженного оксидативного стресса обследуемые лица получали мегадозы α-токоферола и/или β-каротина, являющихся мощными антиоксидантами. В то же время их метаболиты, образующиеся в процессе антиоксидантной защиты, обладают прооксидантным, токсическим действием. При сбалансированном питании антиоксиданты единого витаминно-минерального комплекса восстанавливают эти метаболиты до исходных структур. При монотерапии мегадозами одного антиоксиданта развивается искусственный дефицит других коантиоксидантов, что в ряде случаев приводит к негативному для больного результату [1, 2]. Соответственно, при последующем анализе результатов наблюдения за лицами когорты Prostate, Lung, Colorectal, and Ovarian Screening Trial в том же научном центре не было выявлено положительной ассоциации концентрации витамина D в плазме крови и риска РПЖ у лиц в возрасте 55–74 лет. Более того, отмечено возрастание риска рака у лиц с низкой инсоляцией, которая является фактором дефицита витамина D [31]. Необходимо отметить, что в этом центре в рамках когорты Alpha-Tocopherol, Beta-Carotene Cancer Prevention study выявлено, что лица с наиболее высоким статусом α-токоферола имели низкий риск рака ПЖ по сравнению с мужчинами с низким уровнем витамина (отношение шансов [ОШ] – 0,52; 95 % ДИ – 0,34– 0,80; р = 0,03) [32].
Сотрудники Cancer Prevention Studies Branch, Division of Clinical Science, National Cancer Institute (США) провели исследование связи диеты с развитием РПЖ в упомянутой выше когорте Alpha-Tocopherol, BetaCarotene Cancer Prevention Study. Из 27 101 здорового мужчины-курильщика в возрасте 50–69 лет РПЖ развился у 157 за период в 13 лет – с 1985 до 1997 г. Риск развития РПЖ имел обратную связь с уровнем потребления фолатов (ОШ – 0,52; 95 % ДИ – 0,31–0,87; p = 0,05) [33].
Данная обратная ассоциация, возможно, также объясняется тем фактом, что фолаты являются компонентом единого витаминно-минерального комплекса организма и их высокое нутритивное потребление способствовало восстановлению α-токоферола и β-каротина из метаболитов.
Когорта Prostate, Lung, Colorectal, and Ovarian Cancer Screening Trial (PLCO) включила 51 988 мужчин и 57 187 женщин в возрасте 55 74 лет. Наблюдение за ними проводилось в течение 6,5 лет. У женщин в квартиле с самым высоким потреблением фолатов по сравнению с квартилем с самым низким потреблением отмечено значительное снижение риска РПЖ (ОШ — 0,47; 95 % ДИ – 0,23–0,94; р = 0,09). У женщин была выявлена значительная обратная зависимость общего потребления фолатов (с едой и в составе витаминных и витаминно-минеральных комплексов) и риска РПЖ (р = 0,04) [34]. Отсутствие ассоциации у мужчин, вероятно, объясняется большей, чем у женщин, ролью таких факторов риска, как курение, употребление алкоголя и жирной пищи, влияние которых нивелирует эффект высокого потребления фолатов.
В четырех больших проспективных когортных исследованиях, включивших 208 больных и 623 лиц контрольной группы, не были выявлены ассоциации содержания фолатов, витамина B6 в виде его наиболее активного метаболита пиридоксаль-5-фосфата, витамина B12 в плазме крови и риска рака ПЖ. Однако в подгруппе лиц, не принимавших дополнительно витаминные комплексы, выявлена умеренная обратная связь между уровнями фолатов, пиридоксаль-5-фосфата, витамина В12 и риском рака [35].
За 1984–1988 гг. сотрудники Department of Epidemiology, National Institute of Public Health and Environmental Protection (Нидерланды) совместно с International Agency for Research on Cancer провели исследование типа случай–контроль с целью изучения роли диеты в развитии экзокринной карциномы ПЖ. Полуколичественный анкетный опрос частоты потребления за год до установления диагноза проведен у 164 пациентов, в контрольную группу вошли 480 человек. Выявлена последовательная обратная ассоциация риска карциномы с ежедневным потреблением прошедших кулинарную обработку и свежих овощей, прежде всего крестоцветных. Среди респондентов, опрошенных непосредственно, составивших примерно половину группы, выявлена отчетливая обратная ассоциация РПЖ с потреблением бобовых, стручковых, помидоров, сыра, употребление которых ограничено при ХП, а также ферментированных изделий из молока. Обратные ассоциации с потреблением фруктов и витамина С были только у женщин [36].
Мета-анализ, включивший 4 исследования типа случай–контроль и 5 когортных исследований, выявил обратную ассоциацию потребления цитрусовых, ограниченного у больных ХП, и риска РПЖ. В целом ОШ для потребления цитрусовых составило 0,83 (95 % ДИ – 0,70–0,98), правда, с большой разнородностью результатов и более слабой ассоциацией в исследованиях случай–контроль [37].
На объединенной встрече Международной ассоциации панкреатологов и Японского панкреатологического общества, которая состоялась в Японии (Фукуока) в июле 2010 г., большой интерес вызвала проблемная лекция “Нутритивные стратегии в профилактике РПЖ”, прочитанная известным американским панкреатологом профессором V.L.W. Go [38]. По его данным, к факторам риска рака ПЖ относят генетическую предрасположенность (15 %), курение (25 %), ожирение (15 %), диетические факторы (35 %), ХП и др. (10 %). Следовательно, рациональное питание, возможно, имеет значение для профилактики РПЖ.
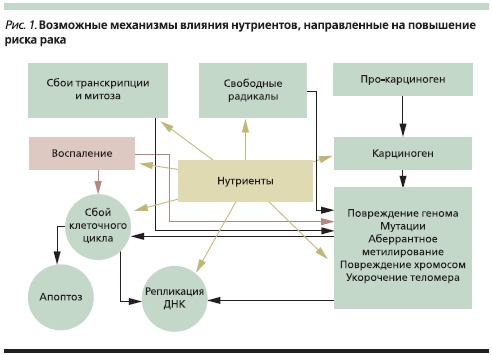
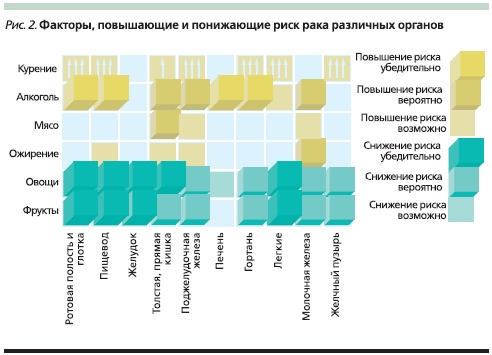
Нутриенты могут влиять на риск рака несколькими путями (рис. 1). В отношении РПЖ доказано, что его риск повышен у злоупотребляющих алкоголем и курящих и понижен у людей, потребляющих большое количество овощей и фруктов (рис. 2). Особую роль в профилактике РПЖ отводят овощам семейства крестоцветных. Так, в когортном исследовании, проведенном в Швеции, в которое вошло около 82 тыс. мужчин и женщин, была показана обратная зависимость между потреблением этих овощей и риском РПЖ. Однако значительная часть представителей крестоцветных (горчица, редис, хрен, японская редька, брюква, репа) ограничена в применении больными ХП. Проведено 2 многоцентровых исследования с участием 183 518 и 424 978 человек, по результатам которых доказана роль кверцетина, кемпферола, мирицитина в снижении риска РПЖ. Оба исследования продемонстрировали обратную зависимость между потреблением продуктов, богатых этими флавонолами, и риском РПЖ, особенно среди курильщиков.
Заместительная полиферментная терапия
Постулируется, что заместительная полиферментная терапия является ведущим методом уменьшения проявлений мальдигестии и мальабсорбции (учащение стула, лиентерея, стеаторея, метеоризм, боли в животе), а также многочисленных проявлений, обусловленных недостатком поступления пластических веществ, витаминов, электролитов. Естественно, эффектом данной терапии являются улучшение течения ХП, профилактика его обострений и канцерогенеза ПЖ. Причем положительное влияние на течение ХП оказывается за счет не только уменьшения проявлений мальдигестии и мальабсорбции, но и возможности расширения рациона питания, уменьшения ситофобии из-за купирования БАС.
Однако имеются различия в рекомендациях о тактике проведения полиферментной терапии. Существует мнение о достаточном назначении любого препарата панкреатина в дозах 6000–10000 ЕД липазы на прием пищи. При этом ведущие отечественные и зарубежные работы по панкреатологии говорят о том, что лечение экзокринной панкреатической недостаточности включает не только заместительную ферментную терапию, но и специфическую нутритивную коррекцию, которая складывается из рекомендаций общего характера: высокого содержания белка в рационе (до 150 г/сут), снижения на 50 % от нормы содержания жиров в пище. Рекомендуются преимущественно среднецепочечные триглицериды, моно- и полиненасыщенные жирные кислоты, которые легче перевариваются панкреатической липазой и всасыоксидантные витаминно-минеральные комплексы с достаточным содержанием жирорастворимых витаминов.
На первый взгляд не вызывает сомнения необходимость назначения препаратов 4-го поколения (энтеросолюбильные минимикросферы). Однако таблетки панкреатина различных производителей в России продолжают рекомендовать и, что особенно печально, порой назначают не только чистый панкреатин, но и препараты с компонентами желчи. Если опираться на экспериментальные исследования, показавшие зависимость размера частиц от скорости их эвакуации из желудка, особенно одновременно с пищей, становится понятно – крупные таблетки (больше 2 мм в диаметре) через пилорический канал проходят достаточно медленно, чаще вовсе не проходят целиком. Большая часть из них разрушается и только в виде фрагментов попадает в двенадцатиперстную кишку. Энтеросолюбильная оболочка, покрывающая таблетки крупного размера, еще больше задерживает нахождение таблеток в желудке, поскольку фрагментирование таблеток возможно только при рН выше 5, а чаще 6. В этих условиях говорить об одновременной эвакуации таблеток и пищи вообще не приходится. Задержка таблеток в желудке, позднее – их фрагментирование способствуют частичной инактивации компонентов препарата (панкреатические липаза и протеазы необратимо инактивируются при рН ниже 3 и 4 соответственно), достигающей 80 % [3, 4, 21, 39].
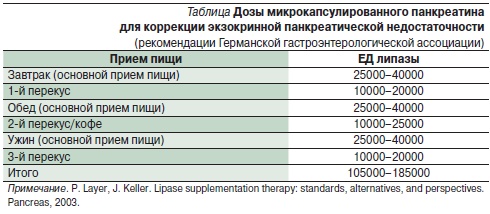
Другой причиной, объясняющей их практическую непригодность, является низкое содержание липазы в 1 таблетке, что определяет необходимость применения не менее 5–7 таблеток на прием пищи, и это без учета того, что препарат частично инактивируется в желудке при “разваливании” крупной таблетки – так, что потенциальная доза выше еще минимум в 2 раза. Поэтому только современные полиферментные препараты с активностью 25000–40000 ЕД липазы (Креон) способны полностью заместить экзокринную функцию ПЖ при ХП с внешнесекреторной недостаточностью (см. таблицу).
Полиферментные препараты назначают пожизненно, однако вариабельность дозы зависит от соблюдения больным диеты. При выборе дозы панкреатина необходимо руководствоваться данными активности фекальной эластазы, коррекция дозы осуществляется по клиническим данным (купирование диареи и стеатореи, метеоризма, стабилизация и набор веса), лабораторным данным (снижение содержания жира в стуле, уменьшение объема фекалий, исчезновение нейтрального жира при микроскопии), результатам дыхательных изотопных исследований с мечеными триглицеридами или крахмалом [3, 4, 21, 39, 40].
Только применение более современных препаратов, сочетающих кислотоустойчивость, одновременный с химусом пилородуоденальный транзит, быструю активацию, высокое содержание протеаз, является залогом успешного лечения и улучшения качества жизни больных. Всеми проведенными исследованиями, опубликованными до настоящего времени, доказано, что наибольшей эффективностью при лечении панкреатической недостаточности характеризуются только препараты 4-го поколения (Креон и аналоги), что в значительной степени определяет целесообразность использования Креона для купирования экзокринной панкреатической недостаточности. Причем по закону обратной связи данный эффект способствует улучшению течения ХП, профилактике утяжеления его течения и, вероятно, профилактике канцерогенеза ПЖ.
Информация об авторах:
Маев Игорь Вениаминович – доктор медицинских наук, профессор, заведующий кафедрой
пропедевтики внутренних болезней и гастроэнтерологии МГМСУ;
Казюлин Александр – доктор медицинских наук, профессор кафедры пропедевтики
внутренних болезней и гастроэнтерологии МГМСУ.
Тел. 8 (499) 181-17-54, e-mail: aldoc1@rambler.ru, proped@mail.ru;
Баранская Елена Константиновна – доктор медицинских наук, профессор кафедры пропедевтики внутренних
болезней ГОУ ВПО “Первый МГМУ им. И.М.Сеченова” Минздравсоцразвития РФ, УКБ № 2;
Кучерявый Юрий Александрович – кандидат медицинских наук, доцент кафедры
пропедевтики внутренних болезней и гастроэнтерологии МГМСУ;
Москалева Анна Борисовна – врач отделения гастроэнтерологии НУЗ ЦКБ № 2 им. Н.А. Семашко ОАО РЖД



