Введение
Рак толстой кишки (РТК) занимает лидирующие позиции по заболеваемости и смертности от злокачественных опухолей. В 2007 г. в России было зарегистрировано 54 738 новых случаев РТК, от которого умерли 37 111 человек [1]. На момент постановки диагноза рак ободочной кишки I–III стадий выявляют у 67,6 % больных (I–II стадий – 35,5 %, III стадии – 32,1 %). Этим пациентам показано хирургическое лечение. Целью адъювантной химиотерапии (АХТ) в данной ситуации является уничтожение микрометастазов и снижение риска развития местного рецидива. Показано, что послеоперационная ХТ улучшает показатели безрецидивной и общей выживаемости у больных раком ободочной кишки III стадии и она рекомендована в качестве стандартного лечения [2, 3]. При раке ободочной кишки II стадии АХТ позволяет улучшать показатели выживаемости только у пациентов, имеющих факторы риска прогрессирования болезни [4, 5]. Решение о выборе схем и начале проведения АХТ должно основываться на наличии у пациентов факторов риска прогрессирования болезни, эффективности и потенциальных осложнениях планируемой терапии, индивидуальных особенностях самого пациента (возраст, сопутствующая патология). В данном обзоре мы рассмотрим применение АХТ при раке ободочной кишки, данные по возможности индивидуализации терапии у больных с ранним раком ободочной кишки с учетом особенностей пациента и опухоли.
Сроки начала АХТ
В теории начинать АХТ необходимо как можно раньше после операции. Однако на практике на этот срок влияют два основных фактора: сроки восстановления после операции и время, которое нужно затратить пациенту на то, чтобы попасть от хирурга к химиотерапевту. Ранее считали, что лечение нужно начинать не позднее 3 месяцев с момента операции, но доказательств данного положения не было. На конференции ASCO GI (American Society of Clinical Oncology’s Gastrointestinal Cancers Symposium) 2011 было доложено о результатах мета-анализа результатов исследований, посвященных определению сроков начала АХТ. J.J. Biagi и соавт. провели систематический обзор литературы, объединив данные 9 исследований, включивших 14 357 пациентов. Было показано, что с увеличением интервала времени от операции положительный эффект АХТ уменьшается. Так, если пациенту в возрасте 65 лет в хорошем состоянии с РТК III стадии начать химиотерапию (с включением фторпиримидинов) в течение 4 недель после операции, риск смерти снижается на 15 %, в сроки от 4 до 8 недель – на 10 %, а от 12 до 16 недель – только на 5 %. При начале терапии позже 16 недель выигрыша от применения АХТ не наблюдается. Авторы делают вывод, что проведение АХТ будет полезно только в течение 12 недель (3 месяца) после операции [6]. Недостатком мета-анализа можно считать то, что объединены данные в основном нерандомизированных и ретроспективных исследований, в которых в качестве АХТ применяли фторурацил (ФУ). Положительным моментом исследования является подтверждение постулата, что чем раньше начинать АХТ, тем лучше для пациента.
Адъювантная химиотерапия при раке ободочной кишки III стадии
Фторпиримидины
ФУ был и остается основой современной химиотерапии больных колоректальным раком. Еще с конца 1990-х гг. появились результаты первых исследований, показавших достоверное снижение частоты рецидивов и риска смерти на 16 % при применении струйного режима введения фторурацила с левамизолом в течение одного года [7]. Позже была показана равная эффективность более короткого курса АХТ (6 месяцев) при комбинации ФУ с кальцием фолинатом (Лейковорин – ЛВ) [8]. С конца 1990-х гг. возрос интерес к длительным инфузиям высоких доз ФУ, при схожей активности обладавших существенно меньшей токсичностью по сравнению со струйными режимами [10–12].
Пролонгированное введение ФУ требует постоянного доступа в центральную вену и наличия специальных устройств для постоянной инфузии препарата, что ассоциируется с дополнительным риском развития таких осложнений, как венозный тромбоз, инфекции. В связи с этим были разработаны пероральные формы фторпиримидинов. Капецитабин (Кселода) – пероральный препарат класса фторпиримидинов, активирующийся в клетках опухоли. При приеме капецитабина в клетках опухоли создается концентрация ФУ, более высокая, чем при длительных внутривенных инфузиях. Это предопределило широкое использование пероральных фторпиримидинов в клинической практике. Избирательность действия капецитабина в опухоли основана на более высокой, чем в нормальных тканях, активности фермента тимидинфосфорилазы [13]. Благодаря карбаматной структуре капецитабин быстро всасывается в неизменном виде. Первые этапы трансформации препарата проходят в печени и опухолевой ткани, где последовательно, под действием ферментов карбоксилэстеразы и цитидиндезаминазы происходит образование промежуточного метаболита, не обладающего цитотоксическим действием. На заключительном этапе тимидинфосфорилаза, обладающая высокой активностью в тканях опухоли, способствует превращению промежуточного метаболита в ФУ. Наиболее часто используется капецитабин в дозе 1250 мг/м2 – 2 раза в сутки в 1–14-й дни каждые 3 недели. При применении капецитабина в комбинированных режимах доза препарата снижается до 1000 мг/м2 2 раза в сутки в 1–14-й дни каждые 3 недели. В исследовании X-ACT (Xeloda in Adjuvant Colon Cancer Therapy) пациенты с III стадией были рандомизированы в две группы: капецитабин 2500 мг/м2 в сутки в 1–14-й дни и болюсное введение ФУ/ ЛВ (схема Мейо). При медиане наблюдения 3,8 года показатели выживаемости без признаков болезни не различались (3-летняя выживаемость – 64,2 и 60,6 % соответственно; р = 0,87). Однако наблюдалась тенденция к значимому различию в показателях общей выживаемости (3-летняя общая выживаемость 81,3 и 77,6 % соответственно; р = 0,07). По сравнению с болюсным введением ФУ/ЛВ при терапии капецитабином реже развивались такие побочные эффекты, как диарея, стоматит, алопеция, чаще – ладонно-подошвенный синдром [14]. В исследовании NSABP C-06 (National surgical adjuvant breast and bowel project C–06) применение тегафура (другой пероральной формы фторпиримидинов) совместно с кальцием фолинатом авторы показали результаты, аналогичные полученным в предыдущей работе [15].
Таким образом, пероральные формы фторпиримидинов являются равноэффективной и более удобной альтернативой инфузионным режимам в качестве АХТ РТК.
Оксалиплатин
Оксалиплатин относится к третьему поколению производных платины. В основе механизма его действия лежит способность образовывать внутри- и межнитевые сшивки ДНК, что прекращает репликацию генома. Препарат практически лишен почечной и гематологической токсичности, однако обладает специфической нейротоксичностью – развитием периферической невропатии [12], которая носит кумулятивный характер и проявляется в виде нарастающих парестезий и дизестезий, способных развиваться на холоде (“холодовые реакции”). У большинства пациентов невропатии носят преходящий характер с постепенным уменьшением проявлений токсичности после отмены оксалиплатина. C учетом синергизма двух препаратов (оксалиплатина и производного фторпиримидинов) [16] в клинике наиболее часто используют режимы XELOX, FOLFOX, FLOX.
В 2004 г. были опубликованы результаты первого рандомизированного исследования III фазы по сравнению режима FOLFOX-4 и инфузионного режима введения ФУ/ЛВ (схема de Gramont) у пациентов с РТК II–III стадий в адъювантном режиме (исследование MOSAIC – Multicenter International Study of Oxaliplatin/5FULV in the Adjuvant Treatment of Colon Cancer). В исследование были включены 2246 больных. Были достигнуты достоверные различия в показателях 3-летней выживаемости без признаков болезни (отношение рисков [ОР] = 0,77; p = 0,002). Добавление оксалиплатина снизило риск рецидива на 23 % [17]. В 2009 г. авторы обновили результаты исследования (см. таблицу), показав, что 6-летняя общая выживаемость также достоверно лучше в группе с FOLFOX (ОР = 0,8; p = 0,03) [18]. Подгрупповой анализ выявил, что достоверное улучшение выживаемости без признаков болезни и общей выживаемости наблюдается у больных только с III стадией болезни.
Таблица. Результаты исследований по применению схем с оксалиплатином в адъювантном режиме у больных РТК.
Положительный эффект от добавления оксалиплатина к болюсному режиму введения ФУ (FLOX против схемы Roswell Park) в адъюванте был подтвержден в исследовании NSABP C-07 (National Surgical Adjuvant Breast and Bowel Project C-07) [19]. Риск развития рецидива при добавлении оксалиплатина к струйному режиму введения ФУ снизился на 21 %. Различий в общей выживаемости не выявлено. При подгрупповом анализе улучшение показателей выживаемости без признаков болезни наблюдалось только у пациентов с III стадией РТК. При сравнении обоих исследований необходимо отметить, что переносимость режима FOLFOX была значительно лучше, чем FLOX, т. к. на фоне последнего отмечена более высокая частота диарей III– IV степеней (10,8 против 38,0 %), что в 6,9 % случаев привело к развитию энтеропатического синдрома (повреждению стенки кишки и развитию сепсиса). Достоверно чаще данное осложнение наблюдалось у лиц старше 60 лет и у женщин. В то же время частота и выраженность полиневропатий, возникших на фоне обоих режимов, существенно не различались и они характеризовались обратимостью. Так, если по завершении шести месяцев терапии практически у каждого пациента развилось данное осложнение, то через 2 года полиневропатии I–II степеней отмечены лишь у 10–15 % больных.
После того как была доказана эффективность капецитабина в адъювантном режиме, инициировано исследование NO 16968, где сравнивались схемы XELOX и режимы Roswell Park/Мейо. Достигнуты достоверные различия в 3-летних показателях выживаемости без признаков болезни (71 против 67 %; см. таблицу).
Сравнительный анализ этих трех исследований четко показывает достоверный выигрыш от добавления оксалиплатина к фторпиримидинам, а также схожую эффективность всех трех режимов химиотерапии. Все это сделало комбинации с включением оксалиплатина стандартом АХТ больных РТК III стадии.
Иринотекан
Иринотекан – полусинтетическое производное алкалоида камптотецина. В основе механизма действия препарата лежит блок фермента топоизомеразы I [12], которая участвует в процессе репликации и транскрипции ДНК, разворачивая для этого на время двухнитевую спираль ДНК. Связываясь с ферментом, иринотекан стабилизирует ДНК в развернутом состоянии, что приводит к ее разрывам.
У больных метастатическим РТК наиболее популярный режим с иринотеканом FOLFIRI обладает схожей с FOLFOX эффективностью. Однако в качестве АХТ все три исследования с иринотеканом потерпели фиаско. Режимы со струйным (IFL) [21] или инфузионным (FOLFIRI) введением ФУ [22, 23] не показали улучшения выживаемости без прогрессирования по сравнению с монотерапией ФУ. Кроме того, экспериментальные режимы характеризовались большей токсичностью. По этим причинам режимы с иринотеканом не могут рекомендоваться к применению в качестве АХТ.
Таргетная терапия
Антиангиогенная терапия
Бевацизумаб – моноклональное антитело, блокирующее фактор роста эндотелия сосудов. На экспериментальных моделях показано, что бевацизумаб приводит к быстрому снижению плотности микрососудистого русла; нормализует структурно и функционально измененные сосуды, что улучшает проникновение химиопрепаратов в опухоль; ингибирует механизмы неоваскуляризации [24–26]. Значение бевацизумаба в первой линии терапии метастатического колоректального рака доказано рандомизированных исследованиях. Естественно, что следующим этапом были инициированы исследования по изучению эффективности бевацизумаба в адъювантной терапии РТК. В исследование NSABP С-08 были включены более 2600 больных РТК II–III стадий. Сравнивали режимы FOLFOX ± бевацизумаб. При медиане наблюдения 36 месяцев не получено достоверного повышения выживаемости без признаков болезни (75,5 % в группе без бевацизумаба против 77,4 % в группе с бевацизумабом; р = 0,15; ОР = 0,85) [27]. В другом исследовании со схожим дизайном (AVANT) получены аналогичные результаты [28]. В настоящее время проводится исследование QUASAR-2 , в котором изучают АХТ с добавлением бевацизумаба к капецитабину.
Таким образом, вопрос о включении бевацизумаба в АХТ больных РТК в настоящее время остается открытым.
Ингибиторы рецептора эпидермального фактора роста
Цетуксимаб – химерическое моноклональное антитело к наружному домену EGFR (Epidermal Growth Factor Receptor). Отмечена корреляция между эффективностью терапии анти-EGFR антителами и наличием мутации в гене KRAS (чаще в экзонах 12 или 13). Активность препаратов реализуется только в группе больных, не имеющих мутации [29, 30].
В 2010 г. на ASCO были доложены результаты исследования по сравнению адъювантного лечения режимами FOLFOX ± цетуксимаб больных РТК II стадии с диким типом гена KRAS в опухоли. При промежуточном анализе результатов терапии 1624 пациента без мутации KRAS различий в показателях 3-летней выживаемости без признаков болезни получено не было (ОР = 1,18; p = 0,33) [31]. Более того, в группе больных старше 70 лет добавление цетуксимаба даже ухудшило 3-летнюю общую выживаемость (83,9 против 75,4 %), в связи с чем исследование было досрочно прекращено. Наиболее вероятной причиной негативных результатов была большая токсичность, сопровождавшая применение цетуксимаба (диарея), что приводило к снижению числа курсов АХТ. Недавно завершено исследование PETACC-8 с аналогичным дизайном. Результаты пока не опубликованы.
Таким образом, несмотря на положительный опыт применения моноклональных антител при метастатическом колоректальном раке, в качестве АХТ они оказались неэффективными.
Адъювантная терапия при раке толстой кишки II стадии
Если необходимость применения АХТ при III стадии уже ни у кого не вызывает сомнения, то ее роль при II стадии болезни остается неопределенной. При II стадии 60–70 % пациентов излечиваются благодаря одной операции, у 15–20 % рецидив разовьется независимо от терапии и выигрыш от АХТ существенно снижается [32]. Так, в исследовании QUASAR применение ФУ/ЛВ больными РТК II стадии привело к увеличению 5-летней общей выживаемости лишь на 2,9 % [33]. Эти данные указывают на необходимость выделения группы больных с высоким риском рецидива и прогрессирования, а также факторов, предсказывающих эффективность АХТ (см. рисунок).
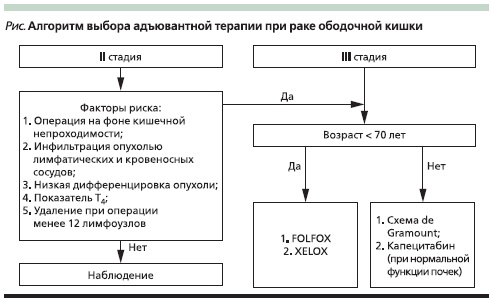
В настоящее время выделены следующие клинические факторы при II стадии болезни, увеличивающие риск рецидива болезни:
- операция на фоне кишечной непроходимости;
- инфильтрация опухолью лимфатических и кровеносных сосудов;
- низкая дифференцировка опухоли;
- показатель Т4;
- удаление при операции менее 12 лимфоузлов.
Анализ исследования MOSAIC показал, что выигрыш от АХТ с включением оксалиплатина у больных II стадии высокого риска соответствует таковому при III стадии (разница в 5-летней безрецидивной выживаемости составила 7,2 %; ОР = 0,74; 95 % доверительный интервал [ДИ] – 0,52–1,08). В то же время у остальных больных со II стадией (с “низким” риском) она не различалась [17, 18]. Улучшение безрецидивной выживаемости не привело к увеличению общей выживаемости больных со II стадией как с “низким” (ОР = 1,0), так и с “высоким” риском (ОР = 0,94). По-видимому, это связано прежде всего с недостаточным числом пациентов со II стадией “высокого” риска.
Кроме клинических факторов, позволяющих выбирать кандидатов для АХТ среди пациентов со II стадией, в последнее время все большее значение начинают придавать молекулярным прогностическим факторам, особенно наличию микросателлитной нестабильности (MSI) и потере гетерозиготности длинного плеча 18-й хромосомы (18qLOH). При РТК II стадии MSI выявляется в 16–22 % случаев. Эти опухоли характеризуются благоприятным прогнозом, и добавление АХТ фторпиримидинами не улучшает результатов лечения [34–37]. До сих пор остается открытым вопрос об эффективности терапии на основе оксалиплатина у этих пациентов. По данным ретроспективного наблюдения, потеря гетерозиготности длинного плеча 18-й хромосомы была ассоциирована с увеличением числа рецидивов при II стадии [38]. В настоящее время эти данные подтверждаются в проспективном исследовании Е5202, в котором на основе MSI и 18qLOH выделяют пациентов с высоким риском рецидива при II стадии болезни, которым в дальнейшем будет проводиться химиотерапия FOLFOX с бевацизумабом.
Адъювантная химиотерапия у лиц пожилого возраста
V. Sundararajan и соавт. сообщили о результатах анализа данных базы SEER, в который были включены 4768 больных старше 65 лет. Половине (52 %) пациентов проводили АХТ ФУ. Больные, которые получали адъювантное лечение, имели достоверно более высокие показатели общей выживаемости (ОР = 0,66) [39]. Таким образом, пожилые пациенты выигрывают от проведения АХТ так же, как и лица более молодого возраста. К аналогичному выводу пришли и J.M. Jessup и соавт., которые провели ретроспективный анализ данных 85 934 больных РТК III стадии [40]. Однако около 30 % пожилых больных РТК III стадии, которым была начата АХТ, прекращают лечение, не завершив его. Смертность среди таких пациентов в 2 раза выше, чем среди тех, кому удалось провести 7 курсов АХТ [41].
В исследовании X-ACT проведен подгрупповой анализ в соответствии с возрастом (менее и более 65 лет). Отмечено, что токсичность капецитабина у пожилых пациентов находится в зависимости от функции их почек. При многофакторном анализе выявлено, что возраст является значимым фактором, влияющим на выживаемость больных [14]. Анализ результатов АХТ 245 пациентов пожилого возраста из базы данных Австралии выявил, что применение капецитабина ассоциировалось с тенденцией к большей частоте токсических реакций [42]. Объединенный анализ данных базы ACCENT был посвящен сравнению результатов АХТ 10 499 больных моложе 70 и 2170 – старше 70 лет со II–III стадиями болезни, принимавших участие в 6 рандомизированных исследованиях. Три четверти больных старше 70 лет имели III стадию болезни. Безрецидивная выживаемость, выживаемость без признаков болезни, общая выживаемость были достоверно выше в экспериментальной группе по сравнению с контрольной у лиц моложе 70, но не старше 70 лет. Эти результаты касаются всех экспериментальных режимов: с оксалиплатином, иринотеканом или пероральными фторпиримидинами. Авторы пришли к выводу, что больные пожилого возраста (старше 70 лет) не выигрывают в общей выживаемости (ОР = 0,86; 95 % ДИ – 0,98–1,32) от применения в адъювантном режиме комбинированных схем с оксалиплатином и/или пероральными фторпиримидинами [43]. Отметим также, что в адъювантном исследовании FOLFOX ± цетуксимаб отмечена более высокая смертность среди лиц старше 70 лет, в связи с чем был приостановлен их набор в данное исследование. Аналогичная тенденция имела место и в исследовании NSABP C-08 (FOLFOX ± бевацизумаб) [44].
Таким образом, у лиц пожилого возраста с РТК III стадии рекомендуется применять инфузионные режимы введения ФУ/ЛВ (менее токсичные по сравнению с болюсными). Другие лечебные опции: капецитабин в монорежиме, FOLFOX, XELOX, по эффективности не уступают ФУ/ЛВ в адъюванте у лиц старше 70 лет.
Капецитабин можно назначать пожилым при адекватной функции почек. Таблетированная форма капецитабина позволяет больному проходить лечение в комфортных домашних условиях.
Информация об авторах:
Федянин Михаил Юрьевич – кандидат медицинских наук, врач-онколог отделения клинической
фармакологии и химиотерапии РОНЦ им. Н.Н. Блохина РАМН.
E-mail: fedianinmu@mail.ru;
Трякин Алексей Александрович – кандидат медицинских наук, старший научный сотрудник отделения клиническойфармакологии и химиотерапии РОНЦ им. Н.Н. Блохина РАМН;
Тюляндин Сергей Алексеевич – доктор медицинских наук, профессор, заведующий отделением клинической фармакологии и химиотерапииРОНЦ им. Н.Н. Блохина РАМН, заместитель директора по научной работе РОНЦ им. Н.Н. Блохина РАМН