Синдром поликистозных яичников (СПКЯ) – самое частое эндокринное заболевание у женщин репродуктивного возраста. Фундаментальный патогенетический дефект СПКЯ до настоящего времени не доказан [1–3]. Клинический синдром характеризуется нарушением менструальной функции по типу олигоопсоменореи или аменореи, ановуляторной инфертильностью или субфертильностью на фоне хронической ановуляции и неопухолевой гиперандрогенией различной степени выраженности. Для диагностики СПКЯ может быть использован метод ультразвукового исследования яичников, который позволяет выявить в них характерные морфологические изменения в виде мелких фолликулов менее 10 мм в диаметре, обычно расположенных по периферии центральной, увеличенной в объеме стромы [4].
У большинства женщин с СПКЯ выявляется инсулинорезистентность (ИР) различной степени выраженности [5–13]. В патогенезе СПКЯ большую роль играют нарушения как секреции инсулина, так и его действия на ткани [14–20]. Нормальная толерантность к глюкозе обусловлена соотношением инсулинзависимых и инсулиннезависимых механизмов. Инсулинзависимые механизмы обеспечивают подавление продукции глюкозы и стимуляцию утилизации глюкозы периферическими тканями. Регуляция этих процессов осуществляется β-клетками, секретирующими инсулин, и инсулинчувствительностью тканей [21]. Кроме того, доступность инсулина для основных тканей-мишеней (жировой и мышечной) частично зависит от скорости элиминации инсулина из кровеносного русла почками и печенью. Нарушения секреции инсулина и чувствительности к нему рассматриваются как факторы риска развития сахарного диабета типа 2 (СД2) [22, 23].
В настоящее время имеются только единичные исследования, посвященные прямой оценке функции β-клеток у лиц без СД. Стандартным методом оценки функции β-клеток является метод гипергликемического клэмпа [24, 25]. Из-за дороговизны и трудоемкости прямых методов оценки чувствительности к инсулину и функции β-клеток использование их в широкой практике ограничено. В настоящее время для оценки данных параметров используют расчетные индексы на базе орального глюкозотолерантного теста (ОГТТ).
Понимание значения метаболических нарушений в патогенезе СПКЯ предопределило новые стратегии в лечении данного синдрома [26]. Однако доступность, цена и безопасность лечения не всегда дают возможность достижения поставленной цели [26–31]. Терапевтическая тактика при СПКЯ основывается на выраженности клинической картины, этиологических моментах, мотивации женщины, при этом необходимо учитывать планы пациентки в отношении беременности в данный период жизни, т. е. план ведения пациентки должен учитывать медицинские и личностные особенности больной для повышения ее приверженности лечению. Если женщина хочет зачать и родить ребенка, врач должен быть твердо уверен, что причиной наблюдаемых нарушений служит СПКЯ. В тех случаях, когда беременность не желанна, лечение направлено, во-первых, на устранение гирсутизма, акне, олигоаменореи [32–35], а во-вторых, на снижение факторов риска развития заболеваний, ассоциированных с СПКЯ, особенно СД2 и ишемической болезни сердца [36, 37]. Уменьшение ИР возможно достигнуть путем снижения массы тела у женщин с ожирением, что на практике осуществить очень сложно, кроме того, не решает проблемы СПКЯ, обусловленного ИР у худых женщин с этим синдромом [38–44].
В последнее время обсуждается и другой подход к лечению ИР у женщин с СПКЯ, который подразумевает использование сенситайзеров инсулина [45–49]. К этому классу веществ относятся тиазолидиндионы и бигуаниды. Понимание того, что гиперинсулинемия является ключевым компонентом патогенеза СПКЯ, дало толчок к развитию новых стратегий лечения женщин с этим заболеванием, однако дополнительные исследования по использованию препаратов, воздействующих на гиперинсулинемию, безусловно необходимы перед официальными рекомендациями по их использованию в клинической практике. Метформин, способствующий уменьшению ИР, так же как и тиазолидиндионы, имеет противопоказания и побочные эффекты. Существуют больные с индивидуальной непереносимостью метформина. Таурин, являясь естественным продуктом обмена серусодержащих аминокислот, обладает многообразными метаболическими эффектами: влияет на кальцийзависимые процессы в клетке и протеинкиназу С, а через эти механизмы оказывает модулирующее влияние на метаболизм углеводов.
Действие отечественного препарата Дибикор (таурин; Пик-Фарма, Россия) реализуется через физиологические и биохимические эффекты таурина, который помимо описанных механизмов влияет и на фосфолипидный состав мембран. При ИР меняется жесткость мембраны клеток вследствие нарушения соотношения холестерина (ХС) и текучесть клеточных мембран, воздействуя как на содержание липидов, так и на ХС путем коррекции уровня внутриклеточного кальция. Таурин имеет сродство к рецепторам инсулина и может модулировать уровни глюкозы, но при этом не изменяет исходно нормальную гликемию. Возрастающий интерес к препарату Дибикор обусловлен его уни-
кальными свойствами, которые могут быть реализованы при лечении метаболического синдрома и ассоциированных заболеваний, в т. ч. и СПКЯ.
Наша гипотеза постулирует, что дисфункция β-клеток, наследуемая девочками от родителей с метаболическим синдромом или СД2 (в обоих случаях имеется генетически обусловленная ИР), является фактором, способствующим появлению “аддитивной гиперинсулинемии”, что в пубертатном возрасте способствует формированию поликистозных яичников, в репродуктивный период – ановуляторной инфертильности и в постменопаузальном периоде – таких ассоциированных заболеваний, как ишемическая болезнь сердца, инфаркт миокарда, артериальная гипертензия и СД2. Метаболические нарушения способствуют возникновению ановулятороной инфертильности у молодых женщин. Дибикор, модулируя углеводный метаболизм, позволит приблизить секрецию инсулина к физиологическому уровню, что может положительно сказаться на репродуктивной функции.
Клинические проявления СПКЯ развиваются у женщин, имеющих, вероятно, генетическую предрасположенность к развитию поликистозных яичников и дефектам стероидогенеза. Основным внешним фактором, способствующим появлению функциональной гиперандрогении, яичниковой, надпочечниковой или смешанной и овариальной дисфункции является хроническая гиперинсулинемия на фоне сниженной чувствительности к инсулину и дисфункции β-клеток и у худых, и у полных женщин с СПКЯ. Эндокринные проявления СПКЯ в виде сочетания различных клинических фенотипов овариальной дисфункции и метаболических нарушений развиваются в результате воздействия внешних факторов и генетической предрасположенности к дисфункции β-клеток при семейном анамнезе СД2. Снижению чувствительности к инсулину способствуют ожирение или абдоминальная аккумуляция жира, дислипидемия и возраст. Возникновение СПКЯ-ассоциированных нарушений на фоне дисфункции β-клеток в виде дислипидемии или интолерантности к глюкозе усугубляет снижение инсулинчувствительности и овариальную дисфункцию у молодых женщин с СПКЯ. Развитие атерогенных фенотипов дислипидемии и нарушение инсулинопосредованной утилизации глюкозы у молодых женщин с СПКЯ ухудшают прогноз восстановления овариальной функции и увеличивают риск возможной преждевременной смерти на фоне сердечно-сосудистых заболеваний и интолерантности к глюкозе, а их своевременная коррекция необходима как для улучшения репродуктивной функции, так и для увеличения продолжительности жизни.
Цель работы: определить возможности использования Дибикора для коррекции метаболических нарушений и улучшения репродуктивной функции у женщин с СПКЯ.
Материал и методы
Сравнительное рандомизированное исследование выполнено на базе Первой городской клинической больницы СМП им. Е.Е. Волосевич (рис. 1).
Рисунок 1. Дизайн исследования.
В исследование была рандомизирована 51 женщина. Критериями включения являлись: подтверждение диагноза СПКЯ на основании проявлений функциональной гипоталамической аменореи (ФГА) и ановуляторных менструальных циклов (олиго/аменореи) при исключении других возможных причин этих нарушений; подписанное информированное согласие на участие в исследовании; возраст 18–35 лет. Критериями исключения были: прием оральных контрацептивов; любая медикаментозная терапия по поводу острых или хронических заболеваний; наличие тяжелых соматических болезней, требующих постоянной медикаментозной терапии; а также интолерантность к глюкозе, имевшаяся до включения в исследование. Клинико-лабораторные показатели включенных в исследование женщин представлены в табл.1.
Таблица 1. Клинико-лабораторные характеристики пациенток с СПКЯ.
Обработка данных выполнена в статистическом пакете “SPSS, версия 13”. Сначала по критерию Колмогорова–Смирнова выборки были проверены на нормальность. Распределение большинства показателей не было нормальным. Затем была вычислена описательная статистика по всем числовым показателям с определением средних величин, дисперсии, максимального и минимального значений, среднеквадратических отклонений, эксцесса и асимметрии, стандартных ошибок. Для нормально распределенных показателей достоверность различий средних значений определялась с использованием t-критерия Стьюдента для парных сравнений независимых выборок. Для прочих показателей использовались непараметрические критерии Уилкоксона и Манна–Уитни. Для показателей, измеренных в различные моменты времени, проведены парные сравнения по критерию Уилкоксона для связанных выборок.
Результаты и обсуждение
Как следует из представленных в табл. 1 данных, диагноз у всех женщин соответствовал таковому СПКЯ. Первым этапом работы явилось выяснение причинно-следственных взаимоотношений между метаболическими нарушениями и ановуляцией. Результаты исследований Yu N., Shyamal K. и Roy S.K. (1999), выполненных in vitro, показали, что инсулин производит эффекты, подобные гонадотропным, которые реализуются через стимуляцию процессов стероидогенеза в клетках гранулезы и теки яичников. Работы Franks S. (2000) показали, что при хронической ановуляции, свойственной СПКЯ, яичники сохраняют чувствительность к инсулину, а растущие фолликулы реагируют на инсулин досрочно, находясь на более ранних стадиях развития, чем в условиях физиологического фолликулогенеза. Такие фолликулы преждевременно накапливают цАМФ, останавливаются в росте и не способны к овуляции, но сохраняют функцию стероидогенеза.
При изучении метаболизма в период фолликулярной фазы овуляторного менструального цикла (МЦ) нами выявлены циклические колебания процессов инсулинопосредованной утилизации глюкозы, а именно в ранний период овуляторного цикла чувствительность периферических тканей к инсулину была достоверно более низкой, чем в поздний, что сопровождалось более высокой активностью β-клеток, чем в поздний период, отличающийся повышением чувствительности к инсулину и снижением функции β-клеток. Эти изменения регистрировались у женщин, имеющих овуляторный МЦ, вне зависимости от ИМТ. На основании регрессионных моделей показана значимость изучаемых метаболических параметров в сложных механизмах селекции фолликулов в овуляторном МЦ. В частности, на диаметр лидирующего фолликула, толщину эндометрия в предовуляторный период, диаметр желтого тела у женщин с овуляторным МЦ достоверно влияли следующие факторы: степень чувствительности к инсулину и показатели, количественно отражающие первую и вторую фазы секреции инсулина, что позволяет рассматривать данные независимые предикторы как значимые для селекции фолликулов. Эти изменения имели одинаковую направленность у женщин как без, так и с избыточной массой тела.
Совершенно иная картина наблюдалась при хронической ановуляции, когда в период, соответствующий фолликулярной фазе овуляторного МЦ (1–14-й дни МЦ), было выявлено наличие значительной аддитивной гиперинсулинемии. Кроме того, при СПКЯ и хронической ановуляции циклические изменения инсулинемии не регистрировались и, несмотря на повышение чувствительности к инсулину в дни, соответствующие позднему периоду фолликулярной фазы, не происходило адекватного снижения функции β-клеток, что и способствовало появлению добавочной гиперинсулинемии. Выявленные нарушения метаболизма жестко ассоциировались с таковым процесса инициации лидирующего фолликула и ановуляцией.
Нарушения углеводного метаболизма сопровождались появлением липидных аномалий; в частности, у женщин с нормальной массой тела проатерогенные сдвиги липидов плазмы были ассоциированы со снижением антиатерогенного класса фосфолипидов вследствие ограничения холестеринакцепторной емкости частиц липопротеидов высокой плотности, что подтверждало низкое отношение
фосфолипидов к уровню холестерина. У женщин с избыточной массой тела в условиях пищевого стресса, например, обусловленного нагрузкой жиром, усугублялись имевшиеся в базальном состоянии атерогенные сдвиги. Этому способствовала высокая скорость падения концентрации фосфолипидов вследствие повышения уровней глюкозы и холестерина, а выявленные нами причинно-следственные связи между этими показателями позволили рассматривать последние как предикторы дислипидемии [50].
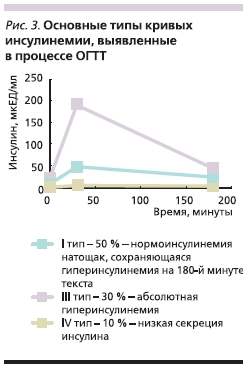
Предварительный анализ результатов ОГТТ (до лечения Дибикором) помог выделить несколько вариантов нарушений: так у пациенток с нормальной массой тела или ее дефицитом кривые гликемии чаще отражали недостаточность 1-й фазы секреции инсулина и повышенный периферический клиренс глюкозы, и лишь в небольшом проценте случаев выявлялись плоские и двугорбые кривые с пиком на 30-й и 120-й минутах теста (табл. 2, рис. 2).
Таблица 2. Показатели гликемии в процессе ОГТТ до и после 3-месячной терапии Дибикором.
Рисунок 2. Изменение типов сахарной кривой, выявленные в процессе ОГТТ до и через 3 месяца терапии Дибикором.
Кривые инсулинемии у этих женщин характеризовались сохраняющейся гиперинсулинемией и на 180-й минуте теста, и в небольшом проценте отмечались плоские кривые с низким уровнем инсулина (табл. 3, рис. 3).

После выполнения 3-месячного курса лечения Дибикором отмечено снижение гликемии, инсулинемии; уменьшение степени ИР; улучшение 1-й и 2-й фаз секреции инсулина (функция β-клеток) на фоне изменения метаболического клиренса глюкозы и повышения чувствительности к инсулину (табл. 4).
Таблица 3. Показатели инсулинемии в процессе ОГТТ до и после 3-месячной терапии Дибикором.
Таблица 4. Степень резистентности к инсулину натощак (НОМА), функция β-клеток, чувствительность
периферических тканей к инсулину и периферический клиренс глюкозы до и после терапии
Дибикором в группах с нормальной и избыточной массой тела.
У женщин с семейным анамнезом СД на фоне применения Дибикора произошла коррекция 1-й фазы
секреции инсулина с увеличением инсулинемии на 30-й минуте теста и со снижением на 180-й минуте, в результате чего кривая гликемии приобрела физиологический тип в результате снижения имевшейся на 60-й минуте теста гипергликемии (рис. 4). Изменения репродуктивной функции имелись у всех пролеченных женщин, но более значимые были достигнуты у пациенток без избыточной массы тела в виде сокращения длительности МЦ с 45–42 до 36–32 дней (рис. 5). Кроме того, при выполнении УЗИ-мониторинга эндометрия в период фолликулярной фазы МЦ были получены данные об увеличении его толщины с 5 до 7–8 мм; уменьшилось число больных с толщиной эндометрия менее 8 мм на 12–13-й дни периовуляторного периода, а в 6 случаях на 12–13-й дни МЦ появился лидирующий фолликул с диаметром 18–22 мм и высокой вероятностью овуляции.
Рисунок 5. Клинические характеристики до и после терапии Дибикором.
Выводы
У женщин без избыточной массы тела Дибикор снижает степень ИР натощак и увеличивает функцию β-клеток за счет повышения секреции инсулина в течение как 1-й, так и 2-й фаз.
У женщин с избыточной массой тела улучшилась функция β-клеток со снижением абсолютной гиперинсулинемии на фоне повышения чувствительности к инсулину и его метаболического клиренса.
Дибикор модулирует метаболические нарушения у пациенток с СПКЯ, уменьшая степень аддитивной гиперинсулинемии.
Применение препарата в течение 3 месяцев улучшает функцию β-клеток за счет коррекции 1-й фазы секреции инсулина и снижения степени гиперинсулинемии, что сопровождается улучшением функции яичников с инициацией процесса селекции лидирующего фолликула у части пациенток с ановуляторной дисфункцией.


