Рост заболеваемости сахарным диабетом (СД) в масштабах всего мира имеет эпидемический характер: в 2005 г. было зарегистрировано 200 млн больных, а уже к 2010 г. эта цифра достигла 285 млн. Опубликованный в 2004 г. прогноз на 2030 г., ранее называемый “неутешительным”, составлял 366 млн человек [1]. Теперь, по оценке IDF, к 2030 г. ожидается увеличение числа людей, страдающих СД, до 438 млн. Стремительный рост заболеваемости СД охватывает все страны, и Россия здесь не является исключением. Так, в 2009 г. в нашей стране было зарегистрировано более 3 млн больных СД [2]. В Москве их количество составляет 240 тыс., из которых подавляющее большинство (93 %) – это пациенты с СД типа 2 (СД2). Ежегодный прирост числа больных СД в Москве составляет 4–6 %.
Все увеличивающееся число больных СД является существенной нагрузкой для экономики. Затраты на лечение таких пациентов включают не только стоимость сахароснижающих препаратов, но и расходы, связанные с лечением осложнений заболевания, контролем гликемии, лечением гипер- и гипогликемических состояний [3].
Наличие СД в 3–4 раза увеличивает риск сердечно-сосудистых заболеваний, которые являются основной причиной смерти пациентов [4]. Так как хроническая гипергликемия играет основную роль в патогенезе ангиопатий, то адекватная компенсация СД является основой профилактики и замедления прогрессирования сосудистых осложнений. Показано, что интенсивный контроль гликемии наряду с нормализацией артериального давления (АД) значительно снижает риск развития ишемической болезни сердца и цереброваскулярных заболеваний. Таким образом, в сложившихся условиях для снижения показателей смертности больных СД наиболее приоритетной задачей является эффективная коррекция гипергликемии [5].
В действительности же 76 % больных СД в РФ (по данным государственного регистра) не достигают целей контроля – уровня гликированного гемоглобина (НbА1с) < 7 %. Это свидетельствует о недостаточной эффективности мер, принимаемых для лечения СД.
Основной задачей современной диабетологии является не только разработка, но и широкое внедрение действенных мер по коррекции гипергликемии, призванных значительно уменьшить риск развития макро- и микрососудистых осложнений, полинейропатии, увеличить продолжительность жизни больных и минимизировать социально-экономические потери. Современный терапевтический подход должен основываться на понимании основных патогенетических механизмов, лежащих в основе развития и прогрессирования СД2 и его осложнений. Несомненно тактика ведения таких больных должна включать не только эффективный, но и безопасный гликемический контроль,
обеспечивающий длительную коррекцию метаболических нарушений.
обеспечивающий длительную коррекцию метаболических нарушений.
Успешное управление СД2 на современном этапе предполагает многоплановое воздействие на различные патогенетические механизмы.
Основными компонентами такого многофакторного терапевтического воздействия являются:
• своевременная диагностика СД;
• оптимизация физической нагрузки и диетотерапия;
• своевременная интенсификация лечения в соответствии с индивидуальными целями;
• терапия до достижения целевых параметров;
• обеспечение низкого риска гипогликемий;
• снижение риска развития осложнений и прогрессирования заболевания;
• коррекция инсулинорезистентности, дислипидемии, снижение массы тела.
• своевременная диагностика СД;
• оптимизация физической нагрузки и диетотерапия;
• своевременная интенсификация лечения в соответствии с индивидуальными целями;
• терапия до достижения целевых параметров;
• обеспечение низкого риска гипогликемий;
• снижение риска развития осложнений и прогрессирования заболевания;
• коррекция инсулинорезистентности, дислипидемии, снижение массы тела.
Рекомендуемые в настоящее время целевые показатели HbA1c установленына основании результатов фундаментальных исследовательских проектов. Так, в исследовании UKPDS обнаружена линейная зависимость между степенью гипергликемии, с одной стороны, и смертностью или сердечно-сосудистой заболеваемостью, с другой. Доказано, что снижение уровня НbА1с, систолического АД (САД) и холестерина липопротеидов низкой плотности (ЛПНП) может уменьшить риск развития микро- и макроваскулярных осложнений. Целями лечения являются: поддержание значений НbА1с < 7 %, снижение САД < 130 мм рт. ст., ЛПНП < 2,2 ммоль/л [6].
Результаты исследования ACCORD показали повышение смертности в группе интенсивного контроля при агрессивной тактике, направленной на достижение уровня HbA1c < 6,5 %. Однако в мета-анализе, включившем 5 исследований [24], в которых участвовали пациенты, получавшие интенсивную терапию (ACCORD, ADVANCE, PREDICTIVE, UKPDS и VADT), не было выявлено подобного влияния на смертность от любой причины (отношение рисков – ОР 1,02; 95 % доверительный интервал – ДИ 0,87–1,19). В то же время обнаружено снижение на 17 % частоты инфаркта миокарда без летального исхода (ОР 0,83; 95 % ДИ 0,75–0,93) и на 15 % частоты коронарной болезни сердца (ОР 0,85; 95% ДИ 0,77–0,93).
Современная терапевтическая концепция лечения СД2 была отражена в совместном консенсусе Американской диабетической ассоциации (ADA) и Европейской ассоциации по изучению диабета (EASD; рис.1).
Рисунок 1. Алгоритм ADA и EASD (2008) по управлению СД2.
Это обновленное руководство определяет основной терапевтической целью достижение и поддержание уровня HbA1c < 7 %, а превышение этого значения следует рассматривать как сигнал к активному изменению терапии (Nathan D.M. и соавт., 2008) [7]. В документе особо подчеркивается важность коррекции дислипидемии, артериальной гипертензии, гиперкоагуляции, инсулинорезистентности и ожирения наряду со снижением гипергликемии.
С момента выявления у пациента СД2 следует начинать терапию метформином вместе с изменением образа жизни (диета + физическая активность). При этом необходимо усиливать влияние на образ жизни при каждом визите, контролировать HbA1с каждые 3 месяца до достижения уровня HbA1с < 7 %, а затем – каждые 6 месяцев. Модификация образа жизни направлена на улучшение показателей гликемии, АД, коррекцию дислипидемии, а также снижение массы тела. Даже небольшое уменьшение веса (на 4 кг) может улучшить показатели гликемии. При отсутствии эффекта от проводимого лечения встает вопрос о его изменении. Терапия должна меняться, если HbA1с ≥ 7 %.
Если указанные меры не обеспечивают поддержание целевых значений HbA1с или применение метформина противопоказано, то в качестве “хорошо подтвержденной базовой терапии” рекомендуется назначение базального инсулина или препаратов сульфонилмочевины (ПСМ). При уровне HbA1с > 8,5 % однозначно рекомендуется назначать инсулин. Если терапия “второго шага” не обеспечивает поддержание целевых значений гликемического контроля, рекомендован переход к интенсивной инсулинотерапии. Алгоритм лечения СД2 рассматривает инсулин в качестве сахароснижающего средства, обладающего наибольшей эффективностью.
Уже на момент выявления СД2 секреция инсулина снижена на 50 % [8]. На фоне терапии ПСМ 5–10 % пациентов ежегодно утрачивают компенсацию заболевания [9]. Развивается т. н. вторичная резистентность к ПСМ вследствие прогрессирующего снижения секреции инсулина β-клетками, а также нарастания инсулинорезистентности. Поэтому без своевременной инициации инсулинотерапии достижение гликемического контроля становится невозможным для большинства пациентов с СД2. По данным Brown и соавт., у пациентов с уровнем HbA1с > 7 % проходит около 10 лет от установления диагноза СД2 до начала инсулинотерапии. По имеющейся информации, в нашей стране только 14 % больных СД2 получают инсулинотерапию [10]. По оценке экспертов, этот показатель должен находиться на уровне 40 %.
Следует подчеркнуть, что при наличии современных аналогов инсулина затягивание начала инсулинотерапии не может быть оправданно. Первым шагомв лечении СД2 при неэффективности пероральных сахароснижающих препаратов (ПССП) должна стать своевременная коррекция гипергликемии натощак путем добавления к ПССП базального инсулин [11, 12].
Инсулин гларгин (Лантус, санофиавентис) – аналог инсулина длительного действия, обеспечивающий потребность в базальном инсулине в течение 24 часов. Добавление одной инъекции инсулина гларгин к каждодневному лечению СД2 у пациентов на ПССП, не достигших или не поддерживающих целевых параметров гликемии, – простой и эффективный путь достижения быстрого и стабильного результата. Применение инсулина гларгин сопровождается улучшением гликемического контроля, снижением уровня HbA1c [13–17], уменьшением риска ночных гипогликемий, повышением удовлетворенности пациента лечением (рис. 2).
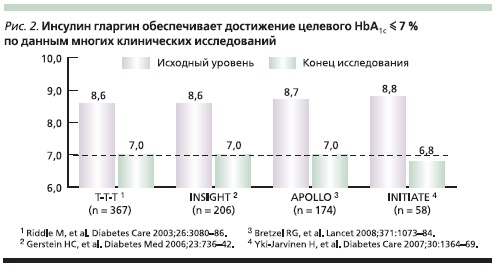
В настоящее время накоплен большой опыт применения инсулина гларгин в повседневной клинической практике. По данным Московского регистра (2007), применение инсулина гларгин в режиме базально-оральной терапии привело к значительному улучшению параметров контроля СД: уровень НbA1с cнизился на 2,1 % (с 9,9 до 7,8 %; р < 0,05).
Анализ регистра LAURЕL (LAntus Utilisation in Real Life) позволил оценить эффективность применения инсулина гларгин у пациентов с СД2 в повседневной клинической практике в РФ. Регистр был создан на базе данных, полученных из поликлиник различных регионов России. В нем приняли участие 366 врачей-эндокринологов (рис. 3).
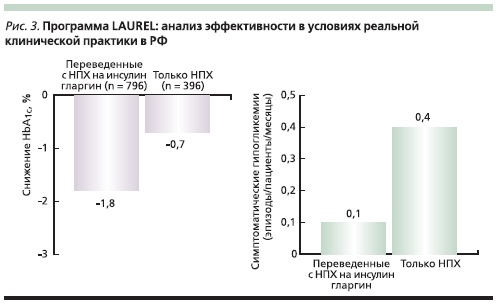
Были проанализированы результаты лечения 1192 пациентов, из которых 796 были переведены с терапии инсулином НПХ на инсулин гларгин; контрольную группу составили 396 больных, продолжавших получать НПХ инсулин. В обеих группах отмечено снижение уровня HbA1c через 4–9 месяцев лечения (на 1,8 ± 1,4 и 0,7 ± 1,1 % соответственно; p < 0,001) и глюкозы плазмы натощак (ГПН; на 2,93 ± 2,26 и 1,15 ± 2,09 ммоль/л соответственно; р < 0,001). Однако в группе гларгина данные показатели были существенно ниже, чем в группе НПХ инсулина. При этом большее число пациентов в группе гларгина достигли целевых значений HbA1c < 7 % (23,0 против 3,5 %; p < 0,001) и ГПН < 5,5 ммоль/л (18,3 против 4,3 %; p < 0,001). По сравнению с инсулином НПХ терапия инсулином гларгин ассоциировалась с меньшим количеством гипогликемических эпизодов на одного пациента в месяц: симптоматических (0,1 ± 0,5 против 0,4 ± 1,0), ночных (0,1 ± 0,5 против 0,7 ± 1,1), тяжелых (0,01 ± 0,1 против 0,04 ± 0,3), любых (0,5 ± 1,0 против 1,7 ± 2,1) [18]. Таким образом, отечественный опыт показал, что перевод больных СД2 на терапию инсулином гларгин позволяет улучшить гликемический контроль и снизить риск гипогликемических состояний в условиях реальной клинической практики.
Увеличение расходов, связанных с ростом числа больных СД, ощутим даже для экономически развитых стран. Для решения вопроса о фармакоэкономической целесообразности длительного применения гларгина было проведено исследование ЛАУРУС (см. таблицу). Его результаты демонстрируют эффективное снижение уровня HbA1c у пациентов, получавших гларгин (на 2,47 против 1,92 % в группе больных на терапии инсулином НПХ) после 6 месяцев лечения. При этом большинство пациентов из группы гларгина (53,6 %) достигли целевых значений показателей углеводного обмена, тогда как подобный результат был зарегистрирован только у 14,6 % пациентов, получавших инсулин НПХ. Частота эпизодов гипогликемии на одного пациента была выше в группе инсулина НПХ (1,95), чем в группе гларгина (0,3). Общая стоимость 6-месячного лечения одного пациента гларгином была выше на 45 %, а эффективность – на 54 %. Соотношение “стоимость–эффективность” было выше
при терапии инсулином НПХ в сравнении с гларгином (780 и 314 руб. соответственно) (Шестакова М.В. и соавт., 2009). Таким образом, инсулин гларгин позволяет добиваться компенсации СД у большинства больных, обладает лучшей переносимостью и оптимальным соотношением “эффективность–стоимость”. С учетом расходов на лечение гипогликемий терапия гларгином еще более оправданна (см. таблицу).
при терапии инсулином НПХ в сравнении с гларгином (780 и 314 руб. соответственно) (Шестакова М.В. и соавт., 2009). Таким образом, инсулин гларгин позволяет добиваться компенсации СД у большинства больных, обладает лучшей переносимостью и оптимальным соотношением “эффективность–стоимость”. С учетом расходов на лечение гипогликемий терапия гларгином еще более оправданна (см. таблицу).
Таблица. Фармакоэкономическое сравнение инсулина гларгин и инсулина НПХ в исследовании ЛАУРУС (РФ).
Ретроспективное наблюдательное исследование ROLE-HПХ, основанное на базах данных США, позволило оценить влияние терапии гларгином на долговременный контроль гликемии. Был проведен ретроспективный анализ данных наблюдения за достаточно большим количеством больных СД2 (2839), у которых к терапии ПССП был добавлен базальный инсулин в связи с плохим контролем заболевания: 2105 пациентов получали терапию гларгином, а 734 –инсулином НПХ. За 2 года терапии у больных, получавших гларгин, зарегистрированы большее снижение уровня HbA1c, меньшая частота эпизодов гипогликемических состояний и большая экономическая эффективность (за счет меньшего числа госпитализаций), чем при применении инсулина HПХ [19].
Ретроспективное исследование, базировавшееся на данных о больных СД2 в Великобритании, позволило оценить динамику уровня HbA1c после перевода с терапии инсулином НПХ на лечение гларгином. Отмеченное снижение уровня HbA1c после 12 месяцев лечения позволило сделать вывод о возможности улучшения показателей углеводного обмена с помощью терапии гларгином для пациентов, у которых не удалось добиться адекватного гликемического контроля с помощью терапии инсулином НПХ [20]. В исследовании Schreiber S.A. и соавт., продолжавшемся 2,5 года, было показано, что титрация инсулина гларгин, добавленного к терапии ПССП, обеспечивает длительный гликемический контроль: через 3 месяца – снижение уровня HbA1c на 1,5 % и ГПН на 3,8 ммоль/л; через 9 месяцев – на 1,7 % и 3,9 ммоль/л [21] и через 32 месяца – на 1,6 % и 4,0 ммоль/л соответственно [22].
Были опубликованы результаты ряда исследований, показавших приверженность пациентов к терапии гларгином. В частности, Eliaschewitz F.G. и соавт. [23], сравнивавшие терапию комбинацией глимепирида с гларгином или инсулином НПХ в качестве базального инсулина, отметили, что число больных, удовлетворенных лечением, было больше в группе гларгина. Интересно, что доля пациентов, пропустивших работу или вынужденных изменить свои планы из-за наличия СД, была достоверно ниже в группе больных, получавших гларгин, по сравнению с инсулином НПХ (1,3 и 3,0 % соответственно).
Как было показано в ходе других исследований, длительная терапия гларгином больных СД2 не сопровождается негативным влиянием на массу тела (Yki-Jаrvinen H, 2006). В работе Schreiber S.A. и соавт. наблюдалась тендеция к уменьшению индекса массы тела (ИМТ) в целом по популяции
больных: исходно – 29,0 ± 4,7 кг/м2; через 3 месяца – 28,7 ± 4,5 кг/м2; через 9 месяцев – 28,5 ± 4,8 кг/м2 [21, 22]. Продление наблюдения на срок до 32 месяцев показало, что при продолжении лечения величина индекса массы тела практически не изменялась (28,6 ± 4,7; 0,3 ± 3,2 кг/м2) [22].
больных: исходно – 29,0 ± 4,7 кг/м2; через 3 месяца – 28,7 ± 4,5 кг/м2; через 9 месяцев – 28,5 ± 4,8 кг/м2 [21, 22]. Продление наблюдения на срок до 32 месяцев показало, что при продолжении лечения величина индекса массы тела практически не изменялась (28,6 ± 4,7; 0,3 ± 3,2 кг/м2) [22].
Таким образом, как контролируемые исследования, так и данные долгосрочных регистров подтверждают клиническую эффективность и безопасность применения пролонгированного аналога инсулина гларгин (Лантус) в лечении СД2.



