Антибиотикотерапия, являясь несомненным достижением медицины середины XX в., позволила справиться со многими тяжелыми инфекциями, но оказалась отнюдь не безобидным методом лечения. Лечение антибиотиками (АБ) может сопровождаться различными побочными эффектами, что зависит от механизма действия препарата, широты его антибактериального спектра, пути введения и элиминации, а также длительности курса. Хорошо известны нефро- и ототоксическое действия аминогликозидов; развитие аллергических реакций в виде крапивницы, отека Квинке и даже анафилактического шока, особенно на антибиотики пенициллинового ряда; воздействие фторхинолонов на хрящевую ткань, тетрациклина – на зубы в период их роста и т. д.
Одними из наиболее распространенных побочных эффектов являются различные диспепсические расстройства: боль в животе, тошнота, метеоризм, однако чаще других наблюдается диарея. Механизмы антибиотико-ассоциированной диареи (ААД) различны. Ряд АБ может оказывать прямое воздействие на структуру кишечного эпителия (неомицин, амоксициллин/клавуланат), другие – на кишечный кровоток (пенициллин, сульфаниламиды), третьи способны стимулировать мотилиновые рецепторы и ускорять моторику кишки (эритромицин), но главной причиной ААД является влияние АБ на экосистему кишечника [1].
В результате антибиотикотерапии происходит уменьшение численности резидентной флоры, выполняющей защитную барьерную функцию, в результате чего нарушается “колонизационная резистентность” и увеличивается число условно-патогенных микроорганизмов. Параллельно нарушаются метаболические процессы, обусловленные кишечной микрофлорой, и в организме могут накапливаться потенциально токсичные продукты. Подавление облигатной микрофлоры может сопровождаться нарушением деконъюгации желчных кислот и как следствие – секреторной диареей. Накопление непереваренного микрофлорой муцина в просвете кишки может связывать катионы Na, К, Ca и вызывать осмотическую диарею; уменьшение пула короткоцепочечных жирных кислот и накопление нерасщепленных углеводов также поддерживает осмотическую диарею.
Эпидемиология
Эпидемиологическое исследование, проведенное во Франции, показало, что из 650 детей в возрасте от 1 месяца до 15 лет, получавших антибиотикотерапию продолжительностью 7–10 дней, диарея (жидкий стул чаще 3 раз в сутки на протяжении не менее 2 дней) отмечалась у 11 % [2]. Наибольшую опасность представляют АБ широкого спектра (амоксициллин/клавуланат, амоксициллин), а также клиндамицин, линкомицин, тетрациклин, цефтриаксон, цефиксим; слабее влияют АБ, плохо проникающие в кишечник из крови (пенициллин, аминогликозиды), и АБ узкого спектра. По данным Bouhnik Y. (2006), ААД развивается у 5–10 % пациентов, получающих ампициллин, 10–25 % – амоксициллин/клавуланат, 15–20 % – цефалоспорины 3-го поколения и лишь у 2–5 %, получающих другие антибиотики [3]. Парентеральное введение АБ при условии их энтерогепатической циркуляции не снижает риска ААД, за исключением аминогликозидов, введение которых никогда не сопровождается развитием диареи [4].
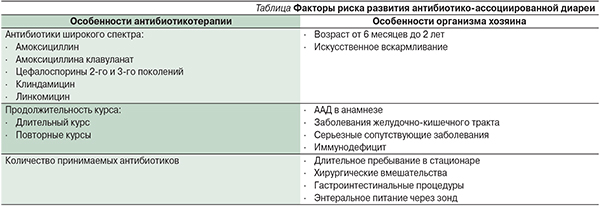
В таблице представлено две группы факторов риска ААД: обусловленные свойствами антибиотика и вызванные особенностями организма хозяина.
Этиология
Антибиотико-ассоциированная диарея этиологически может быть связанной с различными микробами: Pseudomonas aeruginosa, Klebsiella oxytoca, Staphylococcus aureus и др., грибами рода Candida, но наиболее тяжелые ее формы обусловлены Clostridium difficile.
C. difficile – это грамположительный облигатный анаэроб, образующий споры, которые позволяют ему длительно выживать в окружающей среде, встречается у людей и домашних животных, растет медленно на селективных средах, содержащих циклосерин и цефокситин, обогащенных фруктозой и яичным желтком. Клостридиоз – это типичная нозокомеальная инфекция. В литературе описаны вспышки клостридиоза в больницах, причем только 7 % пациентов стационаров являются носителями C. difficile при поступлении и 21 % становятся таковыми за время пребывания в стационаре [5]. Источником инфекции могут быть туалеты, ванные, швабры, тапки медперсонала, лестницы, стены больничных палат. Микроб обнаруживают на руках персонала, он может длительно сохраняться под кольцами на пальцах. C. difficile может распространяться в детских коллективах (детских садах, яслях), а также в роддомах. В литературе описано несколько вспышек инфекции C. difficile у детей.
Delmee M. и соавт. проспективно наблюдали за одной из палат новорожденных в больнице Бельгии в течение 6 месяцев и установили, что 76 из 114 (67 %) детей были инфицированы C. difficile [6]. У двоих из этих детей развился тяжелый некротический энтероколит. Larson H.E. и соавт. проспективно наблюдали 451 новорожденного в 5 палатах одной из больниц Великобритании [7].
В зависимости от палаты инфицированность C. difficile варьировалась от 6 до 52 %. Источником инфицирования была ванна, в которой купали детей. При обследовании матерей микроб в вагинальных мазках обнаружен не был. Небольшие вспышки клостридиоза были описаны также в детских онкологических отделениях [8].
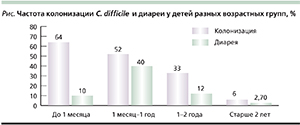
Несмотря на высокую частоту инфицирования C. difficile новорожденных, симптомы диареи у них наблюдаются редко (см. рисунок). Это объясняется незрелостью рецепторов слизистой оболочки кишечника, что обусловливает их нечувствительность к токсинам, недостаточной активностью воспалительного ответа, а также протективным действием материнского молока у детей, находящихся на грудном вскармливании [9]. Могут иметь значение и материнские антитела к C. difficile. Наиболее высокая частота клинически манифестного клостридиоза у детей отмечена в возрасте от 6 месяцев до 2 лет, поскольку кишечный микробиоценоз, равно как и барьерные функции кишечника, формируются лишь к концу второго года жизни.
Клиника
Клинически различают три формы ААД:
- простую диарею;
- геморрагический колит;
- псевдомембранозный колит.
Простая диарея является самой частой формой ААД, она может быть обусловленной любым из вышеперечисленных инфекционных агентов. Обычно диарея начинается через несколько дней после начала курса антибиотикотерапии, но иногда появляется через несколько недель после ее окончания. Диарея обычно нетяжелая, не сопровождается болями в животе или лихорадкой. У большинства больных диарея прекращается даже без лечения после отмены АБ, но иногда может протекать более упорно или давать рецидивы. При эндоскопическом исследовании слизистая оболочка толстой кишки (СОТК) выглядит несколько гиперемированной и отечной, иногда отмечают единичные петехиальные эрозии.
 Геморрагический колит этиологически связан с C. difficile или K. oxytoca [10]. Он проявляется многократным водянистым стулом, впоследствии с примесью крови, сопровождающимся приступообразными болями в животе. Температура обычно нормальная или субфебрильная. Эндоскопически обнаруживают отечную, гиперемированную СОТК со множественными геморрагическими эрозиями, локализующимися как бы на возвышениях. Гистологическая картина неспецифична и характеризуется воспалительной инфильтрацией собственной пластинки (lamina propria) с примесью нейтрофилов, микроэрозиями, повреждением крипт и уменьшением продукции слизи.
Геморрагический колит этиологически связан с C. difficile или K. oxytoca [10]. Он проявляется многократным водянистым стулом, впоследствии с примесью крови, сопровождающимся приступообразными болями в животе. Температура обычно нормальная или субфебрильная. Эндоскопически обнаруживают отечную, гиперемированную СОТК со множественными геморрагическими эрозиями, локализующимися как бы на возвышениях. Гистологическая картина неспецифична и характеризуется воспалительной инфильтрацией собственной пластинки (lamina propria) с примесью нейтрофилов, микроэрозиями, повреждением крипт и уменьшением продукции слизи.
Псевдомембранозный колит (ПМК) обусловлен C. difficile, которая вырабатывает токсины А и В. Почти все штаммы C. difficile продуцируют оба токсина, реже – только токсин В. Токсины C. difficile повреждают актин микроворсинок энтероцитов, вследствие чего усиливается парацеллюлярная проницаемость кишечного эпителия, происходит потеря ионов хлора из клеток. Кроме того, токсины вызывают воспалительную реакцию СОТК с продукцией провоспалительных цитокинов, хемокинов, эйкозаноидов и субстанции Р. Результатом этого процесса являются выраженная нейтрофильная инфильтрация стенки кишки и формирование псевдомембран на поверхности слизистой оболочки [11].
В 95 % случаях ПМК манифестируется тяжелой диареей до 4–10 раз в сутки, стул может быть водянистым, светлым или зеленоватым с большим количеством слизи и прожилками крови. В 70 % диарея сопровождается тенезмами, в 26 % – повышением температуры, могут быть небольшая потеря массы тела, гипоальбуминемия, гипохолестеринемия [12]. Иногда диарея отсутствует и заболевание проявляется токсическим мегаколоном или илеусом; может быть небольшой асцит.
Эндоскопическая картина ПМК обычно очень характерна: на поверхности отечной гиперемированной СОТК обнаруживают желтовато-белые выступающие бляшки диаметром от 2 до 20 мм. Гистологически выявляют поверхностный некроз СОТК с экссудатом лейкоцитов и фибрина, перемешанных со слизью. Крипты заполнены слизью, в собственной пластинке – выраженная инфильтрация полиморфноядерными лейкоцитами.
При более легком течении ПМК типичные бляшки эндоскопически могут не обнаруживаться, поэтому гистологическое исследование приобретает особую важность, т. к. и в этих случаях удается выявить очаговые некрозы эпителия с фибринозно-лейкоцитарным экссудатом. При очень тяжелом течении ПМК эндоскопическая картина может напоминать ишемический колит или болезнь Крона с формированием под фибрином глубоких язв, что требует тщательной дифференциальной диагностики с этими заболеваниями [13].
В ряде случаев у детей C. difficile может стать причиной рецидивирующей или хронической диареи, повторных кишечных колик или других гастроинтестинальных симптомов, которые могут сопровождаться плохим аппетитом и задержкой роста [14]. Повышенный риск клостридиоза имеют дети с болезнью Гиршпрунга, синдромом короткой кишки, синдромом кишечной псевдообструкции. Осложнениями ПМК у детей могут быть экссудативная энтеропатия [14], ректальный пролапс [15], хронический остеомиелит [16], перфорация кишки и некротический энтероколит [17].
Диагностика
Появление диареи на фоне или после курса антибиотикотерапии требует уточнения ее этиологии. С этой целью проводят посев кала на ряд питательных сред, в т. ч. культивирование в аэробных и анаэробных условиях. Для посева на C. difficile используют циклосерин-цефокситин-фруктозный агар. Бактериологический метод имеет ограниченную (78 %) чувствительность и требует наличия хорошо оснащенной лаборатории, что не всегда возможно на практике. Поэтому для диагностики клостридиоза все большую распространенность приобретает иммуноферментный метод обнаружения токсинов А и В в кале. Его чувствительность колеблется от 76 до 96 %, специфичность – от 94 до 100 % [5]. С учетом вероятности обнаружения у пациента лишь одного из токсинов рекомендуется каждый раз исследовать кал на оба из них.
Поскольку существует многообразие причин диареи у детей, даже при обнаружении C. difficile или высеве других возможных возбудителей ААД в каждом случае необходим тщательный анализ клинико-анамнестических данных и результатов дополнительных исследований для установления точной этиологии диареи у ребенка.
Лечение
В случае появления диареи на фоне курса антибиотикотерапии, если возможно, необходимо отменить данный АБ. При любой из клинических форм ААД показано назначение пробиотиков, в случае необходимости продолжения антибиотикотерапии по поводу основной патологии производят смену АБ на менее опасный. Выбор АБ в этой ситуации может зависеть как от чувствительности микрофлоры, вызвавшей основное заболевание, так и от этиологии ААД. При предполагаемой роли условно-патогенных аэробов, в частности K. Oxytoca, рекомендуются аминогликозиды 2-го поколения парентерально (амикацин 10 мг/кг) или нитрофураны (нифурател 15 мг/кг), при кандидозе – флуконазол (10 мг/кг внутрь или внутривенно) или натамицин (100 мг 2 раза/сут внутрь), при клостридиозе – метронидазол (20 мг/кг внутрь или внутривенно) или ванкомицин (40 мг/кг внутрь). В случае резистентности C. difficile к метронидазолу или ванкомицину возможно назначение рифаксимина в дозе 20 мг/кг внутрь. При этом АБ назначают совместно с пробиотиком.
Среди известных пробиотиков только два доказали свою эффективность в лечении ААД: Saccharomyces boulardii (Энтерол®) и Lactobacillus rhamnosus GG (LGG). Однако сравнительные данные по изучению результатов лечения ААД этими пробиотиками показали, что Энтерол® (S. boulardii) по эффективности превосходят LGG: устранение симптомов диареи на фоне лечения Энтеролом® (S. boulardii) было достигнуто у 95 % больных, в то время как при лечении LGG – у 80 %; рецидивы диареи наблюдались после отмены LGG у 50 % больных, а после курса Энтеролом® (S. boulardii) – только у 5 % [5]. Монотерапия ААД Энтеролом® (S. boulardii) по эффективности не уступает лечению метронидазолом или ванкомицином, а по отдаленным результатам и вероятности рецидивов превосходит таковую [5].
В эксперименте антимикробное действие лиофилизированных S. boulardii было продемонстрировано в отношении множества патогенных микроорганизмов, вирусов, грибов и простейших (Rotavirus, C. difficile, Candida albicans, Candida crusei, K. oxytoca, P. aeruginosa, Salmonella typhimurium, Yersinia enterocolitica, Escherichia coli, Shigella dysenteriae, S. aureus, Entamoeba histolytica, Giardia lamblia). Столь широкий круг действия позволяет использовать S. boulardii как для лечения острых диарей, так и для устранения практических всевозможных возбудителей ААД [18, 19]. Благодаря природной антибиотикоустойчивости S. boulardii могут применяться уже на фоне лечения АБ. Они также обладают природной устойчивостью к соляной кислоте, другим секретам и ферментам желудочно-кишечного тракта, что позволяет им беспрепятственно достигать любых отделов кишечника и активно функционировать в нем.
S. boulardii продуцируют особую протеазу 54kDa, которая ингибирует в СОТК действие токсинов C. difficile А и В [20]. Благодаря маннозе, присутствующей в высокой концентрации на клеточной мембране S. boulardii, патогенные бактерии крепко прилипают к дрожжевой клетке, взаимодействуя с лектиновыми рецепторами (адгезинами), и выводятся из кишечника наружу. Этот механизм предотвращает адгезию патогенных бактерий к СОТК [21]. S. boulardii уменьшают гиперсекрецию воды и электролитов, обусловленную энтеротоксинами патогенных бактерий, высвобождая белок 120kDa, подавляющий стимуляцию аденилатциклазы и тем самым снижающий продукцию циклического АМФ, а также секрецию хлоридов и жидкости [22]. Кроме того, S. boulardii тормозят процессы фосфорилирования и распада белков, уменьшая вероятность экссудации и потери белка [22]. S. boulardii способствуют сохранению плотности межклеточных соединений кишечного эпителия, препятствуя фосфорилированию легких цепей миозина, и таким образом поддерживают целостность СОТК [23]. Лиофилизированные S. boulardii выделяют полиамины: спермин и спермидин – гормоноподобные субстанции, стимулирующие регенерацию кишечного эпителия [24]. Это сопровождается повышением ферментативной активности кишечника за счет стимуляции выработки мембранных ферментов: лактазы, сахаразо-изомальтазы, мальтазы [24], а также усилением всасывания в результате активизации работы транспортного канала SGLT-1, обеспечивающего совместное всасывание Na и глюкозы [24]. S. boulardii оказывают стимулирующее действие на местную иммунную систему кишечника, усиливая секрецию SIgA [24]. Одновременно происходит подавление MAP-киназы ядерного провоспалительного белка NF-kB с соответствующим снижением продукции провоспалительных цитокинов [25] и окиси азота – местного сосудорасширяющего медиатора. S. boulardii участвуют в метаболизме углеводов, увеличивая пул короткоцепочечных жирных кислот: уксусной, масляной и пропионовой, усиливая тем самым энергообеспечение и регенерацию эпителия и способствуя росту собственной индигенной бифидофлоры [26]. Столь мощное комплексное воздействие S. boulardii на все звенья патогенеза диареи объясняет высокую эффективность Энтерола® при ААД и других диарейных заболеваниях, выводит S. boulardii из общего ряда пробиотиков, позволяя рассматривать его в качестве биотерапевтического агента с широким потенциалом лечебных свойств.
Энтерол® назначают детям в дозе от 500 до 1000 мг/сут в зависимости от возраста; курс может составлять от 10 до 30 дней. Buts J.P. и соавт. показали высокую эффективность S. boulardii в дозе 500 мг/сут в течение 15 дней у 19 детей в возрасте от 2 до 32 месяцев с хронической диареей, ассоциированной с C. difficil [27]. Исчезновение симптомов диареи было достигнуто у 94,7 %, отрицательный ответ на токсин В C. difficile – у 84,2 % детей, побочных эффектов не было. В исследовании Costalos C. и соавт. S. boulardii в дозе 50 мг/кг в течение 30 дней оказали благоприятное воздействие на формирование кишечного биоценоза у 87 недоношенных детей, получавших энтеральное питание [28].



