Введение
Фибрилляция предсердий (ФП) является одной из наиболее часто встречаемых аритмий у взрослых пациентов в мире, и ожидается, что ее распространенность будет расти из-за увеличения продолжительности жизни населения [1]. Частота ФП у пациентов с острым коронарным синдромом (ОКС) составляет 2–23%, а сама ФП может быть связана с более высоким риском инфаркта миокарда (ИМ) [2, 3]. Более того, до 15% пациентов с ФП подвергаются чрескожному коронарному вмешательству (ЧКВ) по поводу ишемической болезни сердца (ИБС) в течение жизни, а 18–47% имеют сопутствующую стабильную ИБС, что подчеркивает потенциальную необходимость проведения ЧКВ в будущем пациентам с пожизненной терапией оральными антикоагулянтами (ОАК) [4].
Для профилактики инсульта у пациентов с ФП показаны антикоагулянты, тогда как для профилактики повторных атеротромботических событий и тромбоза стентов требуется назначение антиагрегантов [5]. Это определяет необходимость использования тройной антитромботической терапии (ТАТ) в раннем периоде острого ИМ после коронарного стентирования с последующим переходом на двойную антитромботическую терапию (ДАТ) [6, 7]. Хотя в настоящий момент нет единого мнения в отношении продолжительности и состава антитромботической терапии (АТТ), существует согласие в том, что продолжительность ТАТ должна быть сведена к минимуму (1–7 дней) и зависеть от риска ишемических событий и кровотечений у конкретного пациента [5].
Согласно клиническим рекомендациям Минздрава РФ, у пациентов, нуждающихся в длительной антикоагулянтной терапии, с ИМ с подъемом сегмента ST (ИМпST) и с ИМ без подъема сегмента ST (ИМбпST) вне зависимости от проведения коронарного стентирования ДАТ применяется до 12 месяцев, после чего антиагрегант отменяется, продолжается «монотерапия» ОАК для профилактики тромбоэмболических событий у пациентов с ФП в целевой дозе [6, 7].
Однако польза от АТТ в отношении сердечно-сосудистых ишемических событий должна быть тщательно сбалансирована с повышенным риском кровотечений, связанных с лечением [8].
Желудочно-кишечные кровотечения как грозное осложнение АТТ
В крупных рандомизированных контролируемых исследованиях примерно у 3% пациентов, принимавших прямые ОАК (ПОАК) плюс ингибитор P2Y12, возникло сильное кровотечение, а у 10% – клинически значимое кровотечение [9–11], что более чем в 2 раза превышает частоту кровотечений при монотерапии ПОАК, и на 50% выше, чем при использовании ДАТ [12].
В другом исследовании одновременное применение нестероидных противовоспалительных средств (НПВС) с ОАК привело к повышенному риску желудочно-кишечных кровотечений (ЖКК) (относительный риск [ОР]=3,01; 95% доверительный интервал [ДИ]: 1,63–5,55) и больших кровотечений (ОР=2,77; 95% ДИ: 1,84–4,19) [13].
ЖКК на фоне АТТ являются распространенной и серьезной медицинской проблемой. Смертность от кровотечений из верхних отделов и нижних отделов желудочно-кишечного тракта (ЖКТ) составляет от 3,5 до 13 и от 1 до 5% соответственно [14].
Один из компонентов АТТ – ацетилсалициловая кислота (АСК), необратимо ингибирует активность циклооксигеназы (ЦОГ) как в тромбоцитах, так и в слизистой оболочке ЖКТ. Таким образом, синтез цитопротекторных простагландинов в ЖКТ снижается, и в последующем могут развиваться гастродуоденальные осложнения [15]. Кроме того, АСК вызывает прямое повреждающее действие, накапливаясь в эпителиальных клетках, увеличивая проницаемость клеточных мембран и разрушая митохондрии в результате окислительного фосфорилирования [16]. Эндоскопическое исследование бессимптомных пациентов, принимавших АСК (<100 мг/сут), показало, что язвы или эрозии развивались у 48% пациентов [17]. Многонациональное проспективное исследование 187 пациентов, принимавших низкие дозы АСК (75–325 мг/сут) для профилактики сердечно-сосудистых заболеваний, показало, что у 20% из них наблюдались диспептические симптомы. Распространенность язвенной болезни желудка и двенадцатиперстной кишки в той же популяции составила 11% [18].
Другой препарат – клопидогрел, антагонист рецептора аденозиндифосфата (АДФ), подавляющий агрегацию тромбоцитов путем необратимого ингибирования АДФ-индуцированной активации рецептора гликопротеина IIb/IIIa. Исследование «Клопидогрел по сравнению с аспирином у пациентов с риском ишемических событий» CAPRIE (Clopidogrel versus aspirin in patients at risk of ischaemic events), в котором приняли участие 19 185 пациентов со средним периодом наблюдения 1,91 года, продемонстрировало, что прием клопидогрела (75 мг/сут) был ассоциирован со статистически значимо меньшим числом ЖКК (0,52 против 0,72%) и частотой появления диспепсических симптомов (0,97 против 1,22%), чем применение АСК (325 мг/сут) [19]. Тем не менее в другом исследовании частота ЖКК, ассоциированных с приемом клопидогрела, в группе больных высокого риска (с язвенной болезнью в анамнезе) составила 12% [20]. Стоит отметить, что клопидогрел не повреждает непосредственно ЖКТ, однако его активные метаболиты могут ингибировать синтез ангиогенных факторов, тем самым препятствуя заживлению повреждений слизистой оболочки желудка и кишечника [21].
На фоне монотерапии ПОАК среди пациентов, получавших лечение по поводу ФП, общая частота больших ЖКК в рандомизированных исследованиях составила от 0,8 до 1,9 случая на 100 пациенто-лет [22]. Механизм развития ЖКК при приеме ОАК ясен не до конца. Например, известно, что дабигатран может оказывать прямое местное повреждающее воздействие на ткани ЖКТ, нарушая целостность слизистой оболочки и/или препятствуя ее заживлению, тем самым вызывая ЖКК [23]. Но ингибиторы фактора Ха, за счет лучшей биодоступности обладают лучшим профилем безопасности [24]. Кроме действующего вещества риск ЖКК при приеме ПОАК зависит от их дозы и от характеристик пациента: возраст старше 65, низкая масса тела, некоторые сопутствующие заболевания, такие как хроническая болезнь почек и цирроз печени, а также другие одновременно применяемые препараты (НПВС, антиагреганты) повышают риски кровотечений [25]. Антикоагулянты обладают более высоким антигемостатическим эффектом по сравнению с антиагрегантами, что также заставляет настороженно относиться к их применению в отношении рисков кровотечений [26].
С учетом вышеизложенного профилактика повреждения слизистой оболочки ЖКТ и кровотечений из верхних и нижних отделов ЖКТ имеет решающее значение для длительной АТТ у пациентов с сочетанием ФП и ИБС.
Возможности снижения риска ЖКК при применении АТТ
Вопрос об определении риска ЖКК до конца не решен, т.к. традиционно используемая шкала HAS-BLED (Hypertension, abnormal renal/liver function, stroke, bleeding history or predisposition, labile international normalized ratio, elderly, drugs/alcohol concomitantly) прогнозирует риск возникновения больших кровотечений в течение года, но не позволяет говорить о риске ЖКК [27].
В нашей стране высокий риск ЖКК определяется наличием [6, 7] язвенной болезни или ЖКК в анамнезе, хронического использования НПВС или глюкокортикостероидов и минимум двух из следующих признаков:
- возраст ≥65 лет;
- диспепсия;
- желудочно-пищеводный рефлюкс;
- инфицирование Helicobacter pylori;
- хроническое употребление алкоголя.
В 2021 г. междисциплинарная команда, включившая экспертов Российского научного медицинского общества терапевтов (РНМОТ), Научного общества гастроэнтерологов России (НОГР), Национального общества профилактической кардиологии, разработала и опубликовала Российский консенсус экспертов по снижению риска ЖКК у пациентов, получающих ОАК [28]. В консенсусе изложена актуальная информация с учетом проведенных рандомизированных контролируемых исследований и результатов анализа данных реальной клинической практики, описаны факторы риска кровотечений, их оценка с помощью шкал и возможные пути предупреждения данных осложнений. Документ наиболее актуален для практикующих врачей терапевтических специальностей, поскольку содержит алгоритмы оценки и лечения пациентов с высоким риском ЖКК, принимающих ОАК, а также возможные взаимодействия с лекарственными средствами (ЛС)/биологически активными добавками (БАДами)/пищевыми продуктами [28].
Первым шагом для снижения риска ЖКК у пациентов, планирующих лечение с использованием ПОАК, является выявление модифицируемых и немодифицируемых факторов риска. Прежде всего, необходимо обратить внимание на возможность компенсации модифицируемых факторов риска. Для минимизации кровотечений рекомендуется регулярно оценивать список назначенных ЛС с целью профилактики полипрагмазии, а также использование БАДов и безрецептурных ЛС, принимаемых пациентом самостоятельно. Так, одновременное применение НПВС с ОАК сопровождается повышенным риском ЖКК (ОР=3,01; 95% ДИ: 1,63–5,55) и больших кровотечений (ОР=2,774; 95% ДИ: 1,84–4,19) [29]. Особого контроля требуют пациенты, нуждающиеся в комбинированной терапии (ОАК+антиагрегант), приеме ингибиторов CYP3A4 и/или Р-гликопротеина [28]. Пациенту, получающему ОАК, по возможности следует избегать неоправданного назначения антиагрегантов, нефракционированного гепарина, низкомолекулярных гепаринов, тромболитических препаратов, НПВС, селективных ингибиторов обратного захвата серотонина, селективных ингибиторов серотонина и норадреналина, хинидина, дронедарона, амиодарона (кроме апиксабана), ритонавира, кетоконазола, кларитромицина, эритромицина, флуконазола, нелфинавира, индинавира, вориконазола, кетоконазола, саквинавира, дарунавира, ритонавира, ифавиренца), а также некоторых продуктов питания и БАДов (зеленый чай; розмарина экстракт; апельсиновый сок; черный перец; экстракты мяты, абрикоса, клубники, апельсина. хрен обыкновенный, гинкго, имбирь, чеснок, малина, пиретрум девичий, куркумин, грейпфрутовый сок, эвкалипт) [28].
Наконец, пациентам с высоким риском ЖКК показано назначение протекторной терапии для защиты слизистой оболочки пищевода, желудка и кишечника. Наибольшей эффективностью в плане гастропротекции обладают ингибиторы протонной помпы (ИПП) [30].
В масштабном исследовании, объединившем данные о 1 643 123 пациентах, среди пациентов, получавших сопутствовавшую терапию ИПП, частота госпитализаций в связи с кровотечением из верхних отделов ЖКТ (76 случаев на 10 тыс. человеко-лет) была статистически значимо ниже, чем у больных, не получавших лечения ИПП (коэффициент заболеваемости – 0,66; 95% ДИ: 0,62–0,69). Для любого из изучаемых антикоагулянтов (апиксабан, ривароксабан, дабигатран, варфарин) частота госпитализаций по поводу кровотечений из верхних отделов ЖКТ была ниже в той подгруппе пациентов, которым была назначена сопутствовавшая терапия ИПП [31]. В другом исследовании 563 пациентов с ЖКК из верхних отделов (средний возраст – 63,6±16,7 года) и 415 пациентов с ЖКК из нижних (средний возраст – 70,8±13,8 года) совместное применение препаратов ИПП на фоне ДАТ помогает не только снижать риск кровотечения из верхних отделов ЖКТ, но и облегчать симптомы, например изжогу, кислотный рефлюкс, боль в верхней части живота, чтобы повышать приверженность пациентов лечению [26].
Известно, что язвенная болезнь является основной причиной кровотечений из верхних отделов ЖКТ [32]. Кровотечение – наиболее распространенныое осложнение язвенной болезни и, по оценкам, встречается в 15–20% случаев. Так, примерно у 40% пациентов с кровотечением из верхних отделов ЖКТ имеется геморрагическая язва.
H. pylori вызывает хронический поверхностный гастрит с нейтрофильной инфильтрацией слизистой оболочки. Инфекция H. pylori тесно ассоциирована с развитием язвы желудка и двенадцатиперстной кишки и повышает риск развития ЖКК в 1,7 раза [32]. Эрадикация H. pylori рекомендована до применения ПОАК, что значительно снижает риск развития язвы, а следовательно, и кровотечений у пациентов данной группы [33]. В состав лечения инфекции помимо антибактериальных ЛС входят и ИПП. Безусловно монотерапия ИПП не эффективна для уничтожения инфекции H. pylori, однако добавление ИПП к комбинации антибиотиков улучшает показатели эрадикации по сравнению с изолированным использованием антибиотиков. ИПП повышают уровень внутрижелудочного рН и оптимизируют антибактериальное действие принимаемых ЛС. Кроме того, ИПП, снижая секрецию желудочной кислоты, тем самым способствуют заживлению язв и эрозий, а также стабилизации тромбов и снижению частоты кровотечений в ЖКТ у пациентов, принимающих ДАТ. Прием ИПП на 50% снижает риск кровотечения из верхних отделов ЖКТ у пациентов, принимающих клопидогрел, и на 2,8% в год у пациентов с наличием более 3 факторов риска [34]. В рандомизированном исследовании пациенты, получавшие ДАТ в сочетании с ИПП, имели меньше событий со стороны ЖКТ (ОР=0,34; 95% ДИ: 0,18–0,63) по сравнению с пациентами, принимавшими только клопидогрел [35]. В проведенных ранее исследованиях длительное использование ребамипида привело к регрессу морфологических признаков хронического гастрита, выражающихся в лимфоцитарно-нейтрофильной инфильтрации слизистой оболочки желудка [36, 37]. При использовании в составе эрадикационной терапии, ребамипид ингибирует адгезию H. pylori к эпителиальным клеткам слизистой оболочки желудка.
Принимая во внимание плейотропное действие ребамипида, его прием рекомендован в комбинации с антисекреторными ЛС для ускорения заживления язвы, ускорения заживления слизистой оболочки желудка и кишечника. Известно, что сочетание ИПП+ребамипид ускоряет процесс эпителизации язвенного дефекта по сравнению с приемом ИПП в монотерапии (ОШ=2,40; 95% ДИ: 1,68–3,44) [38].
Однако данные многих исследований позволяют говорить о том, что ИПП не защищают нижние отделы ЖКТ [26, 31], а кроме того, до конца не решен вопрос о межлекарственных взаимодействиях, особенно актуальный для пожилых полиморбидных пациентов [39]. В таком случае для защиты слизистой оболочки ЖКТ необходимо рассмотреть другие препараты, особого внимания в этом плане заслуживает ребамипид. Так, ребамипид за счет увеличения выработки простагландинов и снижения перикисного окисления липидов оказывает антиоксидантное действие на слизистую оболочку ЖКТ. Как известно, простагландины обладают широким спектром протективных свойств: индуцируют синтез муцинов и бикарбонатов, регулируют секреторную активность париетальных клеток желудка, а также увеличивают насыщение кислородом слизистой оболочки посредством регуляции тонуса гладких миоцитов [40]. Помимо этого внимательно изучаются возможность ребамипида восстанавливать плотные контакты эпителия ЖКТ, что клинически приводит к регенерации эпителия, а также борьба с синдромом повышенной эпителиальной проницаемости и способность положительно влиять на состав микробиоты в эксперементальных исследованиях [41].
Некоторые особенности фармакокинетики и фармакодинамики этого препарата позволяют говорить в пользу высокой безопасности: отсутствие накопления ребамипида в тканях, отсутствие влияния на метаболизм других одновременно применяемых лекарственных средств, выведение большей части препарата в виде неактивных метаболитов с калом, что дает возможность применения ребамипида пациентами со сниженной фильтрационной способностью почек [40].
При сочетании ИБС с ФП и/или ТЭЛА может быть назначена ДАТ, а в некоторых случаях ТАТ. Соответственно, и риск кровотечений может увеличиваться более чем в 2 раза [42]. Таким пациентам, длительно использующим ПОАК совместно с АСК/ДАТ, особенно при зарегистрированном ЖКК в анамнезе, следует назначать ИПП для снижения риска повторного ЖКК из верхних отделов ЖКТ [28]. А принимая во внимание риск развития именно кишечных кровотечений на фоне приема ОАК, лечение ИПП рекомендовано сочетать с ребамипидом как минимум в течение 3 месяцев [28]. Назначение ребамипида рекомендовано на весь период приема ОАК [28]. Прием ИПП возможен в поддерживающей дозе и далее по требованию. Однако при некоторых показаниях (эрозивный эзофагит, профилактика язв или кровотечений, связанных с приемом НПВС) использование ИПП может продолжаться неопределенно долго [43].
При наличии соответствующих показаний апиксабан является препаратом выбора среди ПОАК. Проведенные исследования показали, что апиксабан реже приводил к ЖКК по сравнению с ривароксабаном и дабигатраном. Более того, апиксабан продемонстрировал более низкий риск относительно крупных кровотечений, включая как ЖКК, так и внутричерепные кровотечения [28, 44].
Реализация концепции защиты ЖКТ пациентов, получающих АТТ, в реальной клинической практике
В 2021–2022 гг. в РФ было проведено многоцентровое кросс-секционное (одномоментное) фармакоэпидемиологическое исследование, в которое был включен 661 пациент (310/46,8% мужчин, 351/53,0% женщин), принимающий ПОАК [45]. В исследовании приняли участие 26 научных центров (13 амбулаторных центров и 13 стационаров) из 15 городов России. По результатам анализа сопутствовавщих заболеваний и структуры лекарственных назначений было выявлено, что 61,6% пациентов имели в анамнезе заболевание ЖКТ, среди которых превалировали заболевания желудка (54,8%), пищевода (33,8%) и кишечника (32,2%). Среди самых распространенных нозологий выявлены гастроэзофагеальная рефлюксная болезнь (41,9%), эзофагит (41,9%), хронический гастрит неуточненной этиологии (26,7%), атрофический гастрит (16,8%) и язвенная болезнь желудка (12,9%). В отношении 1,2% пациентов известно о ЖКК в анамнезе, а 38,4% имели высокий риск развития ЖКК [45]. При этом только 57,1% пациентов получали гастропротекторное лечение: лидирующую роль заняли ИПП – 80,2%, затем ребамипид – 27,8%. Монотерапию гастропротектором получали 337 пациентов (89,2% пациентов из тех, кому была назначена гастропротекторная терапия), а комбинированную терапию (2 и более гастропротектора) – 41 (10,8%) пациент.
Группе пациентов с высоким риском кровотечений из ЖКТ гастропротекторы назначались только в 47,6% случаев. Преимущество также отдавали ИПП (85,9%) и ребамипиду (25,6%). Среди ИПП чаще всего принимали омепразол (69,2%). Необходимо обратить внимание, что 37,5% пациентов с ЖКК в анамнезе вовсе не получали никаких препаратов для защиты ЖКТ.
Снижение риска кровотечений у пациентов высокого риска, получающих ПОАК, – фокус на сочетание ФП и ИБС
Сосуществование двух заболеваний (ФП и ИБС) – значимая проблема для пациента, вытекающая из общих патогенетических механизмов и факторов риска, приводящая к ухудшению прогноза. Распространенность ИБС среди пациентов с ФП варьируется от 17,0 до 46,5% [46]. Частота ОКС среди пациентов с ФП выше, чем в общей популяции: так, в исследовании REGARDS (The REasons for Geographic and Racial Differences in Stroke) ФП была независимо ассоциирована с 2-кратным повышением риска развития ИМ (ОР=1,96; 95% ДИ: 1,52–2,52) [3].
И наоборот, по данным мета-анализа (109 исследований, 8 239 364 пациента), общая распространенность ФП среди пациентов с ОКС составила 11,3%, а ранее существовавшая ФП и впервые диагностированная ФП – 5,8 и 7,3% соответственно. Впервые выявленная ФП была статистически значимо ассоциирована с развитием инсульта (скорректированное отношение рисков [сОР]=2,15), больших кровотечений (сОР=2,93), острой сердечной недостаточности (сОР=3,20), рецидивирующего течения острого ИМ (сОР=1,96) и смерти от любой причины (сОР=1,80) в краткосрочной перспективе; c повышенным риском сердечной недостаточности (сОР=2,21), инсульта (сОР=1,75), смерти от любой причины (сОР=1,67), сердечно-сосудистой смертности (сОР=2,09), внезапной сердечной смерти (сОР=1,53) и в целом различных неблагоприятных сердечно-сосудистых событий (комбинированная конечная точка, сОР=1,54) в долгосрочной перспективе (более 1 месяца), p<0,05 во всех случаях [47].
Помимо вышеперечисленных неблагоприятных сердечно-сосудистых событий сочетание ФП и ИБС повышает риск кровотечений, в т.ч. ЖКК, за счет сочетания антикоагулянтной и антиагрегантной терапии [48, 49]. Это создает необходимость подробнее изучать данную когорту пациентов для оптимизации стратегий лечения и профилактики.
Мы провели когортное ретроспективное исследование, в рамках которого отобрали истории болезни 342 пациентов в возрасте 65 лет и старше с сочетанием ФП и ИБС, проходивших стационарное лечение в кардиологическом отделении многопрофильного стационара (плановый канал госпитализации) Москвы, в период с 01.07. 2018 по 30.06.2019.
Медиана возраста пациентов составила 85 (78–90) лет, что говорит не просто о пожилом возрасте, а о преобладании старческого контингента, из них 68,7% женщин и 31,3% мужчин. Средний балл по HAS-BLED составил 2 [2, 3], а средний балл по CHA(2)DS(2)-VASc – 6 (5–7); 100% пациентов имели высокий риск тромбоэмолических осложнений (балл по CHA(2)DS(2)-VASc ≥3 баллов для женщин и ≥2 баллов для мужчин), а 124 (36,3%) – высокий риск кровотечений (≥3 баллов по HAS-BLED) [50].
Однако при анализе назначений выявлено, что 77 (22,5%) пациентов не получали антикоагулянтной терапии в момент нахождения на стационарном лечении. А при назначении антикоагулянтов врачи отдавали предпочтение ривароксабану (204/59,6% пациентов), 22 (6,4%) пациента получали варфарин, столько же – дабигатран и всего 17 (5,0%) пациентов – апиксабан, хотя именно этот антикоагулянт имеет наиболее высокий профиль безопасности, в частности, в отношении ЖКК [51]. В целом выбор в сторону ПОАК был сделан в отношении 243 (71,1%) пациентов.
Далее мы проанализировали использование антиагрегантной терапии, поскольку критерием включения в исследование было наличие ИБС (как стабильного течения, так и острых состояний). Антиагрегантную терапию получал 51 (14,9%) пациент, в подавляющем большинстве АСК – 46 (13,5%) пациентов, 7 (2,0%) человек получали клопидогрел и 1 (0,3%) – тикагрелор. Всего 1 (0,3%) пациент принимал ДАТ, а 2 (0,6%) – ТАТ.
В структуре заболеваний ЖКТ наиболее распространенной патологией являлся хронический гастрит, диагностируемый у 153 (44,7%) пациентов, за ним следуют заболевания поджелудочной железы у 77 (22,5%), заболевания печени и желчевыводящих путей обнаружены у 58 (17,0%) , а язвенная болезнь желудка и/или двенадцатиперстной кишки у 54 (15,8%) пациентов.
Таким образом, более половины пациентов нуждались в осуществлении гастропротективной терапии для лучшей переносимости показанной АТТ. В действительности гастропротекторы назначались крайне редко (ИПП в 17,3% случаев, табл. 1), в особенности ребамипид, который защищает слизистую оболочку всего ЖКТ. Лишь около 1/5 пациентов защищены от возможного пагубного влияния антитромботиков на слизистую оболочку ЖКТ. Подробные данные представлены в табл. 1.

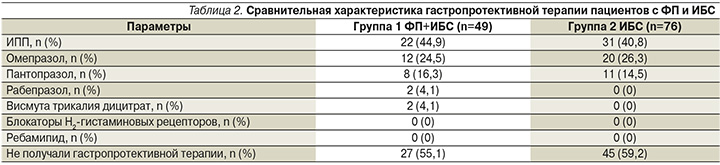
В рамках проспективного исследования мы также осмотрели 125 пациентов, находившихся на амбулаторном наблюдении на кафедре терапии и полиморбидной патологии им. акад. М.С. Вовси ФГБОУ ДПО РМАНПО Минздрава РФ с ИБС (перенесших ОКС менее 1 года до визита) после проведения ЧКВ со стентированием. Первую группу составили пациенты с сочетанием ФП и ИБС (49 пациентов), принимавших комбинированную терапию ПОАК+клопидогрел. Из них ривароксабан был назначен 26 (53,1%) пациентам, апиксабан – 23 (46,9%) . Во 2-ю группу были включены 76 пациентов с ИБС на ДАТ АСК+клопидогрел. В обеих группах преобладали мужчины (77,6 и 71,1% соответственно). Медиана возраста пациентов из 1-й группы составила 69 (69–70) лет, из 2-й – 64 (63–65) года.
Среди заболеваний ЖКТ в этих группах также лидировали хронический гастрит – 19 (18,4%) и 13 (17,1%) пациентов, а также язвенная болезнь желудка и двенадцатиперстной кишки – 2 (4,1%) и 5 (6,6%) пациентов соответственно.
Гастропротекторная терапия в виде изолированного применения ИПП была назначена менее чем половине пациентов (22/44,9 и 31/40,8% соответственно). В обеих группах предпочтение отдавали омепразолу (22/24,5% и 20/26,3% пациентов), на 2-м месте пантопразол (8/16,3 и 11/14,5% пациентов соответственно), 2 (4,1%) пациентам из группы ФП и ИБС был назначен рабепразол.
В группе ФП+ИБС средний балл по шкале HAS-BLED составил 2 (2–3), а с высоким риском кровотечений (≥3 баллов по HAS-BLED) выявлены 19 (38,78%) пациентов. У всех пациентов риск тромбоэмолических осложнений по шкале CHA(2)DS(2)-VASc оказался высоким, а средний балл составил 4 (3–4). Двум пациентам с известным ЖКК в анамнезе, двум с постоянным приемом НПВС и пяти пациентам, периодически прибегавшим к использованию НПВС, был назначен только ИПП в виде монотерапии.
С учетом высокого риска тромбоэмболических и ишемических осложнений все вышеперечисленные пациенты нуждаются в длительном приеме ДАТ. Однако для снижения риска ЖКК гастропротективная терапия в обеих группах в подавляющем большинстве отсутствовала (27/55,1 и 45/59,2% пациентов соответственно) или ограничивалась монотерапией ИПП даже среди пациентов высокого риска (табл. 2).
Возможности ребамипида в защите слизистой оболочки ЖКТ у пациентов, получающих АТТ
Желудочная слизь образует непрерывный слой слизистого геля, покрывающего всю слизистую оболочку желудка, и играет важную роль в механизме защиты желудка от различных условно повреждающих агентов, таких как соляная кислота, пепсин. Распространенным побочным эффектом при использовании АСК является повреждение слизистой оболочки желудка. АСК может ингибировать активность ЦОГ-1 и ЦОГ-2, снижать синтез простагландинов и тем самым ослаблять действие слизистого барьера желудка. Активные метаболиты клопидогрела в свою очередь могут подавлять синтез ангиогенных факторов, тем самым препятствуя заживлению поврежденной слизистой оболочки желудка. Одним из основных механизмов защиты желудка, обеспечиваемых ребамипидом, является увеличение секреции желудочной слизи, что может быть обусловлено не только следствием стимуляции выработки эндогенных простагландинов в слизистой оболочке ЖКТ, но и прямым влиянием на секрецию желудочной слизи [52]. Помимо повышения концентрации простагландинов ребамипид увеличивает синтез гликопротеинов, активирует эпидермальный фактор роста и экспрессию его рецепторов, оказывает противовоспалительное действие.
В проведенном исследовании ребамипид оказывал положительное влияние на проницаемость слизистой оболочки тонкой кишки путем укрепления системы межклеточных плотных контактов. Ребамипид поддерживает плотные контакты клеток эпителия с помощью экспрессии белков плотных межклеточных соединений окклюдина и клаудина. При сохранении функции данной системы, клеточной полярности происходит контроль диффузии молекул через эпителиальный барьер и поддержание адгезии клеток. С учетом вышеперечисленных механизмов действия акцент в отношении применения ребамипида направлен на пациентов, принимающих ОАК совместно с антиагрегантами (в т.ч. АСК) и/или НПВС [53]. Помимо профилактирования кровотечений ребамипид может уменьшать выраженность ЖКК, что коррелирует с увеличением кровотока слизистой оболочки желудка и содержания простагландина Е2 [54].
В России первым препаратом ребамипида, а также наиболее изученным и референтным является является Ребагит® (ПРО.МЕД.ЦС Прага а.о.). В раннее проведенном рандомизированном двойном слепом перекрестном исследовании ребамипид зарекомендовал себя в качестве эффективного гастропротектора, уменьшив повреждение слизистой оболочки желудка у людей, принимавших высокие дозы АСК (>150 мг/сут) [55].
В более современных исследованиях изучена эффективность и безопасность применения ребамипида для пациентов кардиологического профиля, требующих длительного приема АСК в малых дозах и/или других антитромботических ЛС [56–60]. Так, в рандомизированном двойном слепом плацебо-контролируемом исследовании сравнили влияние на слизистую оболочку желудка здоровых добровольцев двух стратегий терапии: АСК в дозе 81 мг/сут в комбинации с плацебо или ребамипидом в дозе 300 мг 3 раза в сутки в течение 7 дней.
Критериями включения были отсутствие заболеваний ЖКТ (эрозии, эритема, кровотечения и язвы при эндоскопии) и отрицательный результат 13C-уреазного дыхательного теста. Средний возраст 20 испытуемых (15 мужчин и 5 женщин) составил 24±2 года. Эндоскопическое повреждение слизистой оболочки желудка определялось в антральном отделе, теле и своде желудка и было разделено на эритему, эрозии и петехии. Эритема определялась как покраснение слизистой оболочки желудка (более выраженное, чем окружающая слизистая оболочка), петехия – как кровоточащая область без дефекта слизистой, а эрозия – как область с дефектом слизистой оболочки. Повреждения слизистой оболочки желудка, выявленные при эндоскопии, оценивали по шкале Ланца. В группе ребамипида выявлено статистически значимо (p=0,039) меньшее число случав развития эритем в антральном отделе желудка. Частота возникновения эрозий и петехий в группах плацебо и ребамипида достоверно не различалась [57].
В связи с увеличивающейся частотой назначения ДАТ особый интерес представляют исследования, включившие пациентов на комбинированной терапии. Одним из таких примеров является рандомизированное двойное слепое плацебо-контролируемое исследование [58], в котором приняли участие 32 здоровых добровольца для определения гастропротективных свойств ребамипида на фоне приема АСК в низких дозах в монотерапии или в комбинации с клопидогрелом.
К участию в исследовании допускались мужчины в возрасте 24–40 лет, показавшие нормальные результаты физикального обследования и лабораторных показателей. Критериями исключения были наличие заболеваний (опухоли, язвы, язвенные рубцы или кровотечения в верхних отделах ЖКТ); наличие в анамнезе язв, операций на желудке или кровотечения из ЖКТ; уровень гемоглобина менее 13 г/дл и лица с аллергией на АСК. Степень повреждения слизистой оболочки желудка оценивали в соответствии с модифицированной шкалой Ланца по шести категориям от 0 до 5: 0 класс – отсутствие эрозии/кровоизлияния; 1-й класс – 1–2 очага эрозии и/или кровоизлияния, локализованных в одной области желудка; 2-й – 3–5 очагов эрозии и/или кровоизлияний, локализованных в одной области желудка; 3-й – 6–9 эрозий и/или кровоизлияний, локализованных в одной области желудка, или не более 10 поражений в двух областях желудка; 4-й – эрозии и/или кровоизлияния в трех областях желудка или не менее 10 поражений во всем желудке; 5-й класс – язва желудка, определяемая как дефект слизистой оболочки более 5 мм в диаметре. Эндоскопические исследования были сохранены в базу данных и оценивались независимо двумя эндоскопистами по модифицированной шкале Ланца. Всем испытуемым выполняли эзофагогастродуоденоскопию с биопсией для диагностики и оценки инфекции H. pylori с помощью быстрого уреазного теста. Субъективные симптомы оценивали с помощью валидированного гастроэнтерологического опросника GSRS (Gastrointestinal Symptom Rating Scale). Опросник включает 15 пунктов и использует 7-балльную шкалу Лайкерта с общим диапазоном значений от 15 до 105, где наивысший балл (7) представляет наиболее выраженный симптом, а наименьший (1) – отсутствие симптомов. Пункты разделены на 5 шкал, представляющих собой рефлюкс-синдром, абдоминальную боль, диспепсию, диарейный синдром и синдром запора. Было выявлено, что ребамипид значительно снижал выраженность повреждения слизистой оболочки желудка. Так, в группах плацебо (плацебо+АСК 100 мг и АСК+клопидогрел+плацебо) отмечено статистически значимое снижение числа баллов по модифицированной шкале Ланца в конце периода наблюдения (14 дней) по сравнению с исходными данными (p<0,05 и p<0,01 соответственно), тогда как в группах приема ребамипида (ребамипид+АСК либо ребамипид+АСК+клопидогрел) в конце периода наблюдения значимого уменьшения числа баллов по модифицированной шкале Ланца не наблюдалось. Авторы сделали вывод: ребамипид может быть использован для первичной профилактики повреждения слизистой оболочки желудка, вызванной использованием монотерапии АСК в низких дозах, а также при двойной антиагрегантной терапии [58].
В другом рандомизированном двойном слепом плацебо-контролируемом исследовании, проведенном R. Pittayanon et al. [59], изучалось протективное действие ребамипида на слизистую оболочку верхних отделов ЖКТ у пациентов (n=95), длительно (≥1 года) получавших двойную антиагрегантную терапию (АСК+клопидогрел/цилостазол/тикагрелор), после проведения ЧКВ. Пациенты, принимавшие ИПП, в исследование не включались. В течение 12-месячного периода наблюдения дефекты слизистой оболочки верхних отделов ЖКТ развились у 43,3% пациентов, принимавших ребамипид, и у 65,5% пациентов группы плацебо (р=0,07), у 6,7% больных из группы ребамипида и 27,6% из группы плацебо выявлены пептические язвы ≥5 мм (р=0,03). Кровотечений и болей в грудной клетке в процессе проведения исследования выявлено не было. Таким образом, пациентам, длительно получающим двойную антиагрегантную терапию, применение ребамипида позволяет предотвращать появление пептических язв желудка [56, 59].
Еще в одном недавнем исследовании изучили 360 пациентов старше 60 лет (284 мужчины, 6 женщин, средний возраст – 70,2±5,5 года) после проведения ЧКВ. Все пациенты были разделены на 4 группы: контрольная группа (90 пациентов) получала лечение АСК 100 мг+клопидогрел, группа рабепразола (90 пациентов) – АСК 100 мг+клопидогрел+рабепразол 20 мг/сут, группа ребамипида (90 пациентов) – АСК 100 мг+клопидогрел+ребамипид 100 мг 3 раза в сутки за 30 минут до еды; и наконец, группа рабепразол+ребамипид (90 пациентов) – АСК 100 мг +клопидогрел+рабепразол+ребамипид в тех же дозах. Пациенты принимали указанное лечение с первого послеоперационного дня в течение 6 месяцев. В период всего наблюдения оценивали как ЖКК, так и основные неблагоприятные сердечно-сосудистые события, включая сердечно-сосудистую смерть и повторный ИМ, при котором требовалась реваскуляризация с проведением повторного ЧКВ или шунтирования коронарных артерий.
В результате в контрольной группе частота возникновения кровотечений из верхних отделов ЖКТ была значительно выше, чем в группе рабепразола (р=0,044; <0,05) и в группе рабепразол+ребамипид (р=0,005; <0,05). Более того, в группе контроля чаще возникали тяжелые кровотечения (4,4%) по сравнению с группой рабепразол+ребамипид (0%).
В данном исследовании дополнительное применение рабепразола в сочетании с ДАТ после проведения ЧКВ у пожилых пациентов с ИБС помогло значительно снизить частоту и тяжесть кровотечений из верхних отделов ЖКТ. Более того, комбинация рабепразола и ребамипида может оказывать синергический эффект ЛС, что помогло еще больше снизить частоту ЖКК [54].
Использование ребамипида оправданно и при профилактике поражений ЖКТ, обусловленных приемом ПОАК. Так, в многоцентровом проспективном открытом рандомизированном наблюдательном сравнительном исследовании в параллельных группах [60] приняли участие 309 пациентов с ФП, которым впервые был назначен дабигатран. Побочные эффекты со стороны ЖКТ оценивали с помощью опросника GOS (Global Overall Severity). Пациенты, набравшие по шкале GOS ≥3 баллов, были рандомизированы для получения 4-недельного курса ИПП, антагониста Н2-рецепторов или ребамипида. Частота развития диспепсии на фоне терапии дабигатраном составила 17,2% (53/309; 95% ДИ: 13,1–21,8%). На фоне приема ИПП, блокаторов Н2-гистаминовых рецепторов или ребамипида в конце периода наблюдения (4 недели) большинство пациентов (83–100%) сообщили, что симптомы улучшились после проведенного лечения (оценка GOS≤2), при этом ребамипид оказался не менее эффектвным, чем кислотподавляющие ЛС [56, 60].
Кроме того, антитромбоцитарные ЛС могут вызывать побочные эффекты, такие как дискомфорт в животе, что может снижать приверженность пациента регулярному приему ЛС, тем самым увеличивая риск повторных сердечно-сосудистых и цереброваскулярных событий. В одном из мета-анализов лечение с использованием ребамипида также было ассоциировано с уменьшением симптомов диспепсии на 23% по сравнению с плацебо/кислотоснижающими ЛС (ОР=0,77, 95% ДИ: 0,64–0,93; р<0,001; I2=21%) [61].
Заключение
Обобщая вышесказанное, профилактика повреждения слизистой оболочки ЖКТ и ЖКК имеет решающее значение для длительной АТТ у кардиологических пациентов. Проведенные анализы лекарственных назначений по-прежнему свидетельствуют о необходимости повышения осведомленности как врачей отделений стационаров, так и работников амбулаторного звена. Совместное применение ребамипида и ИПП в качестве гастропротективной терапии при приеме ПОАК, особенно в составе ДАТ и/или с НПВС, может снижать риск ЖКК. А с другой стороны, улучшать симптомы со стороны ЖКТ (например, изжогу, желудочно-пищеводный рефлюкс, дискомфорт в животе), чтобы повышать приверженность пациентов проводимому лечению, что имеет огромное значение для предотвращения возникновения неблагоприятных сердечно-сосудистых событий.
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы В.А. Де: «Персонализация антитромботической терапии пациентов с ишемической болезнью сердца и неклапанной фибрилляции предсердий»; и диссертационной работы А.В. Дубининой: «Персонализация антикоагулянтной терапии у пациентов с фибрилляцией предсердий, перенесших острый коронарный синдром».



