Введение
Пародонтит – заболевание зубочелюстной системы, характеризующееся развитием острого или хронического воспалительного процесса, деструкцией тканей пародонта и атрофией костной ткани альвеол [1]. По данным Всемирной организации здравоохранения (ВОЗ), заболеваниями полости рта страдают почти 3,5 млрд человек [2]. Среди стоматологической патологии хронические воспалительные заболевания пародонта (гингивит, пародонтит) занимают после кариеса 2-е место по распространенности. Признаки хронического воспаления десен отмечаются более чем у 60% населения европейских стран и примерно у 50% населения США [3]. Американская академия пародонтологии рассматривает пародонтит как воспалительное заболевание бактериального происхождения [4].
Артериальная гипертензия (АГ) – наиболее распространенное сердечно-сосудистое заболевание (ССЗ) в мире, и, по данным ВОЗ, ею страдают 1,28 млрд взрослых в возрасте 30–79 лет во всем мире, две трети которых живут в странах с низким и средним уровнями дохода. В 2019 г. глобальная стандартизированная по возрасту средняя распространенность АГ среди взрослых в возрасте 30–79 лет составила 34% у мужчин и 32% у женщин. В европейских странах распространенность аналогична: различия и значения между странами ниже среднего в Западной Европе и выше среднего в странах Восточной Европы [5].
АГ и пародонтит являются двумя широко распространенными заболеваниями во всем мире, которые оказывают значительное влияние на осложнения ССЗ. Плохое здоровье пародонта связано с повышенной распространенностью АГ и может влиять на контроль артериального давления (АД) [6].
В предыдущих обзорах мы рассмотрели взаимоотношения патологии пародонта с ССЗ, отметили наличие тесной двунаправленной связи между пародонтитом и ССЗ [3, 7–11], что обусловливает необходимость выяснения при сборе анамнеза возможных стоматологических жалоб и осмотра полости рта при курации интернистами пациентов с ССЗ, метаболическим синдромом (МС), дислипидемией и сахарным диабетом (СД), а при их наличии – направление пациентов на консультацию и лечение к стоматологу. С другой стороны, для повышения эффективности лечения болезней пародонта стоматологу целесообразно для уточнения имеющейся соматической патологии отправить пациента на консультацию и лечение к интернисту.
За последние несколько лет опубликованы результаты крупномасштабных исследований, посвященных изучению взаимосвязи АГ и патологии пародонта, активно обсуждаются возможные механизмы этой связи. С учетом вышеизложенного этот обзор посвящен анализу новых данных о взаимоотношениях между АГ и пародонтитом с использованием электронных информационных баз PubMed и Scopus.
Исследования
Эпидемиологические данные указывают на потенциальную связь пародонтита с повышением уровня АД и распространенностью АГ. Данные из перекрестных исследований позволяют предположить, что при АГ наличие у пациентов пародонтита может увеличивать риск и степень поражения органов-мишеней [12, 13]. Повышение АД у пациентов с патологией пародонта отмечено ранее в ряде исследований [14–20].
На связь активного воспаления десен с АГ указывают результаты исследования, проведенного международной группой, при обследовании 5396 взрослых в возрасте не менее 30 лет [21]. Десневое кровотечение (гингивит; нестабильный периодонтит) было независимо связано с повышением +2,6 мм рт.ст. (р<0,001) систолического АД (САД) по сравнению с отсутствием кровотечения (здоровый пародонт, стабильный пародонтит) и с большей вероятностью (отношение шансов [ОШ]=1,42; 95% доверительный интервал [ДИ]: 1,19–1,68; p<0,001) высокого/неконтролируемого АД. У участников с нестабильным пародонтитом САД было выше, чем у пациентов со стабильным пародонтитом (+2,1 мм рт.ст.; p<0,001) или гингивитом (+5,3 мм рт.ст.; p<0,001). Нестабильный пародонтит и гингивит последовательно ассоциировались с повышенным риском высокого/неконтролируемого АД (ОШ=1,65; 95% ДИ: 2,14–1,82; ОШ=1,49; 95% ДИ: 1,22–1,82 соответственно).
Британское исследование «случай–контроль» включило 250 участников с пародонтитом и 250 без пародонтита [22]. Отмечено, что среднее САД выше на 3,36 мм рт.ст. (95% ДИ: 0,91–5,82; р=0,007) и среднее диастолическое АД (ДАД) выше на 2,16 мм рт.ст. (95% ДИ: 0,24–4,08; р=0,027) при наличии пародонтита.
В лонгитюдном когортном исследовании, включившем 244 393 участника британского биобанка, было продемонстрировано аддитивное влияние пародонтита с АГ на риск системного заболевания и смертности [23]. Средний возраст исследуемой популяции составил 55,4 года (стандартное отклонение – 8,1 года), 130 220 (53,3%) участников были женщинами. В начале исследования 131 566 (53,8%) участников страдали АГ, 4,5% сообщили о патологии пародонта. Показатели заболеваемости всеми системными заболеваниями были выше у участников с АГ, чем у негипертоников с тем же пародонтальным статусом. У пациентов с АГ наблюдался аддитивный эффект при наличии патологии пародонта на риски ССЗ (скорректированный относительный риск [ОР]=1,35, 95% ДИ: 1,21–1,53) и респираторных заболеваний (ОР=1,11: 95% ДИ: 0,95–1,30) по сравнению с группой с нормальным давлением.
В немецком исследовании, включившем 5934 участника с полным обследованием пародонта и данными об АД [24], вероятность АГ значительно увеличивалась вместе с тяжестью пародонтита (ОШ для тяжелого пародонтита=2,19; 95% ДИ: 1,85–2,59; p<0,001; ОШ при пародонтите средней тяжести=1,65; 95% ДИ: 1,45–1,87; p<0,001). Участники с умеренным или тяжелым пародонтитом также имели значительно более высокие шансы АГ с поправкой на возраст и пол, которые были немного ослаблены при дополнительной поправке на индекс массы тела (ИМТ), диабет, курение, уровень образования и потребление алкоголя (ОШ для тяжелой формы пародонтита=1,28; 95% ДИ: 1,04–1,59; p=0,02; ОШ для умеренной степени тяжести пародонтита=1,30; 95% ДИ: 1,11–1,52; p=0,001). Доля участников с недостаточно леченой АГ (нелеченая и плохо контролируемая гипертензия) была значительно выше у участников с тяжелым пародонтитом, чем у пациентов с отсутствием/легким пародонтитом (50,1 против 37,4% для отсутствия/легкого пародонтита). Авторы также отметили, что недостаточное лечение АГ чаще встречалось у людей с тяжелым пародонтитом по сравнению с пародонтально более здоровыми людьми.
В южнокорейском исследовании 104 349 участников были отобраны из когорты национальной системы медицинского страхования – скрининга здоровья (NHIS-HEALS) [25]. Средний возраст участников составлял 51,1 года (диапазон – 40–79 лет) на исходном уровне, 55,1% были мужчинами. В общей сложности выявлено 52 855 случаев АГ в течение среднего периода наблюдения 9,6 года. Среди участников пародонтит (ОР=1,02; 95% ДИ: 1,00–1,04) был достоверно связан с частотой АГ после полной коррекции ковариат. Эта связь была более выраженной (ОР=1,04; 95% ДИ: 1,02–1,06) в группе среднего возраста (40–64 года).
В совместном исследовании ученых из Турции и Финляндии продемонстрировано, что тяжесть и скорость прогрессирования пародонтита могут быть независимыми факторами риска АГ [26]. Были обследованы 7008 пациентов, средний возраст – 31,0 год; 60,1% (n=4211) составили женщины. АГ диагностирована у 6,2% (n=435) пациентов. Как стадия, так и степень пародонтита различались (p<0,001) у пациентов с АГ или без нее. Увеличение тяжести заболеваний пародонта было связано с увеличением риска АГ на 20% (ОШ=2,63; 95% ДИ: ,48–4,68; p<0,001) при пародонтите IV стадии. Увеличение скорости прогрессирования пародонтита было связано с повышением риска АГ на 35%; (ОШ=2,22; 95% ДИ: 1,45–3,40; p<0,001) при пародонтите степени С.
Связь между пародонтитом и АГ продемонстрирована в перекрестном исследовании четвертого национального обследования здоровья полости рта в Китае (2015–2016) [27]. В исследование были включены лица в возра-сте 35–44 (n=4409), 55–64 (n=4568) и 65–74 лет (n=4218). Тяжелый пародонтит (III и IV стадий) присутствовал у 41,4% лиц с АГ и у 28,0% лиц с нормотензией соответственно (р<0,001). Распространенность тяжелого пародонтита была выше у лиц с АГ, чем у лиц с нормотензией, среди участников в возрасте 35–44 (18,0 против 10,1%; p<0,001) и 55–64 лет (40,2 против 36,7%; p=0,035), но не у участников в возрасте 65–74 лет (46,4 против 45,1%; p=0,429). Таким образом, разница в пародонтальном статусе между лицами с АГ и с нормотензией уменьшалась с возрастом.
В испанском перекрестном исследовании установлена связь пародонтита с субклиническим церебральным и каротидным атеросклерозом у пациентов с АГ [28].
Обзоры и мета-анализы
В Кокрановском обзоре [29], опубликованном в 2020 г., отмечено, что диагнозы пародонтита средней и тяжелой степеней тяжести (ОШ=1,22; 95% ДИ: 1,10–1,35) и тяжелой формы (ОШ=1,49; 95% ДИ: 1,09–2,05) были связаны с АГ. Проспективные исследования показали, что диагноз пародонтита увеличивает вероятность возникновения АГ (ОШ=1,68; 95% ДИ: 0,85–3,35). У пациентов с пародонтитом наблюдалось более высокое среднее САД (взвешенная разность средних [ВРС]=4,49 мм рт.ст., 95% ДИ: 2,88–6,11) и ДАД (ВРС=2,03 мм рт.ст., 95% ДИ: 1,25–2,81). Аналогичные результаты получены в систематическом обзоре и мета-анализе международной группы ученых, опубликованном в том же году [30].
Китайскими учеными был проведен количественный систематический обзор для изучения связи между потерей зубов и АГ [31]. Из 56 отобранных исследований 28 исследований из 16 разных стран с участием 1 224 821 человека соответствовали критериям для систематического обзора. После поправки на смешанные факторы люди с потерей зубов имели более высокий риск развития АГ (ОШ=1,20; 95% ДИ: 1,10–1,30). Что касается риска АГ при потере зубов, то лица с АГ по-прежнему имели более высокий риск потери зубов (ОШ=1,35; 95% ДИ: 1,07–1,62).
Таким образом, прослеживается потенциальная связь патологии пародонта с повышением уровня АД и распространенностью АГ. Вместе с тем в рекомендациях Европейского общества кардиологов/Европейского общества артериальной гипертензии (ESC/ESH) 2018 г. [32], российских клинических рекомендациях 2020 г. [33], рекомендациях Европейского общества артериальной гипертензии (ESH) 2023 г. [5] эта связь не рассматривается.
Во многом это объясняется сложившимся отдаленным и изолированным местом стоматологии по сравнению с остальными специальностями, а также восприятием пародонтита исключительно как стоматологическое заболевание. Первая попытка объединения была предпринята греческими кардиологами [12]. Они отметили, что возможный патогенетический фон влияния пародонтита на АД должен включать системную генерализацию местного воспаления полости рта, роль иммунного ответа хозяина, прямое микробное воздействие на сосудистую систему и изменения функции эндотелия. При этом нельзя исключать и концепцию неблагоприятного влияния АГ на ткани пародонта. Ими предложен термин «стоматологическая гипертензия» (dental hypertension).
В Консенсусе по пародонтиту и атеросклеротическим ССЗ, опубликованном в American Journal of Cardiology и Journal of Periodontology, рекомендуется информировать пациентов с умеренным и тяжелым пародонтитом о возможном повышенном риске ССЗ и необходимости пройти кардиологическое обследование [34].
В 2021 г. Итальянское общество артериальной гипертензии (SIIA) и Итальянское общество пародонтологии и имплантологии (SIdP) объединили усилия (Hy-Per Group) и опубликовали совместный отчет о связи между АГ и пародонтитом [35, 36]. Основную цель отчета эксперты обозначили как необходимость повышения осведомленности о тесной связи между этими двумя состояниями. В 2023 г. опубликовано дополнение к отчету [37, 38], базовые положения которого содержат 4 пункта: 1) крупные эпидемиологические исследования подчеркивают, что люди с заболеваниями пародонта имеют повышенный риск высокого/неконтролируемого АД независимо от сопутствующих факторов; 2) системное воспаление низкой степени может иметь причинную роль в ассоциации; 3) профилю и контролю АД может помочь лечение патологии пародонта у лиц с предгипертензией и гипертонией; 4) состояние здоровья полости рта должно оцениваться как потенциальный фактор риска высокого/неконтролируемого АД, а эффективный уход за полостью рта должен быть включен в качестве дополнительного показателя образа жизни при лечении АГ.
Лечение коморбидных пациентов (АГ+пародонтит)
В обзоре литературы и клинических исследований, выполненном польскими учеными, отмечается, что наличие патологии пародонта может быть причиной неэффективности антигипертензивной терапии [39], с другой стороны, некоторые интервенционные исследования показали, что лечение пародонтита снижает АД у пациентов с АГ [40–42].
В Кокрановском обзоре [29] также отмечается, что лечение пародонтита может позитивно влиять на лечение АГ. В систематическом обзоре отмечается, что в пяти исследованиях продемонстрировано статистически значимое снижение значений САД в результате пародонтологического лечения [43]. В систематическом обзоре и мета-анализе, включившем 8 рандомизированных клинических исследований (РКИ), международной группы ученых при общей оценке эффекта пародонтологического лечения было отмечено снижение САД (ВРС=-4,3 мм рт.ст., 95% ДИ: -9,10, -0,48; р=0,08) и ДАД (ВРС=-3,16 мм рт.ст., 95% ДИ: -6,51, -0,19; р=0,06) соответственно [44]. При сравнении результатов лечения в группах интенсивного и традиционного лечения пародонтита получено статистически значимое снижение САД (ВРС=-11,41 мм рт.ст., 95% ДИ: 13,66, -9,15; p<0,00001) и ДАД (ВРС=-8,43 мм рт.ст., 95% ДИ: -10,96, -5,91; p<0,00001) в группе интенсивного лечения.
Определенное влияние на состояние пародонта могут оказывать и лекарственные препараты, применяемые в лечении заболеваний АГ. К наиболее значимым негативным для пародонта побочными эффектами блокаторов кальциевых каналов (БКК; нифедипин, амлодипин, лацидипин, нимодипин, верапамил, дилтиазем и др.) относятся гиперплазия десен (кровоточивость, болезненность, отечность) и гипертрофический гингивит [45–47].
В когортном иранском исследовании [48] среди антигипертензивных препаратов (АГП) наиболее часто ксеростомия была связана с приемом БКК – 31,1%. Турецкие кардиологи и пародонтологи оценили частоту возникновения лекарственно-индуцированной гиперплазии десен у пациентов с АГ [49]. Наиболее часто этот побочный эффект отмечен у пациентов, принимавших БКК: 19,6%, реже – при приеме блокаторов рецепторов ангиотензина II (БРА): 12,5% и ингибиторов ангиотензинпревращающего фермента (ИАПФ): 7,5%. При подгрупповом анализе БКК лекарственно-индуцированная гиперплазия десен встречалась при приеме амлодипина –31,8%.
Первый случай гиперплазия десен при приеме нифедипина описан израильскими учеными в 1984 г. [50].
В опубликованном в 2022 г. обзоре международной группы ученых [51] авторы провели широкий поиск за 1980–2021 гг. в электронных базах данных PubMed Central, Scopus, Cochrane и SciELO. Первоначально отобрано 293 публикации: авторы отмечают, что проблема лекарственно-индуцированной гиперплазии десен освещена в медицинской литературе и эту возможность должны учитывать стоматологи и кардиологи, а междисциплинарный подход к лечению позволит улучшить его результаты.
В упомянутом совместном отчете Итальянского общества гипертонии и Итальянского общества пародонтологии и имплантологии по АГ и пародонтиту (Hy-Per Group) [37, 38] вопросы лечения АГ у коморбидного пациента (АГ+пародонтит) не рассматриваются.
В рекомендациях ESC/ESH 2018 г. [32] и Российских клинических рекомендациях 2020 г. [33] представлен алгоритм лечения АГ I–II стадий, который подходит большинству пациентов с поражением органов мишеней, а также может быть использован при лечении пациентов с цереброваскулярной болезнью, СД или заболеваниями периферических артерий (см. рисунок).
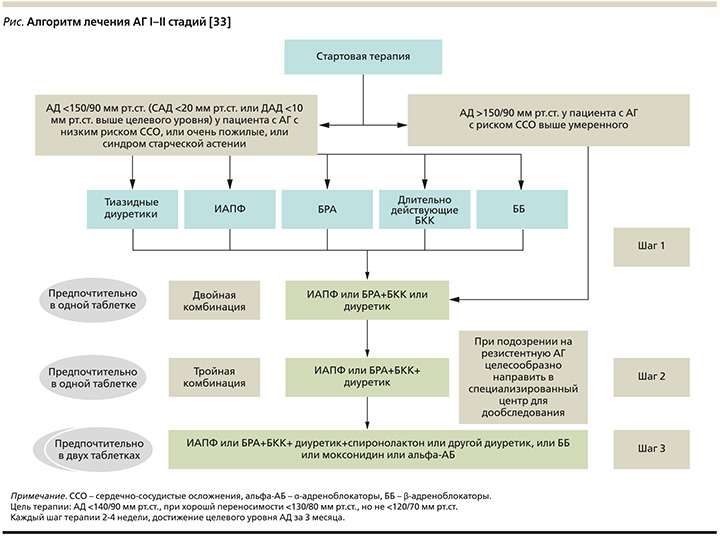
В соответствии с данным алгоритмом пациентам с АД>150/90 мм рт.ст. и риском сердечно-сосудистых осложнений выше умеренного рекомендуется «двойная комбинация» АГП. Одним из составляющих этой комбинации является блокатор ренин-ангиотензин-альдостероновой системы (РААС) – ИАПФ или БРА.
В качестве второго компонента предлагается рассмотреть выбор между БКК и диуретиком. С учетом высокой частоты лекарственно-индуцированной гиперплазии десен у коморбидного пациента (АГ+пародонтит) при использовании БКК в качестве возможного варианта решения этой дилеммы целесообразно рассмотреть диуретик, в частности тиазидоподобный диуретик индапамид.
Диуретики в лечении АГ. Применение диуретиков при АГ патогенетически обосновано, что обусловлено значимой ролью увеличения объема циркулирующей крови и задержки ионов натрия во внутренней среде организма, в АД [52]. Тиазидные и тиазидоподобные диуретики на протяжении более 60 лет (после появления первого препарата этой группы в 1957 г.) входят в число основных классов АГП первой линии антигипертензивной терапии.
В рекомендациях ESC/ESH 2018 г. [32] и Российских клинических рекомендациях 2020 г. [33] выбор диуретика для лечения АГ ограничен тремя препаратами: гидрохлоротиазид (ГХТ), хлорталидон и индапамид.
Ведущее место тиазидные и тиазидоподобные диуретики безусловно занимают в терапии АГ с низкой продукцией ренина, когда на первый план в формировании АГ выходит объем-зависимый патогенетический механизм, связанный с задержкой жидкости в организме, что часто наблюдается у пациентов с МС, СД, пожилого возраста, полиморбидных больных с сопутствующей хронической сердечной недостаточностью и/или хронической болезнью почек со скоростью клубочковой фильтрации ≥30 мл/мин/1,73 м2, а также у представителей негроидной расы [52].
Тиазидные и тиазидоподобные диуретики часто объединяются в единую группу «тиазиды», однако они имеют существенные различия в механизме своего действия, клинических эффектах, профиле лекарственной безопасности, отчасти – в параметрах эффективности контроля АД, а также доказательной базе в РКИ [53]. Так, ГХТ имеет дозозависимый характер влияния на уровень офисного АД, для индапамида такой зависимости не выявлено, а для хлорталидона предполагается наличие как дозозависимого, так и дозонезависимого компонента действия [53].
В РКИ и мета-анализах накоплена обширная доказательная база о позитивном влиянии диуретиков на прогноз в виде снижения риска развития сердечно-сосудистых и цереброваскулярных осложнений [54]. При этом в рекомендациях ESC/ESH (2018) [32] подчеркивается, что тиазидоподобные диуретики превосходят тиазидные в отношении эффективности и прогностической значимости. Так, в мета-анализе китайских кардиологов, которые провели объединенное исследование результатов 19 РКИ [55] с участием 112 113 пациентов (56 802, получавших диуретики, 55 311 в контрольной группе) установлено, что более значимое снижение риска ССЗ (ОШ=0,78; p<0,001), сердечной недостаточности (ОШ=0,57; p<0,001) и инсульта (ОШ=0,82; p=0,016) связано с применением тиазидподобных диуретиков. Однако при сходном влиянии тиазидоподобных диуретиков на снижение цереброваскулярных событий/инсультов и общую смертность хлорталидон увеличивает риск первичной ИБС (ОР=2,0; 95% ДИ: 0,86–4,67) по сравнению с индапамидом (ОР=0,53; 95% ДИ: 0,36–0,77) [53].
Тиазидоподобные диуретики имеют существенно больший период полувыведения по сравнению с тиазидами: для хлорталидона этот показатель составляет 40–60 часов, для индапамида – до 14–24, для ГХТ 6–15 часов [53]. Длительность действия хлорталидона составляет 48–72 часа, для индапамида ≥24, а у ГХТ существенно варьируется, составляя в среднем 16 часов. По результатам суточного мониторирования АД отмечено, что ГХТ в дозе 12,5 мг оказывает антигипертензивное действие преимущественно в дневное время и не влияет на уровень АД в ночные часы, что не позволяет рассматривать монотерапию низкими дозами ГХТ в качестве эффективной терапии АГ [56]. С этим связан недостаточный гипотензивный эффект ГХТ по сравнению с четырьмя другими основными классами АГП как по систолическому, так и по диастолическому АД [57].
Метаболические эффекты диуретиков. В ряде мета-анализов высказываются опасения о том, что терапия диуретиками может приводить к нарушениям электролитного баланса, негативным метаболическим эффектам – нарушениям липидного, пуринового и углеводного обменов, вплоть до повышения риска развития СД 2 типа (СД2). Прежде всего эти опасения относятся к тиазидным и тиазидоподобным диуретикам первого поколения – ГХТ и хлорталидону [58].
В мета-анализах, посвященных оценке клинической эффективности и безо-пасности ГХТ, хлорталидона и индапамида, отмечается, что тиазидоподобные диуретики превосходят ГХТ в снижении АД без увеличения частоты гипокалиемии и гипонатриемии и изменений со стороны показателей углеводного и липидного обменов [59, 60]. В мета-анализе ученых из Тайваня показано, что даже у пациентов, принимавших низкие дозы ГХТ, отмечается существенное повышение уровней глюкозы натощак и гликозилированного гемоглобина, снижение уровня холестерина липопротеидов высокой плотности [61].
Для оценки распространенности гипокалиемии, связанной с приемом ГХТ, американские кардиологи включили в исследование взрослых пациентов в возрасте ≥20 лет из национальной программы NHANES в 1999–2018 гг. [62]. Гипокалиемия отмечена у 12,6% пациентов, принимавших ГХТ, что эквивалентно ~2,0 млн взрослых в США. Более высокий риск гипокалиемии отмечен у женщин (ОШ=2,22; 95% ДИ: 1,74–2,83), у лиц с дефицитом массы тела (ОШ=4,33; 95% ДИ: 1,34–13,95), у пациентов, принимавших ГХТ в течение 5 лет или более (ОШ=1,47; 95% ДИ: 1,06–2,04) и у неиспаноязычных представителей негроидной расы (ОШ=1,65; 95% ДИ: 1,31–2,08).
Те же авторы оценили частоту гипокалиемии у пациентов, принимавших тиазидоподобный диуретик индапамид [63]. В проведенном ими крупном популяционном исследовании с 147 319 человеко-годами наблюдения (всего 62 881 пациент, принимавший индапамид) тяжелая гипокалиемия, требующая госпитализации, была редкостью и отмечена лишь у 509 (0,8%) пациентов. Исследователи отметили, что 53% этих госпитализаций произошло в течение первого года лечения, а половина из них в первый год произошла в течение первых 16 недель. Во время госпитализации смертельных случаев отмечено не было, а средняя продолжительность пребывания в стационаре составила один день. С госпитализацией был связан женский пол (ОШ=1,75: 95% ДИ: 1,45–2,12), связи госпитализации с пожилым возрастом пациентов не отмечено.
Наличие бессимптомной гиперурикемии и подагры как сопутствующего заболевания является абсолютным противопоказанием к применению ГХТ и хлорталидона и относительным противопоказанием к индапамиду [33]. В Кокрейновском обзоре (Cochrane, 2014) при непрямом сравнении влияния диуретиков на уровень мочевой кислоты (МК) продемонстрировано значимо меньшее влияние индапамида по сравнению с ГХТ, особенно хлорталидоном [64].
В нашем исследовании комбинация ИАПФ эналаприла с индапамидом (1-я группа) по сравнению с комбинацией эналаприла с ГХТ (2-я группа) через 3 месяца лечения не только выявила высокую метаболическую нейтральность, но и показала более выраженный эффект в снижении уровня АД и улучшении качества жизни [65]. В первой группе исходный уровень калия в сыворотке крови повысился на 1,7%, уровень глюкозы снизился на 1%, уровень МК повысился на 0,8%. Во 2-й группе исходный уровень калия в сыворотке крови снизился на 7,2%, уровень глюкозы повысился на 8,7%, уровень МК повысился на 4,5%.
К редким, но возможным побочным эффектам тиазидных диуретиков относятся офтальмологические, кожные и пульмонологические, подробно рассмотренные в нашем предыдущем обзоре, в котором диуретики рассматриваются через призму лекарственной безопасности [58]. Так, с приемом ГХТ [66–72] и хлорталидона [73] может быть связано развитие острой транзиторной миопии и острой закрыто-угольной глаукомы.
Связь между приемом ГХТ и повышенным риском развития немеланомного рака кожи (НМРК) – базальноклеточной карциномы (БКлК) и плоскоклеточного рака кожи (ПРК) – продемонстрирована в двух фармакоэпидемиологических исследованиях датских ученых [74, 75]. Применение ГХТ (в суммарной дозе ≥50 000 мг) было связано с ОР=1,29 (95% ДИ: 1,23–1,35) для БКлК и ОР=3,98 (95% ДИ: 3,68–4,31) для ПРК. Риск развития НМРК возрастал при увеличении суммарной (накопленной) дозы ГХТ. При кумулятивной дозе (≥200 тыс. мг ГХТ) для БКлК ОР=1,54 (95% ДИ:1,38–1,71) и для ПРК ОР=7,38 (95% ДИ: 6,32–8,60). При использовании индапамида, напротив, исследователями отмечена отрицательная ассоциация с НМРК [75]. Ассоциация ГХТ с НМРК получила подтверждение в исследованиях и обзорах, выполненных в Португалии [76], Испании [77], Франции [78, 79], Великобритании [80], США [81], Канаде [82], Бразилии [83], Тайване [84]. В исследованиях ученых из Тайваня [84] и США [85] отмечена связь применения ГХТ с развитием меланомы.
В 2023 г. ФГБУ «Научный центр экспертизы средств медицинского применения» со ссылкой на регуляторные органы Австралии, Япония и Канады дало рекомендации производителям лекарственных препаратов, содержащих в своем составе ГХТ, добавить информацию о возможном развитии острого респираторного дистресс-синдрома (ОРДС) [64]. Детальный анализ публикаций о пульмонологических побочных эффектах ГХТ [58] показал, что первые публикации о риске развития ОРДС после приема ГХТ появились еще в 1980-х гг. [87, 88]. В 2007 г. бельгийские кардиологи в обзоре проанализировали 49 клинических случаев [89].
Индапамид: эффективность и безо-пасность. Синтезированный в 1974 г. тиазидоподобный диуретик индапамид не стал мишенью для критических стрел по поводу своей эффективности и безопасности [90–92]. Индапамид оказывает гипотензивное действие на протяжении суток (как в дневное, так и ночное время), а также стабилизирует вариабельность АД, которая тесным образом ассоциирована с развитием сердечно-сосудистых осложнений и прогрессированием поражения органов-мишеней АГ [93]. В дозах, используемых при АГ (0,625–2,5 мг/сут.), индапамид действует прежде всего как артериальный вазодилататор. При его применении в дозе 2,5 мг/сут. суточный объем мочи почти не изменяется. Индапамид благодаря его хорошо документированному позитивному влиянию на сердечно-сосудистые и почечные исходы представляет собой безопасный и ценный вариант лечения пациентов с высоким АД с учетом ассоциирующихся с АГ факторов риска [94].
В мета-анализе 9 РКИ, включившем более 10 тыс. пациентов, показано, что частота побочных эффектов при использовании индапамида сравнима с плацебо (ОР=0,97; 95% ДИ: 0,76–1,22) [95]. В 6-месячном многоцентровом проспективном наблюдательном интрвенционном открытом клиническом исследовании ACES с участием 9124 амбулаторных пациентов авторами отмечена метаболическая нейтральность индапамида, сходная с карведилолом и амлодипином [96].
Индапамид практически не оказывает влияния на метаболические процессы в организме: экскрецию калия, уровни глюкозы, холестерина и МК в крови. Метаболическая безопасность и высокая эффективность применения индапамида в обычной (2,5 мг) и ретардированной формах (1,5 мг), в т.ч. и для проблемных пациентов (с АГ и СД2, МС и у пациентов пожилого возраста), подтверждена результатами международных и российских исследований ADVANCE, HYVET, NESTOR, PROGRESS, АРГУС-2, МИНОТАВР, ЭПИГРАФ и ряда других [92, 97].
На основании результатов 26 РКИ индапамид рассматривается как оптимальный диуретик для применения пациентами с нормолипидемией или гиперлипидемией, поскольку увеличивает уровень холестерина липопротеидов высокой плотности, при этом не повышает уровня холестерина липопротеидов низкой плотности [98].
Таким образом, индапамид, имеющий доказанные органопротективные свойства, – наиболее оптимальный метаболический профиль среди диуретиков, благоприятно влияет на прогноз в рамках сердечно-сосудистого континуума, занимает прочные позиции как в моно-, так и в комбинированной терапии АГ [90–92] и может рассматриваться в качестве препарата выбора у коморбидного (АГ+пародонтит) пациента.
Индапамид одобрен FDA (Food and Drug Administration) для лечения не только первичной гипертензии в качестве монотерапии или в сочетании с другими АГП, но и задержки соли и жидкости, связанной с хронической сердечной недостаточностью [99].
Генерический препарат индапамида – Индап® (PRO.MED.CS Praha a.s., Czech Republic) является единственным генериком индапамида с наличием объективных доказательств терапевтической эквивалентности с двумя формами выпуска оригинального индапамида [100]. Успешный опыт использования препарата Индап® в России на протяжении более 25 лет, данные широкомасштабных проектов с длительным наблюдением пациентов, проведенных практически во всех регионах Российской Федерации и в других странах, свидетельствуют о его метаболической нейтральности, наличии органопротективных свойств и высокой антигипертензивной эффективности, в т.ч. и для проблемных полиморбидных пациентов (с АГ и СД2 или МС, пациентов гериатрической практики). Препарат может эффективно и безопасно применяться как в сочетании с липидснижающими и антигипергликемическими препаратами, так и в комбинации с другими АГП [90–92, 100–104].
Появление на российском фармацевтическом рынке новой формы выпуска препарата Индап®, делимой на 4 равные части (со специальной риской) таблетки индапамида 2,5 мг, способствует удобству его применения и повышению приверженности пациентов лечению. Позволяет врачу в условиях реальной клинической практики титровать индапамид в 4 разных дозах: 0,625 мг, 1,25; 1,875; 2,5 мг и комбинировать его с другими АГП, что способствует профилактике дозозависимых побочных эффектов, за счет возможности постепенного титрования дозы позволяет индивидуализировать подбор минимально эффективной дозы индапамида.
Применение таблетированной формы препарата Индап® с учетом его преимуществ актуально для пациентов старших возрастных групп с наличием ИБС и гемодинамически значимых стенозов брахиоцефальных артерий, перенесших инсульт или транзиторную ишемическую атаку, в постковидном периоде после новой коронавирусной инфекции (COVID-19), для которого характерна нестабильность АД, а также для лечения стоматологической гипертензии.
Заключение
Исследования последних лет, систематические обзоры и мета-анализы подтверждают связь пародонтита и АГ. С учетом широкой распространенности заболеваний пародонта наличие этой патологии следует учитывать при курации пациентов с АГ. В качестве препарата выбора у пациентов со стоматологической гипертензией можно рассматривать тиазидоподобный диуретик индапамид с учетом его эффективности, метаболической нейтральности и безопасности.



