Эпидемиология дефицита железа
До настоящего времени Россия продолжает относиться к странам со значительными проблемами общественного здравоохранения с точки зрения распространенности железодефицита. В данную категорию подпадают регионы с выявленной частотой анемии в популяции более 20%. Дефицит железа (ДЖ) встречается чаще, чем железодефицитная анемия. Согласно результатам наблюдений, проводившихся в течение 2 лет, латентный ДЖ самопроизвольно купируется только у 13,4% пациентов, в 60% случаев сохраняется, в 26,6% трансформируется в манифестную форму ДЖ [1].
Абсолютная распространенность ДЖ зависит от исследуемой популяции. Согласно одному из крупных последних исследований, проведенных в США, распространенность ДЖ составила 15,1±1,7% у детей ясельного возраста, 10,4±0,5% у небеременных женщин и 16,3±1,3% у беременных женщин соответственно. При этом отмечено, что распространенность ДЖ у беременных значительно возрастала с каждым триместром и составляла 5,3±1,5%, 12,7±2,3 и 27,5±3,5% в I, II и III триместрах. Согласно данным других авторов, распространенность ДЖ увеличивается с 7% в I триместре до 24 и 39% во II и III триместрах. Исследования с 2019 по 2022 г. показывают, что частота ДЖ без анемии у беременных может быть даже выше – от 53 до 81% (в зависимости от гестационного возраста при отборе проб и используемых критериев ДЖ). По оценкам Всемирной организации здравоохранения (ВОЗ), более 40% беременностей осложняются анемией. В отчете Специальной программы дополнительного питания США для женщин, младенцев и детей (WIC) за 2022 г. зафиксирован рост распространенности анемии, связанной с беременностью с 10,1% в 2008 г. до 11,4% в 2018 г. [2–4].
К особой группе риска железодефицита относятся женщины репродуктивного возраста. Опубликованные данные литературы свидетельствуют, что доля менструирующих женщин, которые имеют ДЖ в разных регионах, составляет от 20 до 65%.
В Австралии (2018) ДЖ без анемии диагностирован у 29% обследованных, на Ближнем Востоке (2017) распространенность ДЖ у молодых здоровых женщин колебалась от 27 до 47% в зависимости от страны. В исследовании 2008 г. среди здоровых молодых женщин в Италии распространенность ДЖ составляла 27 и 30% у спортсменов и не занимающихся спортом соответственно [5–7].
Стратегии профилактики железодефицитных состояний
Такая высокая распространенность железодефицитных состояний и связанные с ними риски подчеркивают необходимость разработки эффективных и безопасных путей профилактики.
В настоящее время применяются три основные стратегии профилактики дефицита микронутриентов: фортификация, саплементация и пищевая диверсификация. Основной стратегией профилактики железодефицита в репродуктивном возрасте является саплементация – пероральный прием 30 мг железа. Саплементация – наиболее эффективная стратегия, ее используют преимущественно в группах риска, особенно в тех случаях, когда другие стратегии не работают или еще недостаточно налажены.
Однако рекомендованный ВОЗ стандартный подход в виде ежедневного обогащения рациона питания препаратами железа в течение 3 месяцев не всегда оказывается эффективным, в т.ч. в связи с низкой приверженностью предписаниям специалистов по причине побочных эффектов [8]. Основные побочные эффекты при приеме препаратов железа связаны с желудочно-кишечным трактом (ЖКТ): запоры, диарея, тошнота, рвота, металлический вкус во рту.
Согласно данным статистики, до 40% пациентов досрочно прекращают прием препаратов железа из-за побочных эффектов, что диктует поиск новых путей, которые бы повышали приверженность терапии как при проведении профилактики железодефицитных состояний, так и для эффективного лечения манифестной анемии. С этой целью рассматриваются два направления: изменение режима дозирования и применение соединений железа, произведенных с помощью современных технологий, обеспечивающих повышение безопасности без снижения биодоступности и эффективности.
В настоящее время с целью улучшения переносимости рекомендуется применение препаратов железа в низких дозах короткими курсами (2 недели в месяц) или альтернирующими режимами (через день в течение месяца) [9]. Интермиттирующий режим при пероральном приеме препаратов железа (2 или 3 раза в неделю) был предложен в качестве эффективной альтернативы ежедневному обогащению питания железом в целях профилактики анемии у менструирующих женщин. Способность эпителиальных клеток усваивать железо ограниченна. Обновление клеток в кишечнике происходит каждые 5–6 дней. Вводимые в интермиттирующем режиме препараты железа будут доступны для усваивания преимущественно новым эпителиальным клеткам, что способствует повышению эффективности всасывания. Кокрейновский обзор 25 рандомизированных клинических исследований с участием 10 996 женщин репродуктивного возраста показал, что интермиттирующий режим дозирования по эффективности сопоставим с ежедневным приемом препаратов железа в снижении распространенности анемии и повышении концентраций гемоглобина. Интермиттирующий режим приема способствует уменьшению оксидативного стресса, снижению частоты других побочных эффектов, связанных с ежедневным приемом препаратов железа, минимизирует блокаду усвоения других минеральных веществ ввиду высоких уровней содержания железа в просвете ЖКТ и кишечном эпителии [10].
Одними из первых для лечения железодефицитных состояний начали применяться ионные соли двухвалентного железа, которые оказывали быстрый и выраженный эффект на гематологические показатели пациентов, однако характеризовались наличием массы побочных эффектов. Причиной возникновения побочных эффектов является воздействие ионов металла на слизистую оболочку ЖКТ.
Гидроксид-полимальтозный комплекс (ГПК) железа-III абсорбируется путем активного всасывания при конкурентном обмене лигандами, уровень которых определяет скорость абсорбции железа Fe3+. Неионная структура, гарантирующая стабильность комплекса, и перенос железа с помощью транспортного белка обеспечивают хорошую переносимость. Однако полимальтозный комплекс железа-III имеет достаточно низкую биодоступность.
В последние годы на фармацевтическом рынке появился ряд соединений железа, при производстве которых используются новые фармацевтические технологии, обеспечивающие и высокую биодоступность, и хорошую переносимость: хелатное железо, ферментированное железо, липосомальное железо. Продукция, содержащая данные соединения, имеет регистрационный статус биологически активной добавки (БАД) и может долгосрочно применяться с целью профилактики или компенсации железодефицитных состояний у разных групп населения.
Клинико-фармакологические особенности железосодержащих препаратов, произведенных по нанотехнологии SunActive® Fe
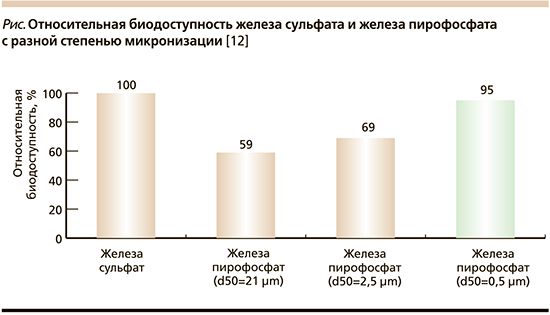
Сульфат железа является наиболее часто назначаемой пероральной формой, имеющей высокую биодоступность. Однако до 70% из тех, кому его назначают, сообщают о значительных желудочно-кишечных расстройствах, а 2 мета-анализа, посвященных пероральной терапии препаратами железа во время беременности, сообщают о неприемлемо высокой частоте побочных эффектов со стороны ЖКТ [11]. Пирофосфат железа – трехвалентное соединение с хорошей переносимостью, но низкой биодоступностью, что связано с низкой растворимостью этого соединения в воде. Специальная запатентованная нанотехнология SUNACTIVE®, применяемая при производстве БАДа Боноферлат заключается в максимальной микронизации c последующим мицеллированием пирофосфата железа. Технология супердисперсии позволяет измельчать пирофосфат железа до наночастиц размером менее 0,3 мк, что не дает им «слипаться» в жидкой среде. Степень микронизации ассоциирована с величиной биодоступности. Железа пирофосфат, миронизированный до 0,3 мк, по биодоступности сопоставим с эталонным соединением железа сульфатом (см. рисунок).
Последующее мицеллирование микронизированного пирофосфата железа дополнительно защищает его от взаимодействия с кислой средой желудка и создает естественную транспортную систему, которая обеспечивает прямой путь транспорта Fe3+ через М-клетки, расположенные наиболее близко к скоплениям лимфоидных клеток и тканей.
Микроскладчатые клетки (М-клетки) представляют собой специализированные фагоцитирующие эпителиальные клетки, специализированные для передачи широкого спектра антигенных частиц и микроорганизмов через фолликуло-ассоциированный эпителий (FAE) в лимфоидную ткань, ассоциированную с кишечником (GALT) посредством процесса, называемого трансцитозом. Мицеллы захватываются М-клетками путем эндоциоза и путем трансцитоза преодолевают эпителиальный барьер. Такой путь всасывания обеспечивает быстрое попадание железа через энтероциты в лимфу и далее в печень для встраивания в ферритин и трансферрин.
Мицеллы – частицы в коллоидных системах, состоящие из нерастворимого в данной среде ядра очень малого размера, окруженного стабилизирующей оболочкой адсорбированных ионов и молекул растворителя. Мицеллы имеют липидное ядро, оболочка которого покрыта одним слоем фосфолипидов с гидрофильными головками и гидрофобными хвостиками (см. таблицу).

В отличие от липосом мицеллы имеют меньшие размеры, а также в их структуре отсутствует водное ядро, что делает их наиболее подходящими для транспорта плохо растворимых в воде соединений, к которым относится железо. Мицеллы по своему строению и размерам наиболее приближены к хиломикронам – естественным транспортным частицам нашего организма.
Помимо прямого транспорта железа через М-клетки у мицелл есть и дополнительный ионный путь усвоения железа. Под действием пищеварительных ферментов в 12-перстной кишке и начале тонкого кишечника происходит высвобождение железа Fe3+ из мицелл. Присутствующая в препарате аскорбиновая кислота (АК) способствует переходу части Fe3+ в Fe2+, что обеспечивает всасывание через ионный путь транспорта с участием переносчика двухвалентного металла DMT-1. DMT-1 является посредником апикального захвата железа в дуоденальных энтероцитах и транспорта железа из эндосомы в цитозоль после клеточного захвата его трансферриновым рецептором (ТфР).
Таким образом, технология SunActive® Fe позволяет значительно улучшать биодоступность пирофосфата железа, что делает компенсацию ДЖ в организме максимально эффективной и безопасной.
Роль АК в процессах всасывания железа
АК относится к пищевым факторам, влияющим на всасывание железа. АК преодолевает негативное влияние на всасывание железа всех ингибиторов, к которым относятся фитаты, полифенолы, кальций и белки в молочных продуктах, и увеличивает всасывание как нативного железа, так и железа, содержащегося в БАДе и/или лекарственных средствах [13].
Исследования с применением радиоактивных изотопов при однократном приеме добровольцами убедительно показали дозозависимый усиливающий эффект нативной или добавленной АК на всасывание железа. Эффект в значительной степени обусловлен способностью восстанавливать Fe3+ до Fe2+, а также способностью хелатировать железо.
Экспериментальная работа по изучению сравнительной биодоступности пирофосфата железа и сульфата железа продемонстрировала следующее: добавление АК повышает биодоступность железа из любого из этих источников при долгосрочном курсовом применении. Добавление АК привело к повышению относительной биодоступности из сульфата железа на 18%, из пирофосфата железа на 19%. Показатель эффективности регенерации гемоглобина, определенный как разница конечного и начального уровней гемоглобина, умноженная на 100 и разделенная на количество употребленного в мг железа, составил для сульфата железа и сульфата железа+АК на 4-й день приема 20,55±4,27 и 40,67±6,76; на 13-й день приема 16,85±5,06 и 20,51±1,12; на 21-й день приема 10,02±1,96 и 11,85±0,51; для пирофосфата железа и пирофосфата железа+АК на 4-й день приема 14,80±3,17 и 39,42±5,53, на 13-й день приема 13,79±2,79 и 23,36±2,14, на 21-й день приема 8,09±0,88 и 10,91±0,56 соответственно [14].
Мета-анализ проведенных клинических исследований (A. Heffernan et al., 2017, 6 рандомизированных клинических исследований, 118 пациентов) подтвердил положительное влияние АК на рост уровня гемоглобина у пациентов, включенных в исследования [15, 16]. АК ускоряет изменение MCV (среднего размера эритроцитов) у пациентов с железодефицитной анемией [16]. АК участвует в процессах метаболизма железа и стимулирует синтез ферритина. Описан ряд новых механизмов влияния АК на обмен железа. АК регулирует процесс входа железа в клетку и последующий его внутриклеточный метаболизм; стимулирует синтез ферритина (депо железа в организме), подавляет распад ферритина в лизосомах клетки, снижает потери железа клетками [17].
Наиболее эффективное молярное отношение железа к АК составляет ~1:4, именно такое соотношение находится в составе Боноферлата [18].
Заключение
В условиях растущей распространенности железодефицитных состояний основной стратегией профилактики является саплементация. Для длительного профилактического приема соединения железа должны обладать хорошей растворимостью, высокой биодоступностью, достаточным содержанием элементарного железа и не вызывать побочных эффектов. БАД Боноферлат представляет собой комбинацию микронизированного пирофосфата железа, произведенного в Италии по запатентованной технологии мицеллярного микрокапсулирования SunActive® Fe и L-АК. В составе 1 капсулы БАДа Боноферлат содержится 30 мг железа и 110 мг АК, что обеспечивает эффективное молярное соотношение между ними для адекватного восстановления валентности с Fe3+ в Fe2+.
Содержание 30 мг железа в одной капсуле Боноферлата позволяет упрощать подбор необходимых дозировок в соответствии с рекомендациями экспертов ВОЗ. Согласно этим рекомендациям, для профилактики железодефицита, в т.ч. во время беременности, используются дозировки железа 30–60 мг/сут., а с целью компенсации железа при анемии – 120 мг железа в сутки до нормализации уровней гемоглобина и ферритина с последующим переходом на профилактический режим дозирования с целью предупреждения рецидивов анемии.
Железо в составе Боноферлата хорошо переносится, не вызывает побочных эффектов со стороны ЖКТ и не взаимодействует с молочными продуктами, чаем, кофе и другими пищевыми продуктами, поэтому его можно принимать в любое удобное время без потери эффективности.
Технология микронизирования и наномицеллирования железа SunActive® Fe удостоена ряда международных премий в Японии, США и в Европе за инновации и была одобрена американской FDA (Food and Drug Administration), а также рекомендована ВОЗ в качестве высокоэффективного способа восполнение ДЖ [19].
Боноферлат может применяться при повышенной потребности в железе во время беременности в I, II и III триместрах, грудного вскармливания, с целью компенсации хронических потерь железа при менструальных и межменструальных кровотечениях, при миомах, полипах, аденомиозе и т.п., кровотечениях из геморроидальных вен, донорстве крови, при недостаточном поступлении гемового железа с пищей в результате диет или особенностей питания (вегетарианство), при нарушении всасывания железа в ЖКТ, а также для восполнения ДЖ в комплексной терапии железодефицитных анемий и сидеропений различной этиологии.



