Актуальность
В настоящее время доказано, что акромегалия является не мономорфным, а гетерогенным заболеванием, объединяющим множество более или менее дифференцированных гистологических подтипов соматотрофных опухолей, различающихся клинико-патологическими проявлениями, конечным размером, сценарием развития, иммунологическим профилем и чувствительностью к лечению. Согласно классификации ВОЗ от 2022 г., среди нейроэндокринных гипофизарных соматотрофных опухолей выделяют 7 спорадических или генетически детерминированных гистологических подтипов. Чаще встречаются моноцеллюлярные (плотногранулированные, редкогранулированные, маммосоматотрофные) и бицеллюлярные (сомато-лактотрофные) неоплазии. Реже наблюдаются низкодифференцированные морфотипы (зрелые плюригормональные опухоли PIT1-линии, незрелые опухоли PIT1-линии и опухоли из ацидофильных стволовых клеток), характеризующиеся небольшой секреторной активностью, но ускоренным и инвазивным ростом [1–3].
Наиболее распространенными гистологическими подтипами, в первую очередь нуждающимися в дифференцированной диагностике, являются плотно- и редкогранулированные соматотрофные опухоли (ПСО и РСО), принципиально отличающиеся выраженностью цитоплазматического присутствия гормон роста (ГР)-содержащих гранул, рецепторным фенотипом, клиническим течением и лечебным прогнозом.
ПСО, наблюдаемые в 30–50% случаев, как правило, формируются в возрасте 40–60 лет, отличаются сохранной видовой специализацией, медленным интраселлярным ростом и высокой секреторной активностью. Данный морфотип характеризуется поздней манифестацией, скрытым характером течения и маловыраженными соматическими изменениями, что, как правило, проявляется запоздалой диагностикой и широким спектром инвалидизирующих полиорганных и обменных нарушений, негативно влияющих на качество и продолжительность жизни пациентов. Тем не менее сохранность рецепторного фенотипа с доминирующей экспрессией 2-го подтипа (п/т) соматостатиновых рецепторов (СР) в клетках ПСО проявляется хорошей чувствительностью к аналогам соматостатина 1-й генерации (АС1).
В 15–35% случаев причиной акромегалии являются менее дифференцированные РСО, проявляющиеся ускоренным экстраселлярным и инвазивным ростом, приводящим к развитию интракраниальной компрессии, зрительным и нейро-сосудистым нарушениям.
Для РСО характерна повышенная митогенная активность клеток (Ki-67 > 3%), способствующая ускоренному нарастанию опухолевой массы. Сниженная экспрессия адгезивного белка Е-кадгерина приводит к нарушению межклеточных связей и обеспечивает опухолевым клеткам способность к инфильтративному росту, миграции и развитию отдаленных метастазов.
В клетках РСО отмечается относительно меньшая плотность 2-го п/т СР, что обусловливает резистентность к АС1. Этот наиболее проблемный для курации морфотип манифестирует в молодом возрасте, отличается выраженным масс-эффектом, рецидивирующим течением и резистентностью к лучевому и медикаментозному воздействию. В связи с высоким риском малигнизации РСО внесены в группу агрессивных нейроэндокринных гипофизарных опухолей, требующих активного комбинированного лечения и пожизненного динамического контроля [4–6].
В связи с гетерогенностью соматотрофных опухолей в научной литературе широко обсуждаются отдельные биомаркеры и обобщенные клинико-морфологические предикторные модели, способные прогнозировать возможность послеоперационной ремиссии, риск рецидива (или продолженного роста резидуальной опухоли), а также долгосрочную эффективность медикаментозного лечения с учетом иммунологического фенотипа и клинических характеристик соматотрофной опухоли [7, 8].
Комплекс лечебных мероприятий при акромегалии включает транссфеноидальную хирургию, медикаментозное лечение и лучевую терапию, причем, как правило, доминируют комбинированные схемы лечения. Методом выбора является эндоскопическая аденомэктомия с использованием трансназального транссфеноидального доступа, позволяющая при микроаденомах в 80–90% случаев достигать полной ремиссии заболевания. Однако в связи с запоздалой диагностикой у 70% вновь выявленных пациентов регистрируется макроаденома гипофиза с экстраселлярным и инвазивным ростом, что снижает эффективность радикальной аденомэктомии до 40–60% и требует подключения медикаментозной или лучевой терапии.
К негативным прогностическим факторам нейрохирургического вмешательства относятся молодой возраст при постановке диагноза, высокое исходное содержание ГР и инсулиноподобного ростового фактора-1 (ИРФ-1), большие размеры опухоли и ускоренный ее рост, инвазия в твердую мозговую оболочку и кавернозный синус, эрозия дна турецкого седла, выявление при гистологическом исследовании редкогранулированной опухоли. Около половины прооперированных пациентов с эндо-экстраселлярными опухолями гипофиза нуждаются во вторичной медикаментозной терапии в связи с наличием остаточной опухолевой ткани и сохраняющейся активностью заболевания [9, 10].
Современная фармакотерапия акромегалии включает препараты центрального и периферического действия.
К первым относятся синтетические аналоги соматостатина, а также селективные агонисты дофамина (каберголин). Препарат периферического действия (пэгвисомант) является антагонистом рецепторов ГР, обеспечивающим достижение контроля акромегалии путем конкурентного блокирования его биологического действия.
Аналоги соматостатина (АС) занимают особое место в медикаментозном лечении акромегалии, поскольку обладают выраженным антисекреторным и антипролиферативным действием. В настоящее время выделяют 2 генерации АС, отличающиеся по доминирующему воздействию на определенные подтипы соматостатиновых рецепторов (СР). АС 1-й генерации (АС1) – октреотид и ланреотид, преимущественно связываются со 2-м п/т СР и потому наиболее эффективно действуют на больных с ПСО. Доказано, что контроль акромегалии при использовании ланреотида (Соматулин Аутожель) в качестве первичной или вторичной медикаментозной терапии (МТ) в селективной выборке наблюдается у 72–80% больных. При сниженной экспрессии 2-го п/т СР методом выбора является АС 2-й генерации (пасиреотид), воздействующий на 5-й подтип СР, который обладает наибольшим эффектом при лечении РСО. Чувствительность к АС, как правило, оценивается по величине ИРФ-1 и ИРФ-1 индекса (ИИ), характеризующего степень превышения концентрации ИРФ-1 верхней возрастной нормы. Согласно международным рекомендациям, критерием контроля акромегалии является величина ИИ ≤1 [11–13].
С учетом реально существующей множественности гистологических подтипов соматотропином, выбор оптимального лечебного препарата напрямую зависит от совокупности клинических, радиологических и морфологических предикторов специфической рецепторной экспрессии. Это безусловно усложняет клиническую задачу, но в большей степени соответствует реальной ситуации. Если говорить о перспективных направлениях совершенствования диагностической и лечебной помощи больным акромегалией, то они связаны прежде всего с реализацией прецизионного и персонализированного подхода к лечению больных с синдромом акромегалии. Стратификация характерных признаков заболевания и практическая возможность определения конкретного опухолевого морфотипа позволяют не только предсказывать дальнейший характер клинического течения заболевания, но и подбирать больному оптимальную схему лечения, способную обеспечивать скорейшее достижение биохимической ремиссии.
На современном этапе перехода к персонализированной медицине первоочередными задачами, направленными на совершенствование опухоль-ориентированной диагностики и лечения пациентов с синдромом акромегалии в России, являются:
1. Внедрение в клиническую практику иммуногистохимического анализа (ИГА) опухолевой ткани для определения особенностей рецепторной экспрессии и выраженности пролиферативной активности опухолевых клеток.
2. Использование фармакотерапевтического тестирования для прогнозирования долгосрочной эффективности АС1 генерации и оптимизации лекарственной терапии.
3. Совершенствование радиологического обследования больных акромегалией с внедрением в итоговый протокол данных об интенсивности опухолевого сигнала на Т2-взвешенных МР изображениях для прогнозирования гистологического подтипа соматотрофных опухолей и чувствительности к АС.
Цель работы: проведение комплексной клинико-морфологической и радиологической стратификации соматотрофных опухолей с целью уточнения опухолевого морфотипа и прогнозирования успешности предлагаемого лечебного пособия.
Предикторы гистологического морфотипа и рецепторной экспрессии соматотрофных опухолей
В настоящее время «золотым» стандартом в дифференциальной диагностике морфологического строения соматотрофных опухолей является ИГА фрагментов удаленной опухоли, который позволяет судить об особенностях рецепторной экспрессии и пролиферативной активности опухолевых клеток. Это позволяет аргументированно использовать таргетный принцип МТ, гарантирующий достижение долгосрочного терапевтического успеха. Среди предикторов чувствительности к АС1 выделяют женский пол, старший возраст, небольшое превышение уровней ГР и ИРФ-1, наличие GNAS-мутации и плотногранулированной опухоли, высокую экспрессию 2-го подтипа СР, низкую величину пролиферативного индекса Ki-67, выраженный ответ на острый тест с октреотидом, а также выявление гипоинтенсивной опухоли на Т2-взвешенных МР изображениях. Напротив, присутствие AIP-мутации, редкогранулированной опухоли, гиперинтенсивного опухолевого сигнала на Т2-взвешенных изображениях ассоциируются с низкой чувствительностью к АС1 [11, 14–16].
Методы
Проведено ретроспективное клинико-морфологическое сопоставление с целью изучения клинических и иммунофенотипических особенностей ПСО и РСО, влияющих на сценарий клинического течения и чувствительность к традиционной терапии АС1. Обследованы 82 пациента (29 мужчин) с акромегалией, перенесших нерадикальную аденомэктомию и длительно принимавших АС1 продленного действия. Гистологический и иммуногистохимический анализы фрагментов биопсийного материала проведены в Референс-центре иммуногистохимических, патоморфологических и лучевых методов исследования ФГБУ «НМИЦ эндокринологии» МЗ РФ (директор – член-корреспондент РАН Н.Г. Мокрышева). РСО подтверждена у 49, ПСО – у 33 больных. Гендерное соотношение в группах было сходное, доля мужчин составила 36,7 и 36,4% соответственно. В качестве вторичной МТ больные получали ланреотид (Соматулин Аутожель 120 мг/28–56 дней), октреотид (Октреотид Депо, Октреотид Лонг – 10–30 мг/28 дней). Длительность лечения составила 29,9±20,4 месяца (Ме – 23,5 месяца).
Дизайн исследования одобрен ЛЭК при РМАНПО.
Результаты и их обсуждение
В табл. 1 и 2 представлены сравнительные иммунологические и клинические характеристики выделенных групп пациентов (ПСО, РСО). Выявлено наличие статистически значимых различий между основными иммунологическими показателями, которое подтверждает присутствие разных рецепторных фенотипов, обусловливающих чувствительность к АС1.
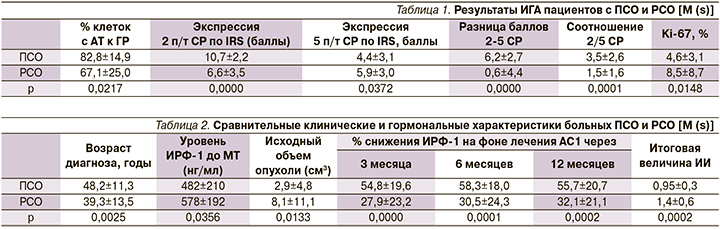
Как следует из табл. 1, ПСО отличаются от РСО более высоким титром АТ к ГР, доминирующей экспрессией 2-го п/т СР, более высокой разницей и соотношением баллов по IRS (immunoreactive score) между 2-м и 5-м подтипами СР, а также меньшей пролиферативной активностью опухолевых клеток.
Как следует из табл. 2, больные ПСО статистически значимо отличаются более старшим возрастом диагноза, меньшей гормональной активностью, небольшими размерами опухоли и хорошей чувствительностью к АС1 на всем протяжении лечебного периода. Экспрессия 2-го п/т в ПСО составляет 10,7±2,2 против 6,6±3,5 баллов IRS в РСО (р=0,0001). Напротив, больные РСО обладают прямо противоположными характеристиками с низкой чувствительностью к АС1, обусловленной в первую очередь меньшей экспрессией 2-го п/т СР (рис. 1).
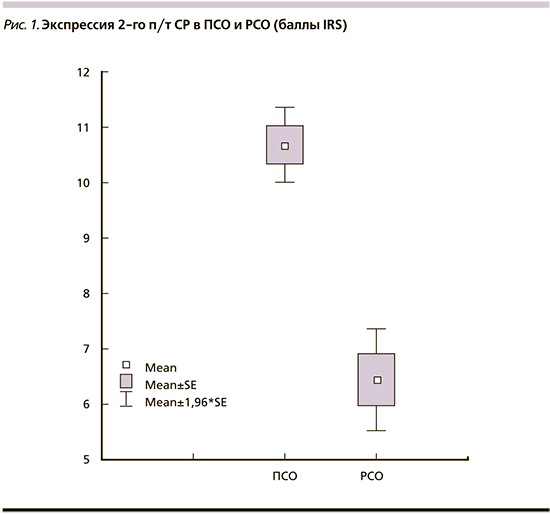
На рис. 2 представлена динамика уровня ИРФ-1 на фоне длительного лечения АС1 в зависимости от опухолевого морфотипа. На графике видно, что у больных с ПСО уже через 3 месяца от начала лечения АС1 достигнута медикаментозная ремиссия, которая сохранялась на всем протяжении МТ. Напротив, пациентам с РСО, несмотря на длительное лечение АС1 в максимальных дозах с подключением каберголина, так и не удалось достичь биохимической ремиссии. В последующем эта проблема решена добавлением к терапии пэгвисоманта (рис. 2).
В отличие от пациентов с ПСО, у больных с РСО в силу низкой экспрессии 2-го п/т СР длительный прием АС1 в максимальных дозах не привел к желаемой биохимической ремиссии, поскольку не был соблюден принцип таргетной терапии. Таким образом, определение рецепторного фенотипа является ведущим условием адекватного планирования лекарственной терапии.
Фармакотерапевтическое тестирование
Практика показала, что эффективность препаратов центрального действия зависит непосредственно от рецепторного фенотипа опухолевых клеток (экспрессий 2-го, 5-го п/т СР и D2-рецепторов). Следует отметить, что значительная часть пациентов в силу разных причин не имеет иммунофенотипического «паспорта» (наличие противопоказаний или отказ от операции, отсутствие морфологической лаборатории, необходимых реагентов, низкое качество биопсийного материала и т.п). Отсутствие необходимых сведений служит причиной лечения методом ex juvantibus без надежной гарантии на успех. Согласно литературным данным, при традиционной фармакотерапии АС1 в качестве препарата 1-й линии достижение контроля акромегалии в неселективной выборке наблюдается в 40–55% случаев. Это создает известные клинические проблемы для большой когорты частично резистентных и «нечувствительных» пациентов, включая прогрессирование полиорганных нарушений и продолженный рост опухоли вследствие недифференцированного подхода к МТ [17–19].
Несмотря на существующие данные, согласно которым у 25% больных, длительно получающих АС1 в максимальных дозах, не удается достичь контроля акромегалии, тем не менее сохраняется практика многолетнего ожидания клинического эффекта и инертности в изменении лечебной стратегии, способствующих дальнейшему повышению коморбидности «резистентных» пациентов. Такой подход наиболее опасен для больных с РСО, отличающихся высоким риском малигнизации. К сожалению, в настоящее время отсутствует согласованное мнение относительно контрольного срока для оценки феномена первичной резистентности. Одни авторы предлагают 12-месячный срок пробного лечения АС. Другие считают, что уровень ГР через 3 месяца и содержание ИРФ-1 в крови через 6 месяцев от начала лечения служат предиктором эффективности дальнейшей лекарственной терапии. На современном этапе в случае отсутствия данных о рецепторном фенотипе опухолевых клеток могут быть использованы иные предикторы эффективности МТ АС, к которым относятся оценочные пробы с октреотидом и сигнифором, фармакотерапевтическое тестирование и определение интенсивности опухолевого сигнала на Т2-взвешенных МР изображениях [20–23].
Фармакотерапевтическое тестирование позволяет косвенно оценивать не только рецепторный фенотип опухолевых клеток, но и интактность пострецепторных механизмов, принимающих непосредственное участие в реализации супрессивного действия АС1 на секрецию ГР. В табл. 3. представлены результаты внутригруппового корреляционного анализа между величинами снижения уровня ИРФ-1 (в %) на всем протяжении лечения (через 3, 6, 12 месяцев от начала терапии и при последнем визите). Величина снижения уровня ИРФ-1 через 3 и 6 месяцев лечения АС1 обратно коррелирует с его итоговыми результатами (табл. 3).
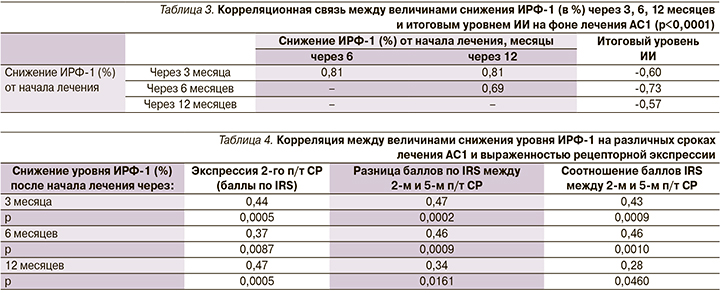
В табл. 4 представлены результаты корреляционного анализа между степенью снижения уровня ИРФ-1 (%) в выбранных временных интервалах и экспрессией 2-го п/т СР, а также разницей и соотношением 2-го и 5-го подтипов. Наличие прямой корреляции между величинами снижения уровня ИРФ-1 и выраженностью абсолютной и относительной экспрессии 2-го подтипа СР указывает на прогностическую значимость данных показателей для оценки рецепторного фенотипа опухолевых клеток. Таким образом, результаты 3–6-месячного фармакотерапевтического тестирования коррелируют с абсолютной и относительной экспрессией 2-го п/т СР опухолевых клеток и могут служить предиктором гистологического подтипа соматотрофной опухоли и эффективности долгосрочного лечения АС1.
Результаты ROC-анализа прогностических возможностей 3–6-месячных фармакотерапевтических маркеров для оценки долгосрочной эффективности лечения представлены на рис. 3.
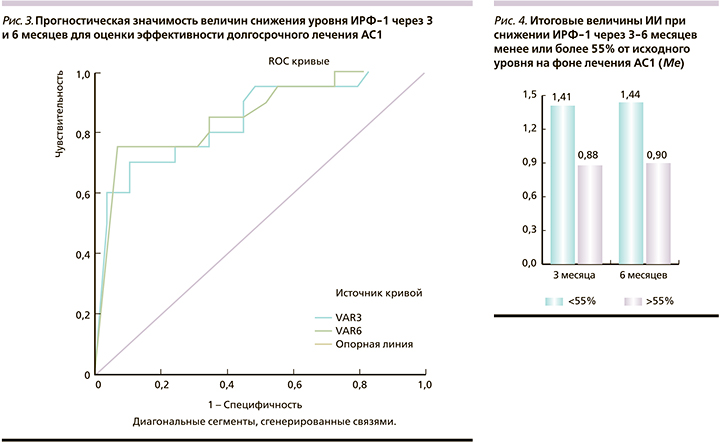
Площадь под кривой маркера 3-месячного лечения составила 0,841 (95% доверительный интервал [ДИ]: 0,725–0,957), 6-месячного лечения – 0,853 (95% ДИ: 0,741–0,966); чувствительность предикторов составила 70 и 75%, специфичность – 83 и 88% соответственно. Отрезные точки снижения ИРФ-1 через 3 и 6 месяцев составили 55% от исходного уровня (рис. 3). Как показали результаты ретроспективного анализа, у больных с уровнем снижения ИРФ-1 через 3 месяца от начала лечения менее или более 55% величина итогового ИИ составила 1,56±0,65 против 0,90±0,22 (р=0,0000), а через 6 месяцев – 1,65±0,65 против 0,98±0,28 (р=0,0000) соответственно (рис. 4).
Таким образом, использование фармакотерапевтического тестирования позволяет судить о рецепторном фенотипе опухолевых клеток и о долгосрочной эффективности АС1. Снижение ИРФ-1 >55% от исходного уровня через 3–6 месяцев лечения АС1 свидетельствует о сохранности как рецепторного аппарата, так и пострецепторных механизмов и предсказывает стойкую биохимическую ремиссию. Напротив, отсутствие биохимического и опухолевого ответа на предлагаемое лечение пациентов с РСО, входящих в группу высокого риска, предполагает своевременный переход на другие формы лечения.
Представленные выводы согласуются с мнением М. Puig-Domingo et al., которые предлагают оценивать чувствительность к АС1 по итогам 6-месячного лечения в максимальных дозах с последующей стратификацией по величине ИИ. При этом выделяются следующие группы больных: А) чувствительные к АС1 (ИИ <1), Б) частично резистентные (1,0 < ИИ <1,3) и В) резистентные к АС1 (ИИ ≥1,3). Поскольку, согласно международным рекомендациям, критерием контроля акромегалии является величина ИИ ≤1, то последние две группы, претерпевшие терапевтическую неудачу, нуждаются в фармакологическом маневре [24].
Определение сравнительной интенсивности опухолевого сигнала на Т2-взвешенных МР изображениях
За последние десятилетия накопились научные данные, указывающие на возможность с помощью МРТ судить не только о наличии неообразования гипофиза, его размерах и направлении роста, но и предсказывать присутствие конкретного морфотипа соматотрофной опухоли, а следовательно, его клинические свойства. Исследования показали, что в отличие от других тропных опухолей ГР-секретирующие неоплазии отличаются вариабельностью интенсивности сигнала на Т2 ВИ МРТ, что свидетельствует об их патоморфологическом различии.
Связь между Т2-взвешенной интенсивностью сигнала опухоли гипофиза и ответом на вторичную МТ АС1 у пациентов с акромегалией впервые изучена М. Puig-Domingo et al. Были обследованы 62 пациента с активной акромегалией, прошедших нерадикальное хирургическое вмешательство. Резидуальная опухоль была классифицирована на гипер- и гипоинтенсивные неоплазии на Т2 ВИ. В дальнейшем пациенты в течение 12 месяцев получали АС1 в максимально эффективных дозах с последующим гормональным и МР-контролем. Было отмечено, что уже через 6 месяцев у 71% пациентов с Т2-гипоинтенсивностью наступила нормализация уровня ИРФ-1 по сравнению с 20% пациентов с Т2-гиперинтенсивными опухолями. Через 12 месяцев лечения у 62% больных Т2-гипоинтенсивной группы сохранялся контроль акромегалии, тогда как в гиперинтенсивной группе положительной динамики не наблюдалось. Авторы заключают, что использование показателя интенсивности опухолевого сигнала позволяет прогнозировать долгосрочную результативность вторичной МТ АС1 [25]. Последующие работы подтверди-ли первоначальные результаты. Было продемонстрировано, что Т2-взвешенный сигнал МРТ прогнозирует реакцию соматотропиномы не только на АС1, но и на АС2, поскольку наличие гиперинтенсивного опухолевого сигнала служит показанием к назначению аналога соматостатина 2-й генерации (Пасиреотида ЛАР), влияющего на 5-й п/т СР [24, 26, 27].
При сравнительном исследовании показано, что высокая относительная интенсивность сигнала на Т2 ВИ характерна для редкогранулированных соматотрофных опухолей (РСО), отличающихся бòльшими размерами, слабой грануляцией и резистентностью к АС1. Напротив, плотногранулированные соматотрофные опухоли (ПСО), как правило, отличаются низкой сравнительной интенсивностью опухолевого сигнала, замедленным ростом и хорошей чувствительностью к АС1. Потенциальные преимущества использования интенсивности опухолевого сигнала на Т2 ВИ закреплены в международных рекомендациях для дифференцированной диагностики соматотрофных опухолей и оптимизации лечебного пособия [13, 28, 29].
В настоящее время радиологами используются 3 способа классификации интенсивности опухолевого сигнала на Т2 ВИ – один качественный (визуальный) и два количественных (метод соотношения сигналов и метод трех тканей) [30].
Качественный метод наиболее простой и включает визуальную оценку интенсивности опухоли относительно окружающих тканей. Для этого применяется корональное Т2 ВИ опухоли гипофиза. В качестве контрольной ткани используется серое вещество лобной доли. Опухоль регистрируется как гипоинтенсивная при опухолевом сигнале ниже серого вещества или как гиперинтенсивная при сигнале выше серого вещества. Этот способ легкодоступен для опытного радиолога, однако лишен стандартизации и воспроизводимости в силу вариабельности субъективного восприятия.
Способ соотношения сигналов предполагает сравнение интенсивности двух зон интересов (опухоли и нормальной ткани гипофиза) с вычислением относительной интенсивности. При этом оптимальной зоной интереса является здоровая часть гипофиза, которую легче обозначить при наличии микроаденомы. В качестве основы для сравнения можно использовать серое вещество височной доли, поскольку оно имеет схожую интенсивность сигнала с нормальной тканью гипофиза. Другие авторы в качестве компаратора предлагают использовать серое или белое вещество лобной доли, путамен, варолиев мост или ножку мозжечка.
Способ трех тканей включает количественную оценку интенсивности трех зон интересов (опухоли, серого вещества и ткани белого вещества). Трехтканевый метод более дифференцированный, позволяющий также выделять изоинтенсивные опухоли. Согласно расчетам, относительная гиперинтенсивность опухоли регистрируется при значениях интенсивности сигнала выше серого вещества, изоинтенсивность – при соответствии интенсивности с сигналом белого вещества и гипоинтенсивность – при интенсивности сигнала ниже белого вещества. В связи с наблюдаемым сходством в клиническом поведении некоторые авторы предлагают объединить больных с изо- и гиперинтенсивным Т2-сигналом в группу негипоинтенсивной категории [31–34].
К сожалению, в настоящее время в Российском алгоритме радиологического обследования больных ГР-секретирующими опухолями отсутствует такая важная опция, как метод цифрового определения интенсивности опухолевого сигнала на Т2 ВИ, что существенно ограничивает возможности дифференциально-диагностического поиска. Поэтому внедрение в клиническую практику единого согласованного протокола количественного анализа интенсивности опухолевого сигнала на Т2 ВИ будет способствовать повышению эффективности диагностики и лечения заболевания.
Ниже представлены предварительные данные радиологического и морфологического сопоставления различных морфотипов соматотрофных опухолей гипофиза.
С целью выявления особенностей МРТ визуализации плотно- и редкогранулированных соматотропином из подготовленной базы данных (см. выше) случайным образом выбраны 16 больных (6 мужчин), поровну разделенных на 2 группы, согласно морфологическому диагнозу ПСО или РСО. Возраст диагноза составил 47,1±15,4 против 38,4±10,9 года (р=0,22). Исходный объем опухоли составил 3,7±4,4 против 7,2±10,3 см3 (р=0,4).
Радиологическое обследование проведено на высокопольных МР-томографах с индукцией магнитного поля в 1,5 Тесла. Толщина срезов – 2–3 мм.
Все исследования содержали Т1- и Т2-взвешенные режимы высокого разрешения, применяемые при сканировании гипоталамо-гипофизарной области. Пятнадцати из 16 пациентов выполнено контрастное усиление гадолиний-содержащими препаратами по стандартной методике.
В работе применен способ соотношения сигналов, в ходе которого рассчитывалась интенсивность зон интереса опухолей на на Т2 ВИ относительно серого вещества головного мозга, согласно формуле: Sотн=(Sоп–Sсв)/Sсв×100%, где Sотн – относительный МР-сигнал (относительная интенсивность МР-сигнала) опухоли в процентах относительно сигнала от серого вещества, Sоп – МР-сигнал от опухоли, Scв – МР-сигнал от серого вещества. Расчет относительной интенсивности сигнала опухолей гипофиза позволил компенсировать различия в параметрах МРТ сканирования и объединить результаты для различных плоскостей визуализации. Степень инвазии в окружающие опухоль анатомические структуры оценивали согласно классификации Knosp и Hardy [29]. Объем опухоли рассчитывался по формуле De Chiro и Nelson (А×Б×С×π/6), где А – сагиттальный, В – фронтальный, С – аксиальный размеры (в см) [30]. Сравнения двух групп проводили по непараметрическому критерию Манна–Уитни. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Полученные результаты пилотного исследования показали, что при визуальной оценке ПСО выглядят более «темными» относительно серого вещества головного мозга и сохранной ткани аденогипофиза, тогда как РСО, напротив, отличаются более ярким изображением относительно ткани сравнения (рис. 5).
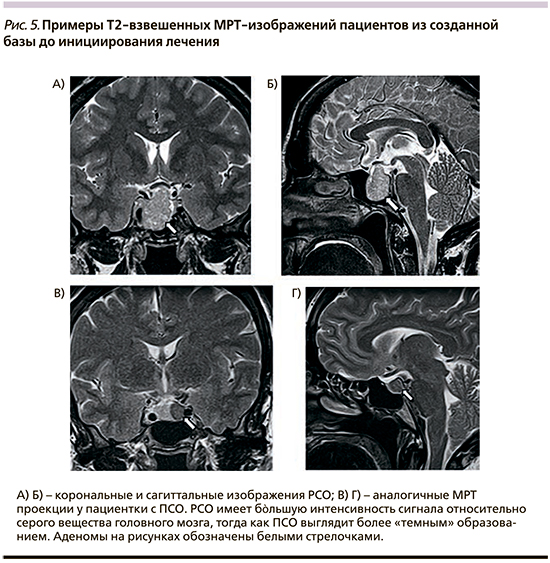
При проведении количественной оценки во всех проанализированных случаях установлено, что ПСО имеют статистически значимый низкий относительный сигнал на Т2 ВИ по сравнению с РСО: -22,2±18,8 против 28,6±26,5 (р=0,0011). При сопоставлении до- и послеоперационных МРТ-исследований показано, что оперативное вмешательство не влияет на исходную интенсивность опухолевого сигнала резидуальной опухоли. Это доказывает валидность послеоперационного анализа и согласуется с литературными данными (рис. 6) [25].
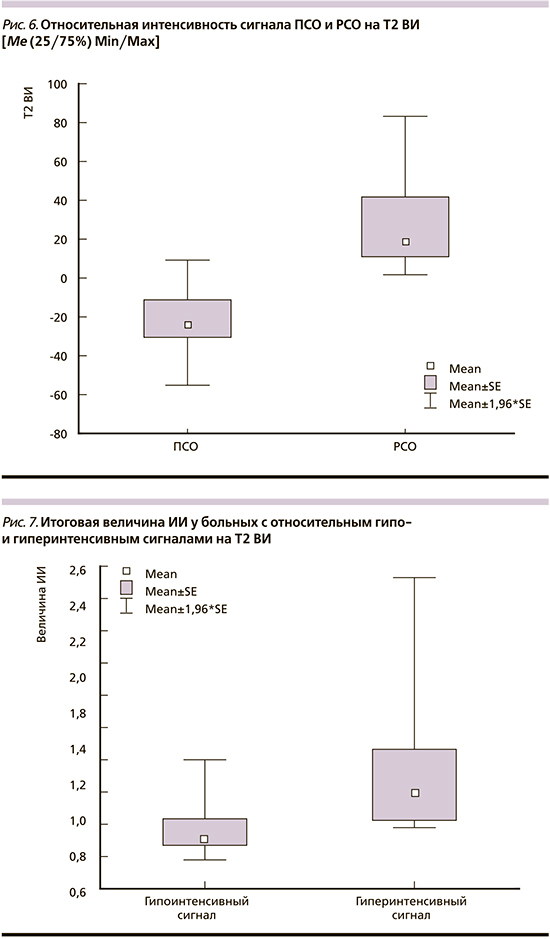
В связи с немногочисленной выборкой в данном пилотном исследовании авторам не удалось выявить значимых различий в отношении исходной гормональной активности, объемных характеристик, выраженности инвазии соматотропином в окружающие ткани и особенностей накопления и вымывания контраста. Все эти сведения мы намерены обсудить позже по мере накопления клинического материала. Однако, по данным ИГА, выявлено статистически значимое межгрупповое различие, касающееся экспрессии 2-го п/т СР: 10,6±1,9 против 5,7±3,4 балла по IRS (р=0,0031), разницей и соотношением 2-го и 5-го п/т: 7,6±2,7 против 0,6±4,8 (р=0,041) и 5,5±3,7 против 1,7±1,9 (р=0,0216), у больных гипо- (ПСО) и гиперинтенсивными (РСО) опухолями соответственно. Наблюдаемое абсолютное или относительное доминирование 2-го п/т СР у больных с гипоинтенсивным относительным сигналом отразилось на итоговой величине ИИ на фоне лечения АС1: 0,97±0,19 против 1,36±0,52 у пациентов с гиперинтенсивным относительным сигналом (р=0,0157; рис. 7).
В данной работе представлен первый отечественный опыт цифровой радиологической дифференциальной диагностики соматотрофных опухолей, результаты которого согласуются с литературными данными. В работе L. Liu еt al. показано, что у 83,3% больных ПСО сравнительная интенсивность опухолевого сигнала на Т2 ВИ была <1, тогда как у 53% больных с РСО >1. В исследовании F. Tortora et al. предпринята оценка 12-месячной эффективности первичной МТ АС1 у «наивных» больных акромегалией с Т2-гипо- и гиперинтенсивными опухолями. Критериями эффективной терапии считались снижение уровней ИРФ-1 ≥50%, ГР ≥80% от исходного уровня, а также уменьшение опухолевого объема ≥20%. Результаты показали более выраженные биохимический и опухолевый ответы больных с гипоинтенсивными опухолями по сравнению с гиперинтенсивными. Авторы заключают, что Т2-взвешенная МРТ представляет собой потенциальный инструмент для уточнения патоморфологического строения соматотрофных опухолей, клинического прогноза и наиболее оптимальной схемы лечения [35–37].
Также указывается, что гистологическая структура опухолевой ткани и ее радиологическая характеристика служат манифестным проявлением определенного клеточного фенотипа, тесно ассоциированного с эффективностью к АС. Отмечено, что сочетание выраженной экспрессии 2-го подтипа СР и гипоинтенсивности опухолевого сигнала на Т2-взвешенных МР изображениях характеризуется как соматостатин-чувствительный морфологический фенотип с хорошим лечебным прогнозом при использовании АС1 [15, 20, 35]. Это подчеркивает эффективность и надежность комплексного обследования для решения клинических задач.
Заключение
Таким образом, существующая множественность гистологических подтипов соматотрофных опухолей вызывает необходимость совершенствования методов клинико-морфологической стратификации с целью уточнения опухолевого морфотипа и прогнозирования успешности предлагаемого лечебного пособия. Внедрение в клиническую практику клинических, радиологических и морфологических методов опухоль-ориентированной диагностики будет способствовать расширению возможностей диагностического поиска и реализации персонализированного подхода к лечению пациентов с синдромом акромегалии.
Представленные предварительные данные подтверждают наличие значимых количественных различий относительной интенсивности опухолевого сигнала на Т2 ВИ между ПСО и РСО, что в дальнейшем может быть использовано в дифференциальной диагностике соматотрофных опухолей и прогнозировании лечебных исходов. Как было показано, гипоинтенсивные опухоли отличаются бòльшей чувствительностью к АС1 по сравнению с гиперинтенсивными соматотропиномами, что следует учитывать при назначении лекарственной терапии. Поскольку МРТ головного мозга облигатно проводится при обследовании всех пациентов с акромегалией, представляется практически важным включение показателя интенсивности сигнала на Т2 ВИ в унифицированный протокол радиологического анализа.



