Обоснование
Острые нарушения мозгового кровообращения, определяющие высокий уровень смертности и стойкой утраты трудоспособности населения, представляют собой одну из наиболее актуальных проблем современной медицины в мире [1]. В Российской Федерации заболеваемость инсультом составляет 2,5–3,0 случая на 1000 населения в год, при этом ишемическую природу имеют до 80% мозговых инсультов [2]. Показатели смертности от цереброваскулярных заболеваний в России остаются одними из самых высоких в мире и не имеют тенденции к снижению [3].
В настоящее время среди причин, увеличивающих риск развития инсульта, тяжесть его течения и исход, особое место отводят нарушениям углеводного обмена. У больных сахарным диабетом 2 типа (СД2) риск развития ишемического инсульта (ИИ) в 2,0–2,5 раза выше, чем у лиц без диабета [4, 5]. Патогенетические компоненты СД2 (гипергликемия, гиперинсулинемия и инсулинорезистентность) рассматриваются в качестве независимых факторов риска инсульта. Среди лиц с острыми нарушениями мозгового кровообращения частота гипергликемии достигает 60% [6]. Однако до настоящего времени отсутствует единое мнение о роли повышения уровня глюкозы в развитии инсульта: имеет ли оно физиологический или патологический характер? В ряде исследований показана сопряженность между выраженностью стрессовой гипергликемии и тяжестью, а также исходом инсульта [7, 8]. С другой стороны, некоторые авторы указывают на отсутствие взаимосвязи гипергликемии и клинического исхода инсульта у пациентов с СД2 [9, 10].
Цель исследования: изучить влияние гипергликемии в дебюте ИИ на течение и краткосрочный клинический прогноз заболевания у больных СД2.
Методы
В исследование включены 186 больных с ИИ, развившимся на фоне СД2, проходивших лечение в отделении для больных острым нарушением мозгового кровообращения ГБУЗ «Городская клиническая больница № 18» Уфы в 2015–2018 гг. Дизайн: исследование серии случаев. Все пациенты поступили в стационар в течение первых 12 часов после развития очаговой неврологической симптоматики. Диагноз заболевания устанавливали в соответствии с критериями Международной классификации болезней и проблем, связанных со здоровьем (МКБ-10). Возраст больных колебался от 42 до 80 лет (в среднем 67,8±7,72 года), из них 54 (29,0%) мужчины и 132 (71,0%) женщины. У всех больных сосудистая катастрофа развилась на фоне артериальной гипертензии 2–3-й степеней.
До развития инсульта СД2 страдали 146 (78,5%) человек. Все больные получали плановую сахароснижающую терапию, из них: 57 (39,0%) человек – препараты сульфонилмочевины и метформин, 72 (49,3%) – инсулинотерапию, 17 (11,6%) человек – диетотерапию. У 40 (21,5%) пациентов диабет был впервые выявлен в условиях стационара. Верификация диабета проведена врачами-эндокринологами в соответствии с диагностическими критериями (ВОЗ, 1999–2006) и Алгоритмами специализированной медицинской помощи больным сахарным диабетом [11].
Критерии исключения: геморрагический инсульт, соматическая патология в стадии декомпенсации.
Оценка тяжести неврологической симптоматики больных проведена на основании исходного суммарного балла шкалы NIHSS. Выраженность функциональных нарушений оценивалась по модифицированной шкале Рэнкина (МшР).
Анализ клинического исхода к 21-м суткам от момента развития ИИ выполнен с использованием шкалы инсульта NIHSS, согласно которой изменение состояния больных расценивалось как заметное улучшение при регрессе неврологической симптоматики на 3 и более баллов на фоне положительной динамики лабораторных показателей; незначительное улучшение – при минимальном регрессе неврологической симптоматики (1–2 балла) и неудовлетворительных лабораторных показателях; нарастание симптоматики в пределах 3 баллов – отсутствие динамики; нарастание симптоматики на 4 балла и более – отрицательная динамика.
Всем больным при поступлении проводили исследование уровня гликемии глюкозооксидантным методом. В случаях, когда было невозможно установить, принимал ли больной пищу перед развитием нарушения мозгового кровообращения, содержание сахара в крови определяли через 2 часа после дебюта заболевания.
План обследования и лечения построен в соответствии с Федеральными стандартами оказания помощи больным сосудистыми заболеваниями, утвержденными приказами Минздрава РФ. Протокол исследования (№ 22 от 16.11.2017) одобрен локальным этическим комитетом ГБУЗ «Городская клиническая больница № 18» Уфы. Каждый пациент получал подробную информацию о проводимом исследовании и давал информированное согласие на добровольное участие в исследовании.
Статистический анализ данных выполняли с использованием пакета программ Microsoft Excell 7.0 и SPSS v. 19,0 [12]. Рассчитывали групповые показатели суммарной статистики – среднюю арифметическую величину (M) и ошибку средней (m). Сравнение двух независимых групп осуществляли с помощью критерия Хи-квадрат с поправкой Йетса. Различия считались статистически значимыми при р<0,05.
Результаты
Установлено, что в дебюте ИИ средний уровень сахара в крови составил 11,8±3,86 ммоль/л. У большинства (142 [76,3%]) больных уровень гликемии превышал 7,8 ммоль/л. Уровни гликемии 4,4–6,1 ммоль/л, соответствующие целевым показателям контроля диабета, выявлены у 14 (7,5%) пациентов, пограничные уровни гликемии 6,2–7,8 ммоль/л – у 23 (12,4%) пациентов. Содержание сахара в венозной крови менее 4,4 ммоль/л отмечено у 7 (3,8%) больных.
В зависимости от уровня гликемии больные были разделены на три группы. Первую составили 37 (19,9%) пациентов, у которых уровни сахара в крови были равны 4,4–7,8 ммоль/л. Во вторую группу был включен 51 (27,4%) пациент с гликемией 7,9–10 ммоль/л, в третью группу вошел 91 (48,9%) пациент с уровнем глюкозы крови более 10 ммоль/л. Пациенты с уровнем сахара менее 4,4 ммоль/л были исключены из исследования, поскольку их число было недостаточным для статистического анализа.
На фоне проводимой терапии у больных второй и третьей групп к третьим суткам от развития инсульта выявлено заметное улучшение показателей гликемии (табл. 1). При этом у пациентов второй группы различия с исходными величинами были статистически значимыми (на 21,5%; р=0,039), тогда как у пациентов третьей группы они носили характер тенденции (на 41,8%; р=0,100).
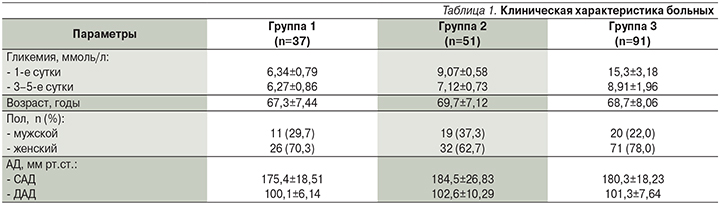
Не было обнаружено существенных различий возрастных и гендерных характеристик у больных СД2 с разными уровнями гликемии в дебюте инсульта. У обследованных больных в дебюте инсульта отмечены высокие уровни систолического и диастолического артериального давления. Средние уровни систолического давления были равны 180,6±21,23 мм рт.ст., диастолического – 101,5±8,30 мм рт.ст.
Во всех группах больных в большинстве случаев сосудистая катастрофа в головном мозге возникла впервые. Среди пациентов с сопутствующим СД2 повторный инсульт отмечен в 53 (28,5%) случаях. В первой группе повторный инсульт развился у 12 (32,4%) больных, во второй – у 17 (33,3%), в третьей группе – у 21 (23,1%).
Представленность различных подтипов инсульта в исследованных группах больных СД2 была сопоставимой. Чаще встречался атеротромботический подтип, выявленный у 21 (56,8%) больного первой группы, у 30 (58,8%) больных второй и у 64 (70,3%) больных третьей групп. Представленность кардиоэмболического подтипа в группах больных составила 12 (32,4%), 13 (25,5%) и 19 (20,9%) пациентов соответственно. ИИ неуточненной этиологии определен у 3 (8,1%) пациентов первой группы, у 5 (9,8%) второй и 6 (6,6%) пациентов третьей групп. Транзиторные ишемические атаки были диагностированы у 6 (3,6%) из 176 больных диабетом без эпизодов гипогликемии в дебюте инсульта.
В первой группе больных доля средней и тяжелой степеней неврологического дефицита по шкале NIНSS составила 56,8% (21 человек) и 16,2% (6), во второй группе – 43,1% (22) и 27,5% (14) соответственно, в третьей группе – 40,7% (37) и 34,1% (31) соответственно. При этом в первой группе пациентов представленность тяжелого инсульта была существенно ниже, чем в третьей группе больных, на 17,9% (χ2=4,08; р=0,044).
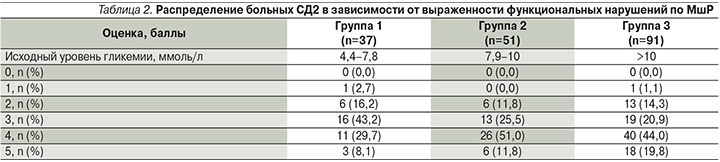
При оценке нарушений жизнедеятельности по шкале МшР получены следующие результаты (табл. 2). Встречаемость выраженных (4 балла) и грубых (5 баллов) функциональных нарушений при содержании сахара в крови 7,9–10,0 ммоль/л частота превысила показатели при гликемии 4,4–7,8 ммоль/л на 25,0% (χ2=5,33; р=0,021), при гликемии более 10,0 ммоль/л – на 26,0% (χ2=7,17; р=0,008).
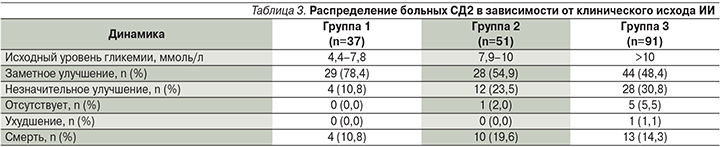
Наиболее низкая смертность к 21-м суткам от развития ИИ установлена в первой группе – 10,8%, что на 8,6% ниже показателей во второй группе и на 3,5% ниже значений в третьей группе (табл. 3). Среди пациентов первой группы с исходной нормогликемией представленность заметного улучшения была существенно выше, чем у пациентов второй группы, – на 23,5% (χ2=5,18; р=0,023), и у пациентов третьей группы – на 30,0% (χ2=9,68; р=0,002). Незначительная положительная динамика в первой группе больных определена достоверно реже, чем в третьей группе больных, – на 20,0% (χ2=5,59; р=0,019).
Обсуждение
Существующая доказательная база свидетельствует о том, что нарушения углеводного обмена играют важную роль в развитии ишемического инсульта, способствуя усилению выраженности проявлений заболевания и большей летальности [4, 13, 14]. Однако информация о состоянии гормонально-метаболического профиля в острейшем периоде ишемического инсульта противоречива и требует уточнения. До настоящего времени отсутствует единое мнение о роли гипергликемии в развитии инсульта: носит ли она физиологический или патологический характер?
Полученные нами результаты свидетельствуют о сопряженности клинических особенностей течения ИИ у больных СД2 с выраженностью нарушений углеводного обмена в дебюте заболевания. Установлена высокая представленность (76,3%) гликемии выше 7,8 ммоль/л – значение, расцениваемое у стационарных больных как гипергликемия и определяющее высокий уровень риска возникновения сердечно-сосудистых заболеваний у пациентов с диабетом [4, 15]. Следует также отметить высокую частоту гликемии при развитии инсульта более 10 ммоль/л, усиливающем негативные эффекты гипергликемии: 48,9% [16]. При этом отклонения уровня гликемии более 10 ммоль/л носили транзиторный характер и на 3-и сутки пребывания в стационаре достигали показателей, рекомендованных для больных СД в критических состояниях [17].
Среди обследованных больных обращает на себя внимание высокая представленность женщин, что, возможно, обусловлено более высокой распространенностью СД среди них [18].
Результаты исследования позволяют предполагать влияние уровня гликемии на развитие и течение острого периода ИИ у больных СД2. У пациентов с гипергликемией >10 ммоль/л установлена более высокая, чем у пациентов с содержанием сахара в венозной крови 4,4–7,8 ммоль/л, соответствующим целевым показателям контроля диабета, представленность тяжелой степени неврологического дефицита по шкале NIНSS, выраженных и грубых функциональных нарушений по шкале МшР.
Особое значение имеет то, что у больных СД2 высокий уровень гликемии в дебюте инсульта оказался ассоциированным с более высокой частотой летальных исходов и меньшим регрессом очаговой неврологической симптоматики. Минимальная летальность в остром периоде инсульта установлена у пациентов с гликемией 4,4–7,8 ммоль/л (10,8%), тогда как у остальных категорий пациентов с ИИ смертность была почти в 1,5–2,0 раза выше. У пациентов с СД2 наличие гипергликемии более 7,8 ммоль/л при развитии ИИ сопровождалось более низкой частотой благоприятного клинического исхода заболевания. Полученные нами результаты согласуются с мнением других авторов о взаимосвязи гипергликемии с негативным течением и клиническим исходом ИИ в остром периоде при наличии СД2 [7, 8].
Следует особо обратить внимание на гипогликемические состояния в дебюте ИИ у больных СД2, которые, несмотря на невысокую частоту встречаемости (3,8%), сопровождаются резким возрастанием летальных исходов.
Заключение
Таким образом, результаты исследования свидетельствуют о том, что у больных, страдающих СД2, развитие ИИ сопряжено с высокими уровнями гликемии более 7,8 ммоль/л. Гипергликемия в дебюте инсульта ассоциирована с существенным возрастанием представленности тяжелой степени неврологического дефицита, выраженного и грубого нарушения жизнедеятельности и меньшей встречаемостью заметной положительной динамики.
Вклад авторов
Концепция и дизайн исследования – Г.И. Ижбульдина, Л.Б. Новикова; получение данных, анализ и интерпретация результатов, обработка данных – Г.И. Ижбульдина; утверждение рукописи для печати – Л.Б. Новикова.



