Введение
Сезонный аллергический ринит (САР) представляет собой иммунологически опосредованную аллергическую реакцию 1-го типа в результате попадания аллергена, к которому чувствителен пациент, на слизистую оболочку полости носа. САР носит периодический характер, возникает в сезон опыления растений. Основные симптомы: ринорея, затруднение носового дыхания, чихание, зуд в полости носа, реже нарушение обоняния [1]. Описанные выше симптомы приводят к значительному снижению работоспособности и качества жизни пациентов, требуют высоких экономических затрат населения и здравоохранения в целом.
Согласно современной классификации аллергического ринита (АР), по характеру течения выделяют интермиттирующий АР (симптомы беспокоят менее 4 дней в неделю или менее 4 недель в году) и персистирующий АР (симптомы беспокоят более 4 дней в неделю или более 4 недель в году) [2].
Главным этиологическим фактором (триггером) служит пыльца ветроопыляемых растений, в связи с чем в литературе можно встретить другие названия САР — поллиноз, или сенная лихорадка [3]. В соответствии с календарем цветения (пыления) растений для средней полосы России выделяют три периода: весенний (алрель-май), связан с пылением деревьев (береза, орешник, ольха и др.), ранний летний (июнь-середина июля), цветение злаковых или луговых трав (овсяница, тимофеевка, мятлик, рожь и др.), поздний летний (осенний, середина июля-сентябрь), цветение сорных: сложноцветных (подсолнечник, полынь, амброзия), крапивных (крапива) и маревых (лебеда) [4].
Диагностика
К характерным жалобам пациентов с САР относятся прозрачные, водянистые выделения из носа, заложенность носа, пароксизмальное чихание, зуд в глазах и носу. Постоянный мучительный зуд в носу вынуждает пациентов к характерному движению ладонью в направлении вверх («аллергический салют») [3]. Также могут присутствовать симптомы аллергического конъюнктивита, такие как покраснение глаз, зуд, слезотечение.
Необходимо выполнение передней риноскопии и эндоскопического исследования полости носа: слизистая оболочка выглядит бледной с синеватым оттенком и отечной. Водянистые выделения могут быть как в полости носа, так и по задней стенке глотки. У некоторых пациентов возможно присутствие полипозных изменений слизистой оболочки полости носа.
Постоянное потирание носа может приводить к образованию горизонтальной складки на стыке кончика носа и переносицы (аллергическая складка), темных кругов под глазами вследствие инфраорбитального венозного застоя, а также двойных складок на нижних веках (симптом Денни-Моргана). У пациентов с АР в 3 раза возрастает риск развития бронхиальной астмы и атопического дерматита - атопический «марш» [5, 6].
Для выявления причинно-значимых аллергенов и определения целесообразности назначения аллерген-специфической иммунотерапии (АСИТ) рекомендуется проведение кожных проб (prick-тесты — тесты уколом, скарификационные и внутрикожные тесты), определение специфических IgE (иммуноглобулин Е)-антител, выполнение назального провокационного теста с аллергенами [3, 7].
На сегодняшний день на рынке представлены различные современные, удобные в использовании тест-системы — панели различных групп аллергенов. Во избежание ложноотрицательных кожных проб антигистаминные препараты, интраназальные глюкокортикостероиды (ИнГКС), антагонисты лейкотриеновых рецепторов должны быть отменены минимум за 3 дня до проведения тестирования.
Фармакотерапия сезонного АР
Основная цель фармакотерапии САР — контроль симптомов заболевания у пациента. Согласно международному руководству ARIA (Allergic Rhinitis and its Impact on Asthma), принципами терапии АР являются элиминационные мероприятия (предотвращение контакта с аллергеном), медикаментозная терапия, АСИТ и обучение пациента (информирование о существующих методах лечения заболевания и правильном использовании препаратов) [4]. Необходим индивидуальный подход и подбор ступенчатой терапии [7, 8].
Наиболее простым и удобным методом оценки степени выраженности клинических симптомов и контроля эффективности лечения на сегодняшний день является визуальная аналоговая шкала (ВАШ) в виде линейки от 0 до 10 баллов (от 0 до 10 см), где 0 — отсутствие симптомов, а 10 — максимально выраженные симптомы. На рис. 1 и 2 представлены алгоритмы для пациентов, ранее не получавших лечение и получавших терапию [4].
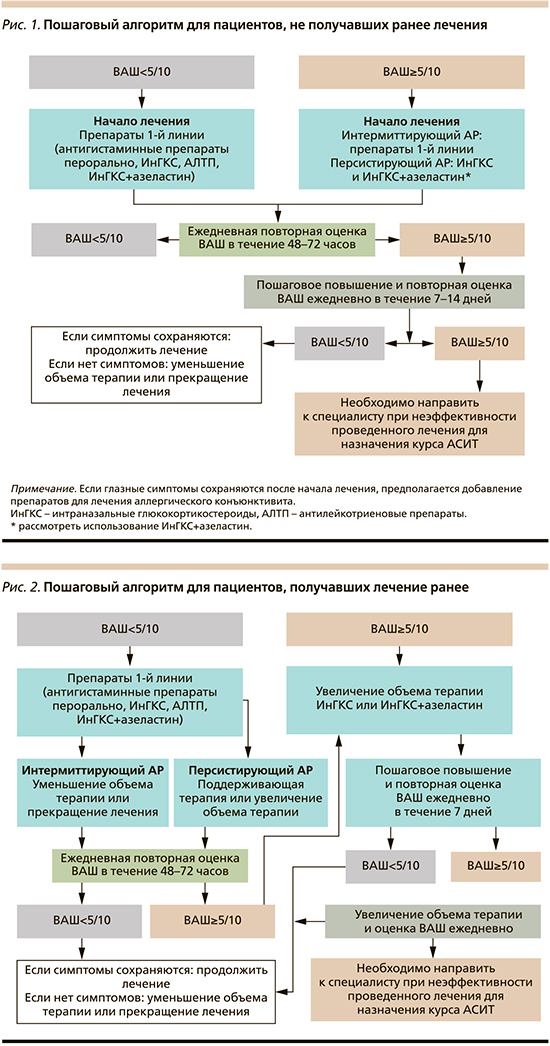
Всем пациентам с САР рекомендуется при наличии такой возможности предотвращение или минимизация контакта с триггером: некоторые пациенты с САР, вызванным цветением амброзии, даже вынуждены переезжать из регионов распространения растения. В 1994 г. М. Джеймс, работая на фабрике по производству косметической продукции, где в воздухе стояли облака из целлюлозного порошка, заметил, что никто из сотрудников не имел проявлений АР. Сын работника страдал АР, тогда М. Джеймс предложил ему вдохнуть некоторое количество порошка, после чего симптомы прекратились. С 2009 г. препарат на основе порошка микроцеллюлозы зарегистрирован в России [9].
Фармакотерапия САР включает антигистаминные препараты, ИнГКС, антагонисты лейкотриеновых рецепторов, моноклональные антитела.
Антигистаминные препараты, блокирующие Н1-рецепторы и устраняющие эффекты гистамина, играют важную роль в улучшении и поддержании качества жизни пациентов с АР. Среди антигистаминных препаратов наиболее предпочтительны антигистаминные препараты 2-го поколения и их активные метаболиты. Существенными недостатками препаратов 1-го поколения являются их низкая аффинность к рецепторам, короткая продолжительность действия, седативный эффект (сонливость, ощущение сухости слизистых оболочек, нарушение скорости реакции), что обусловлено высоким прохождением через гематоэнцефалический барьер и ингибированием центральных Н1-гистаминовых рецепторов [3, 4].
В рандомизированном двойном слепом исследовании клинической эффективности биластина (10 или 20 мг), фексофенадина (60 мг 2 раза с интервалом 12 часов) и плацебо, проведенном K. Hashiguchi et al. в 2017 г. с участием 136 пациентов с сенсибилизацией к пыльце японского кедра, выраженность назальных симптомов по общей шкале назальных симптомов в первый день после приема биластина 20 мг была значительно ниже, чем в группе пациентов, принимавших фексофенадин [10].
Азеластин является местным антигистаминным препаратом, для которого характерно быстрое начало терапевтического эффекта (через 15 минут), выпускается в форме глазных капель и спрея для интраназального применения. Также препаратами первой линии являются комбинации ИнГКС и азеластина [11].
ИнГКС - наиболее эффективные препараты 1-й линии для контроля симптомов АР. Они снижают высвобождение медиаторов воспаления и цитокинов, тем самым уменьшая воспаление слизистой оболочки полости носа. Наиболее эффективно снижают назальные и глазные симптомы АР при регулярном использовании, т.к. начало действия наступает через 7-12 часов, а максимальный эффект достигается в течение 2 недель [12]. Местные побочные эффекты включают эпистаксис, сухость слизистой оболочки носа, перфорацию носовой перегородки (редко), что чаще всего связано с неправильной техникой использования.
Исследования показали, что из-за меньшей дозы и более низкой биодоступности ИнГКС в отличие от ингаляционных ГКС существует меньший риск неблагоприятных событий, связанных с системной абсорбцией [13].
В исследовании P.T. Daley-Yates et al. (2021) проводится анализ фармакологических характеристик, клинической эффективности и безопасности препаратов. Такое физико-химическое свойство, как липофильность, обеспечивает большее сродство к тканям, наиболее липофильные ИнГКС (мометазона фуроат, флутиказона фуроат, флутиказона пропионат) обладают высоким сродством к рецептору и временем удерживания в полости носа по сравнению с гидрофильными молекулами (будесонид) [12, 14, 15].
E.O. Meltzer et al. исследовали дозовый диапазон флутиказона пропионата и пришли к следующему выводу: все исследуемые дозы значительно уменьшали тяжесть симптомов по сравнению с плацебо; снижение показателей общей оценки симптомов было немного больше при дозе (400 мкг 2 раза в сутки) по сравнению с меньшей дозой (25 мкг 2 раза в сутки), но разница не была значимой [12, 16].
В целом клинические исследования, сравнивавшие эффективность ИнГКС при лечении симптомов АР у взрослых, не выявили клинически значимых различий между препаратами при использовании в рекомендованных дозах [6, 17, 18].
Системное воздействие препаратов сильно различается, низкие значения связаны с малой дозой, биодоступностью и высоким системным клиренсом [12]. Высокие значения отмечены для будесонида (31%), низкие значения отмечены для мометазона фуроата (0,46%), флутиказона фуроата (0,50%), флутиказона пропионата (0,51%) [19, 20]. В связи с этим отличается и терапевтический индекс: ИнГКС с высокой аффинностью к рецепторам и низкой системной биодоступностью имеют более высокий терапевтический индекс [12].
Также в исследовании 2021 г. P.T. Daley-Yates et al. рассматривался вопрос влияния ИнГКС на темпы роста у детей. Было выявлено, что у препаратов с низкой биодоступностью отсутствует значительное влияние на темп роста (значение потенциала влияния, выраженного в долях, >1, для флутиказона пропионата - 150, мометазона фуроата - 120) [12].
Антагонисты лейкотриеновых препаратов эффективно воздействуют на симптомы заболевания, особенно при сочетании АР с бронхиальной астмой, не только действуя на назальные симптомы, но и уменьшая бронхиальную обструкцию [21].
Перспективным направлением в лечении пациентов с АР является применение моноклональных anti-IgE-антител. Препарат связывается с циркулирующими антителами, предотвращая взаимодействие с рецепторами на эффекторных клетках (тучные клетки, базофилы).
M.V. Kopp et al. (2009) изучали клиническую эффективность терапии АР на пыльцу трав и астмы при применении омализумаба или плацебо в сочетании с АСИТ. Авторы пришли к выводу, согласно которому комбинированное лечение омализумабом и АСИТ значительно уменьшает проявления АР, улучшает контроль симптомов аллергической астмы и качество жизни пациента по сравнению с группой плацебо-АСИТ [11, 22]. АСИТ рекомендована к применению пациентам с подтвержденной IgE-зависимой природой АР/риноконъюнктивита/астмы, неконтролируемыми симптомами заболевания или пациентам, которым требуются высокие дозы препаратов для контроля симптомов, при нежелательных побочных эффектах фармакотерапии или отсутствии приверженности пациента назначенной терапии. При АСИТ происходят повышение уровня аллерген-специфических IgG-блокирующих антител, снижение выработки аллерген-специфического IgE, снижение реактивности тучных клеток, базофилов и лимфоцитов, выработка супрессорных Т-клеток, а также снижение выработки некоторых лимфокинов [3].
Назначение АСИТ возможно с 5-летнего возраста [23]. Среди методов АСИТ выделяют подкожный (курс инъекций аллергена) и сублингвальный (аллерген в виде капель или таблеток). Доза определяется специалистом, под контролем которого проводится иммунотерапия. Поддерживающую терапию рекомендуется продолжать от 3 до 5 лет для достижения долгосрочного эффекта.
M.A. Calderon et al. (2007) провели мета-анализ рандомизированных контролируемых исследований с участием пациентов с САР и подтвержденной сенсибилизацией к аллергенам, которым проводилась подкожная АСИТ. Авторы пришли к выводу, соласно которому подкожная АСИТ приводит к значительному снижению и улучшению контроля симптомов САР [24]. Побочными эффектами подкожной АСИТ являются местные реакции (боль в месте инъекции, гиперемия, отек), в связи с чем может быть рекомендован предварительный прием антигистаминного препарата. Системные реакции — ангионевротический отек, крапивница, анафилаксия встречаются редко.
Заключение
Современные методы диагностики и лечения позволяют добиваться контроля симптомов САР, значительно улучшать качество жизни пациентов. ИнГКС играют важную роль в терапии заболевания, их клиническая эффективность и безопасность подтверждены в многочисленных исследованиях. Согласно международному руководству ARIA (Allergic Rhinitis and its Impact on Asthma), к пациентам с САР необходим индивидуальный подход и назначение ступенчатой терапии.



