Введение
Рак желудка (РЖ) занимает 5-е место среди онкологических заболеваний (1,313 млн случаев) и служит 3-й причиной смертности от рака (819 тыс. случаев смерти) в мире [1]. В настоящее время не вызывает сомнений, что злокачественная опухоль – это динамическая система, рассматриваемая в комплексе со всеми морфологическими составляющими, формирующими ее микроокружение: клетки стромы, клетки системы иммунитета, кровеносные, лимфатические сосуды и экстрацеллюлярный матрикс [1, 2]. Опухоль-инфильтрирующие лимфоциты (TILs – tumor-infiltrating lymphocytes) предсталяются объектом активного изучения [3–5]. Им отводится ключевая роль в концепции противоопухолевого иммунитета. Кроме этого клетки системного иммунитета как отвечают за подавление опухолевого роста [6], так и, напротив, коррелируют с неблагоприятным прогнозом [7, 8]. Таким образом, за последние 20–30 лет достигнуты большие успехи в терапии РЖ. Важным этапом в разработке новых терапевтических агентов стало понимание роли прогностических и предиктивных факторов, включая значение субпопуляционного состава иммунокомпетентных клеток и биологии опухоли.
Целью данной работы стало комплексное изучение структуры TILs, системного иммунитета до и в процессе лечения метастатических больных аденокарциномой желудка.
Методы
В проспективное исследование были включены больные метастатическим РЖ (мРЖ), проходившие лечение в ФГБУ НМИЦ онкологии им. Н.Н. Блохина с 2017 по 2018 г. Пациентам проведено 9 двухнедельных циклов химиотерапии (ХТ) I линии либо 6 трехнедельных курсов с последующим наблюдением до прогрессирования болезни. Анализ иммунного статуса по морфологическому материалу и периферической крови осуществлен дважды (до начала лечения и после 3–4 курсов ХТ).
Основные критерии включения пациентов в исследование: возраст старше 18 лет, морфологическая верификация опухоли – аденокарцинома желудка вне зависимости от стадии заболевания. Основные критерии исключения: наличие в анамнезе воспалительных заболеваний за последние 3 месяца, поддерживающая антибактериальная и иммуномодулирующая терапия на момент включения в исследование.
Анализ показателей субпопуляций лимфоцитов периферической крови и опухолевой ткани осуществлен методом проточной цитометрии в целях определения структуры иммунных клеток: степени инфильтрации опухолевой ткани лимфоцитами (CD45+CD14-TILs); Т-клеток (CD3+CD19-TILs); В-клеток (CD3-CD19+TILs); NK-клеток (CD3-CD16+CD56+TILs); эффекторных клеток CD16 (CD16+Perforin+TILs), CD8 (CD8+Perforin+TILs) и их цитотоксического потенциала – CD16ЦТПTILs и CD8ЦТПTILs; субпопуляций регуляторных Т-клеток – NKT-клеток (CD3+CD16+CD56+TILs), регуляторных CD4-- (CD4+CD25+CD127-TILs) и CD8-- (CD8+CD11b-CD28-TILs) клеток, а также данных показателей клеточного иммунитета.
Проточно-цитометрический анализ
Структуру субпопуляций иммунокомпетентных клеток оценивали по связыванию с моноклональными антителами различной специфичности методом многопараметрового количественного анализа на проточном цитометре FACSCalibur (BD Biosciences). Для каждого образца анализировали не менее 500–5000 клеток в CD45+-гейте. Использовали DotPlot-анализ цитограмм с коммерческим программным обеспечением BD CellQuest PRO software (BD Biosciences). Дальнейшую обработку FSC-файлов первичных цитометрических данных проводили с использованием программного пакета WinMDI, версия 2.8.
Статистическая обработка материала и расчеты показателей проведены с использованием статистического пакета программ Statistica for Windows v.10 и SPSS v.21. Достоверность различий между количественными показателями вычисляли по t-критерию Стьюдента для нормально распределенных величин или по непараметрическим критериям Манна–Уитни и Вилкоксона. Для сравнения качественных двух параметров применяли точный критерий Фишера и χ2-критерий. Различия считали значимыми при p<0,05 (95% точности). Степень взаимосвязи параметров оценивали с помощью корреляционного анализа по Спирмену.
Статистическая обработка материала и расчеты показателей проведены с использованием статистического пакета лицензионных программ Statistica для Windows v.10 (однофакторный анализ, корреляционный анализ по Спирмену, описательная статистика сравнения количественных показателей по Манну–Уитни, анализ Каплана–Майера) и SPSS v.21 (ROC-кривые, многофакторный анализ). Количественные переменные отклонялись от нормального распределения (тест Колмогорова–Смирнова) и представлены медианой с указанием 25-го и 75-го квартилей. Категориальные переменные выражали в процентах и абсолютных значениях.
Статистическую значимость различий между количественными показателями вычисляли по t-критерию Стьюдента, по непараметрическим критериям Манна–Уитни и Вилкоксона. Для сравнения качественных параметров применяли точный критерий Фишера и χ2-критерий. Различия считали значимыми при p<0,05 (допустимый уровень α-ошибки – 5%). Степень взаимосвязи параметров оценивали с помощью корреляционного анализа по Спирмену. Определение границ с оптимальным соотношением чувствительности и специфичности выполняли методом построения ROC (Receiver Operator Characteristic)-кривой.
Результаты исследования
В исследование были включены 20 пациентов с мРЖ: 9 (45%) мужчин и 11 (55%) женщин. Возраст пациентов варьировался от 44 до 64 лет (средний возраст – 58 лет). В зависимости от деления пациентов на возрастные группы до 45 лет; 46–60; старше 60 лет пациенты преимущественно относились к 3-й группе – 9 (45%) соответственно. Опухоль была низкодифференцированной у 12 (60%) больных мРЖ и представлена кишечным типом Lauren. Статус HER2neu был позитивным у 6 (30%) больных. У 20 больных нарушений в системе репарации не отмечено (MSS – Maximum segment size). Среднее время наблюдения за больными составило 16,4±6,2 месяца (от 0,7 до 23,6 месяца, медиана – 18,5 месяца). В хирургической группе у 2 (4%) пациентов имел место высокий уровень микросателлитной нестабильности (MSI).
Результаты исследования клеточного иммунитета в периферической крови представлены в табл. 1.
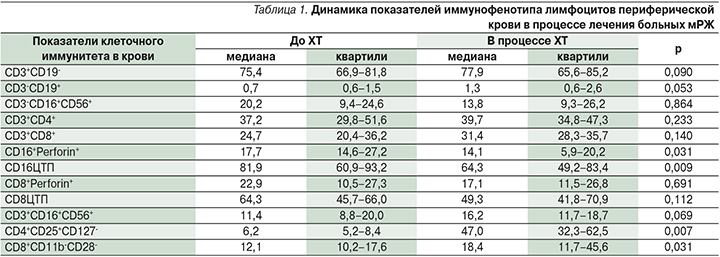
Таким образом, процентное содержание эффекторных CD16+-клеток и их цитотоксического потенциала до начала ХТ было выше, чем в процессе лечения (р=0,031; р=0,009). Однако после проведения 3–4 курсов ХТ отмечено статистически значимое повышение процента Т-регуляторных клеток с фенотипами CD4+CD25+CD127- (р=0,007) и CD8+CD11b-CD28- (р=0,031).
Для оценки возможности предсказать раннее прогрессирование у пациентов с мРЖ по показателям крови уже до начала лечения мы сравнили результаты исследования системного клеточного иммунитета в подгруппах, где прогрессирование заболевания зарегистрировано в сроки до 6 месяцев и позднее (табл. 2).
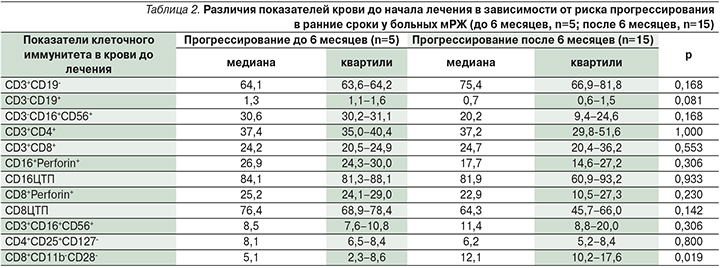
Из табл. 2 следует, что высокий уровень CD8 Т-регуляторных клеток с фенотипом CD8+CD11b-CD28- до начала лечения служит прогностическим фактором благоприятного прогноза (р=0,019).
Характер изменения показателей в процессе ХТ также может быть информативным для предсказания раннего прогрессирования, поэтому мы сравнили величину данного изменения в зависимости от сроков прогрессирования.
Однако у пациентов, обследованных в динамике, раннего прогрессирования не отмечено (до 6 месяцев). Поэтому для анализа динамики показателей мы выбрали границу сроков прогрессирования в 9 месяцев. Среди «линейной» структуры лимфоцитов медиана Т- и В-клеток растет у пациентов с прогрессированием до и после 9 месяцев, 8,3 против 2,4%; 283,3 против 22,9% соответственно. Уровень NK-клеток снижается у больных мРЖ с прогрессированием до 9 месяцев и обратно увеличивается при прогрессировании после 9 месяцев (-35,7 против 10,2%). Медианы CD4+- и CD8+-цитотоксических лимфоцитов до и в процессе терапии росли у пациентов с мРЖ при прогрессировании до и после 9 месяцев, 27,2 против 4,2%; 11,7 против 26,9% соответственно. Медианы эффекторных CD16- и CD8-клеток снижались у больных с прогрессированием заболевания до 9 месяцев и обратно росли при прогрессировании после 9 месяцев: -69,5 против 9,1%, -1,8 против 11,4% соответственно. Значения их цитотоксического потенциала снижались в обоих случаях: -21,5 против -16,2%, -9,6 против -1,2% соответственно. При этом статистически значимо изменялся процент в зависимости от времени прогрессирования (до и после 9 месяцев) эффекторные CD16-клетки с фенотипом CD16+Perforin+ – 69,5 против 9,1% соответственно (р=0,013). Дельты значений Т-регуляторных клеток с фенотипом CD4+- и CD8+-, а также NKT-клеток росли и составили 750,0 против 494,1%, 0,6 против 141,0% и 44,3 против 34,5% соответственно.
Таким образом, для больных мРЖ до начала лечения характерно повышение уровня эффекторных CD16+Т-клеток (р=0,031) и их цитотоксического потенциала (р=0,009), тогда как 3–4 курса ХТ увеличивают уровень CD4+- и CD8+ Т-регуляторных клеток: 0,007 и 0,031 соответственно. В то же время уровень CD8+ Т-регуляторных клеток служит прогностическим фактором благоприятного прогноза для выживаемости без прогрессирования (ВБП).
У пациентов с высоким уровнем CD8+-Т-регуляторных клеток до начала лечения статистически значимо выше вероятность пережить ВБП 6 месяцев (р=0,019). Однако увеличение уровня эффекторных CD16-клеток в процессе ХТ увеличивает вероятность пережить ВБП 9 месяцев (р=0,013).
Результаты исследования клеточного состава опухолевой ткани методом проточной цитометрии представлены в табл. 3.
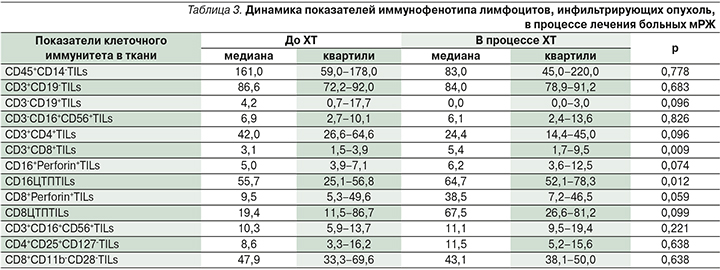
Из табл. 3 следует, что цитотоксический потенциал CD16+-ТILs- (р=0,012) и CD3+CD8+-ТILs- (р=0,009) клеток статистически значимо повышается в процессе ХТ у больных мРЖ.
Для оценки возможности предсказать раннее прогрессирование у пациентов с мРЖ уже до начала лечения мы аналогично сравнили результаты исследования локального иммунитета в подгруппах, где прогрессирование заболевания зарегистрировано в сроки до 6 месяцев и позднее (табл. 4).
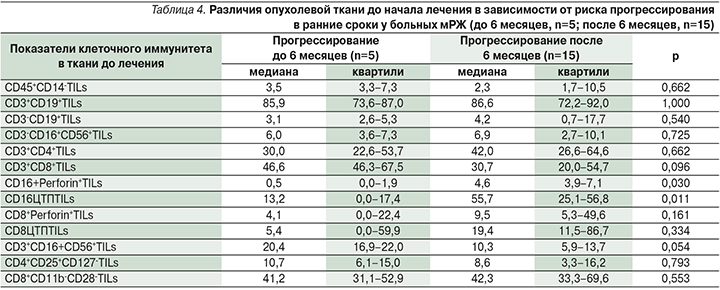
Таким образом, низкий уровень перфоринового потенциала эффекторных CD16-клеток (р=0,030) и их цитотоксического потенциала (р=0,011) до начала ХТ служит неблагоприятным фактором и моюет свидетельствовать о более высоком риске и вероятности прогрессирования до 6 месяцев.
При оценке характера изменения показателей в процессе ХТ для предсказания раннего прогрессирования мы также выбрали границу сроков прогрессирования в 9 месяцев. Отмечено, что для пациентов с прогрессированием до 9 месяцев характерно снижение степени инфильтрации опухолевой ткани лимфоцитами, NK-клеток, перфоринового потенциала эффекторных CD8-клеток и цитотоксического потенциала CD16- (-7,5% -18,1%; р=0,031) и CD8-клеток, а также CD8+-Т-регуляторных клеток, и, напротив, увеличение Т-клеток (22,0– -9,7%; р=0,012), CD8+-ЦТП, перфоринового потенциала эффекторных CD16-, NKТ-клеток (207,9– -13,8%; р=0,002) и CD4+-Т-регуляторных клеток (190,7– -25,2%; р=0,002). Однако у больных мРЖ с прогрессированием после 9 месяцев отмечается повышение степени инфильтрации опухолевой ткани лимфоцитами, NK-клеток, перфоринового потенциала эффекторных CD8-клеток и цитотоксического потенциала CD16-- и CD8-клеток, а также CD8+-Т-регуляторных клеток, а уровень Т-клеток, цитотоксических Т-лимфоцитов (ЦТЛ) CD8+-клеток, перфоринового потенциала эффекторных CD16-, NKТ-клеток и CD4+-Т-регуляторных клеток снижается.
Таким образом, для больных мРЖ с прогрессированием до 9 месяцев характерно статистически значимое увеличение Т-клеток (р=0,012), NKТ-клеток (р=0,002) и CD4+Т-регуляторных клеток (р=0,002). Напротив, повышение перфоринового потенциала эффекторных CD16-клеток (р=0,030) и их цитотоксического потенциала (р=0,011) служит благоприятным прогностическим фактором и увеличивает вероятность достигать длительную ВБП.
Данные изменения показателей локального и системного иммунитета в динамике указывают на увеличение цитотоксических CD8+-лимфоцитов, NKТ-клеток и CD4+Т-регуляторных клеток в периферической крови и опухолевой ткани в процессе лечения. Однако высокий уровень CD8+-Т-регуляторных клеток в периферической крови и низкий уровень перфоринового потенциала эффекторных CD16-клеток и их цитотоксического потенциала в опухолевой ткани до начала лечения свидетельствуют о низком и высоком риске и вероятности прогрессирования до 6 месяцев соответственно. В то же время повышение уровня эффекторных CD16-клеток в периферической крови и опухолевой ткани до и в процессе лечения – благоприятный прогностический фактор и увеличивает вероятность прогрессирования после 9 месяцев. Напротив, увеличение числа Т-клеток, NKТ-клеток и CD4+Т-регуляторных клеток в опухолевой ткани характерно для больных мРЖ с вероятностью прогрессирования до 9 месяцев.
Обсуждение
Развитие рака – сложный процесс, зависящий от взаимодействия отдельных клеток в опухоли, микроокружения и иммунной системы, которые могут как стимулировать, так и подавлять рост и инвазию опухоли [9].
В нашем исследовании представлено новое понимание механизмов, лежащих в основе дисфункции Т-клеток при проведении ХТ больных РЖ. Так, у 20 больных мРЖ после проведения 3–4 курсов ХТ отмечалось снижение перфоринового потенциала CD16+-клеток (CD16+Perforin+), 17,7 против 14,1% (р=0,031), и цитотоксического потенциала CD16+-клеток (CD16ЦТП), 81,9–64,3% (р=0,009). Напротив, содержание регуляторных минорных популяций лимфоцитов периферической крови с фенотипами CD4+CD25+CD127- и CD8+CD11b-CD28- статистически значимо увеличилось после 3–4 курсов ХТ и составило 6,2–47,0% (р=0,00007); 12,1–18,4% (р=0,031) соответственно. Однако результаты исследования Q. He et al. с включением 105 пациентов с местнораспространенным РЖ разнонаправлены. Образцы крови собирали до и через неделю после последнего введения ХТ. Процент CD3+CD8+-лимфоцитов увеличивался после ХТ, а содержание CD4+CD25+CD127-регуляторных Т-клеток снижалось (р=0,003 и р<0,001 соответственно). Повышение числа Т-лимфоцитов обусловлено активацией Т-клеточного иммунитета, но в нашем исследовании отмечалась лишь незначительная тенденция к их росту после 3–4 курсов ХТ – от 24,7 до 31,4%. Однако при оценке величины изменения показателей системного иммунитета до и в процессе ХТ из «линейной» структуры периферической крови только у Т-клеток (CD3+CD19-) наблюдается тенденция к их увеличению. Кроме этого у пациентов с высоким уровнем CD3+CD8+-ЦТЛ и низким уровнем CD4+CD25+CD127-Tregs отмечено увеличение общего выживания (р=0,012 и р=0,048 соответственно). По данным ряда исследований, у пациентов с различными видами новообразований выявлена корреляция между CD3+CD19- T-клетками и CD3+CD8+-ЦТЛ и благоприятным прогнозом. Однако, по данным Q. He et al., содержание CD3+CD19- Т-клеток и CD3+CD4+ЦТЛ после ХТ не изменилось и не коррелировало с клиническим течением заболевания, что согласуется с результатами нашего исследования [10].
Соответственно, корреляция между уровнем CD4+CD25+-CD127-Tregs и клиническим исходом указывает на их ключевую роль в прогнозе пациентов с РЖ и может служить биомаркером для выявления пациентов с наилучшим ответом на неоадъювантную ХТ.
При сравнении результатов исследования системного клеточного иммунитета в подгруппах, где прогрессирование заболевания зарегистрировано в сроки до 6 месяцев и позднее, выявлено, что высокий уровень CD8- Т-регуляторных клеток до начала лечения является прогностическим фактором благоприятного прогноза: 12,1 против 5,1% (р=0,019). Наши результаты согласуются с недавним исследованием субпопуляционного состава лимфоцитов периферической крови больных плоскоклеточным раком (ПКРГШ). При анализе данных 29 пациентов с ранними (I–II, n=16) и поздними (III–IV, n=13) стадиями ПКРГШ выявлено, что у больных ПКРГШ с ранними стадиями наблюдалось статистически значимое повышение процента CD8+CD11b-CD28- лимфоцитов, 40,0–28,6% [11]. По результатам анализа Т.Н. Заботиной и соавт., при анализе 29 пациентов с ранними и поздними стадиями ПКРГШ у больных ПКРГШ I–II стадий отмечено повышение содержания CD16-клеток по сравнению с III, IV стадиями: 22,1 против 18,0% [11]. Соответственно, увеличение числа эффекторных CD16-клеток с фенотипом CD16+Perforin+ в процессе ХТ увеличивает ВБП, что также согласуется с нашими результатами.
С учетом наших результатов и данных зарубежных исследователей можно предположить, что в периферической крови больных РЖ реализация эффекторных функций в процессе ХТ происходит за счет CD16-клеток, тем самым увеличивая вероятность пережить ВБП 9 месяцев.
Ряд исследований, посвященных распределению субпопуляций лимфоцитов в опухолевой ткани, показали, что TILs связаны с ответом на ХТ и прогнозом заболевания [12]. Так, в нашем исследовании при оценке изменения субпопуляционного состава в опухолевой ткани до и в процессе ХТ выявлено статистически значимое увеличение процентного содержания цитотоксического потенциала эффекторных CD16+TILs и CD3+CD8+-TILs, составив 3,1 против 5,4% (р=0,009), 55,7 против 64,7% (р=0,012) соответственно. Увеличение числа CD3+CD8+-TILs вместе с CD3+CD16+CD56+TILs, CD3+CD19-TILs после ХТ наблюдается и у пациентов с местнораспространенным раком молочной железы [13].
Далее при сравнительном анализе изменений показателей локального и системного иммунитета в динамике выявлено увеличение числа цитотоксических CD8-лимфоцитов, NKТ-клеток и CD4-Т-регуляторных клеток в периферической крови и опухолевой ткани больных мРЖ. По мнению ряда авторов, повышение уровня Tregs как в микроокружении опухоли, так и в периферической крови регистрируется у пациентов с раком желудочно-кишечного тракта, раком молочной железы, раком поджелудочной железы, гепатоцеллюлярным раком и т.д. [14–16]. Несмотря на противоречивые мнения об изменениях в лимфоцитах периферической крови и в образцах опухолевой ткани при РЖ, в недавнем японском исследовании 44 больных раком шейком матки при сравнительном анализе иммунных клеток в периферической крови и опухолевой ткани выявлено, что число CD3+CD19- Т-лимфоцитов значительно выше в опухолевой ткани, чем в периферической крови: 68,58 и 55,59% (р<0,001). Тем не менее наблюдалось значительное уменьшение популяции CD3+CD4+ Т-клеток в опухолевой ткани по сравнению с периферической кровью: 54,04 против 45,85% (р<0,013), тогда как уровень CD3+CD8+ Т-клеток значительно увеличился в опухолевой ткани по сравнению с периферической кровью: 32,37 против 44,92% (р<0,001). Более того, доля NK-клеток была значительно выше в опухолевой ткани, чем в периферической крови: 0,33 против 4,38% (р<0,079). При сравнении распределения различных подмножеств лимфоцитов между рецидивирующими пациентами и пациентами без признаков прогрессирования в опухолевой ткани у 35 больных без прогрессирования обнаружено статистически значимое увеличение CD3+CD4+-TILs: 48,07 против 33,12% (р=0,018) и увеличение CD3+CD8+-TILs у рецидивирующих больных раком шейки матки: 57,92 против 42,87% (р=0,015). Однако данные 44 больных по периферической крови оказались достоверно незначимыми [17].
Заключение
Соответственно, результаты показали, что распределение субпопуляций лимфоцитов в периферической крови – это не оптимальный метод прогноза заболевания, тогда как определение субпопуляций лимфоцитов в опухолевой ткани имеет прогностическую значимость. Полученные в данном исследовании результаты подтверждают, что наиболее полная информация о состоянии противоопухолевого иммунного ответа онкологических пациентов может быть получена только при одновременном изучении иммунных клеток периферической крови и клеток, инфильтрирующих опухолевую ткань.



