Введение
Меланома кожи (МК) – опухоль нейроэктодермального происхождения, возникающая в результате злокачественной трансформации меланоцитов, расположенных преимущественно в коже. Заболеваемость МК неуклонно увеличивается в большинстве европейских стран, а также в США и Австралии. Аналогичная тенденция роста заболеваемости наблюдается и в нашей стране. Так, по данным В.В. Старинского и соавт., в 2013 г. в России было зарегистрировано 8974 новых случая МК, а в 2015 г. число лиц с впервые установленным диагнозом МК составило уже 9384 [1–2].
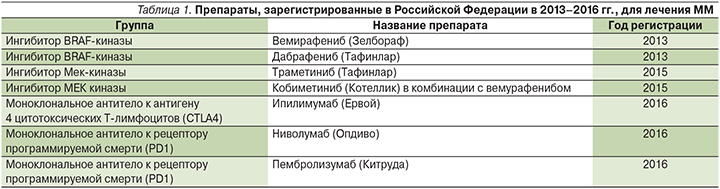
Прогноз пациентов с метастатической меланомой (ММ) в течение нескольких десятилетий оставался крайне неблагоприятным с медианой общей выживаемости 6–10 месяцев от момента появления отдаленных метастазов [3]. Химиотерапия долгие годы была единственной возможной опцией лечения для пациентов с ММ, однако ее применение не приводило к увеличению общей продолжительности жизни больных. Первые значительные успехи в лечении метастатической МК появились в 2011 г., когда было зарегистрировано 2 новых препарата: ипилимумаб (моноклональное антитело к антигену 4 цитотоксических Т-лимфоцитов) и вемурафениб (ингибитор мутантной формы BRAF-киназы). Оба препарата впервые продемонстрировали достоверное увеличение общей выживаемости пациентов с ММ по сравнению с контролем [4–5]. В настоящее время в нашей стране разрешены к применению 7 новых препаратов, представляющих 2 перспективных направления в лечении ММ: восстановление противоопухолевого иммунитета посредством блокады регуляторных молекул ключевых этапов иммунного ответа и блокада митоген-активированного протеинкиназного сигнального пути с помощью ингибиторов BRAF/MEK-киназ (табл. 1).
Следует, однако, отметить, что, несмотря на высокую эффективность новых препаратов, на фоне терапии более чем у половины пациентов развивается рефрактерность к проводимому лечению и не менее 40% больных умирают в течение первых 2 лет от момента начала лечения. Кроме того, важным фактором, органичивающим использование новых препаратов, является их высокая стоимость, что не позволяет обеспечить всех нуждающихся в лечении пациентов не только в России, но и в странах Европейского Союза [6].
Таким образом, в настоящее время химиотерапия, уступив лидирующие позиции в современных международных стандартах лечения, сохраняет свое значение как средство паллиативной помощи при развитии рефрактерности, а также в отсутствии доступа к новым возможностям лечения ММ [7].
Неудовлетворительные результаты стандартной химиотерапии при ММ стимулировали поиск новых противоопухолевых препаратов, которые могут быть потенциально эффективными при этом заболевании.
На сегодняшний день выделено 4 группы цитостатических химиопрепаратов (производные имидазол-карбоксамида, нитрозомочевины, платины, а также винкаалкалоиды), эффективность которых в режиме монотерапии при диссеминированной МК не превышает 10–15%. Практически все они были разработаны и испытаны за рубежом. В нашей стране проводилась активная научно-экспериментальная работа, направленная на создание оригинальных противоопухолевых препаратов [8]. Особый интерес вызывают результаты клинических исследований отечественного цитостатика группы производных нитрозомочевины – Аранозы.
Араноза – 3-α-L-арабинопиранозил-1-метил-нитрозомочевина, представляет собой метильное производное нитрозомочевины, в котором носителем цитотоксической группы является моносахарид L-арабиноза [9]. Препарат синтезирован в лаборатории химического синтеза Научно-исследовательского института экспериментальной диагностики и терапии опухолей Российского онкологического научного центра (РОНЦ) им. Н.Н. Блохина.
В доклинических исследованиях была отмечена удовлетворительная переносимость Аранозы в сочетании с другими цитостатическими препаратами без опасности критичного усиления их токсического действия. Это выгодно отличало Аранозу от других препаратов группы производных нитрозомочевины. При экспериментальном изучении на модели опухолей мышей LLC была показана возможность достижения терапевтического синергизма противоопухолевого действия комбинации Аранозы с топотеканом [10], цисплатином и гемцитабином [11], цисплатином и иринотеканом [12], цисплатином и этопозидом [13], а также цисплатином и топотеканом [14].
В ходе I фазы клинических испытаний Аранозы был отработан режим лечения – 550–800 мг/м2 внутривенно струйно 3 дня подряд или через день с повторением цикла каждые 4 недели, а также обнаружена противоопухолевая активность препарата при диссеминированной МК. Была определена дозолимитирующая токсичность Аранозы – миелосупрессия, которая возникала при дозе более 792 мг/м2 в виде лейкопении (55,5% пациентов), тромбоцитопении (22,0%). Среди других видов токсичности отмечены тошнота/рвота (72,8% пациентов) и диарея (10,2% пациентов).
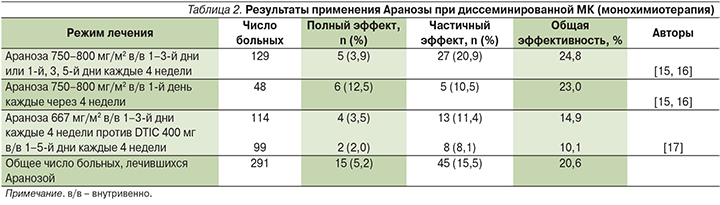
При проведении многоцентрового клинического исследования II фазы, включившего 129 больных метастатической МК, общая эффективность Аранозы составила 24,8% (32/129), включая 3,9% полных и 20,9% частичных регрессий опухоли. Переносимость лечения признана удовлетворительной, среди основных побочных эффектов отмечены тошнота/рвота и лейко-/тромбоцитопения 1–2-й степеней [15–16]. В другом исследовании II фазы, проведенном в РОНЦ им. Н.Н. Блохина и Онкологическом центре Грузии, у 48 больных, получивших лечение Аранозой в дозе 750–800 мг/м2 в течение 3 дней с интервалом 4 недели, общий эффект составил 23%, при этом у 12,5% больных длительность полных ремиссий достигла 6–18 месяцев (в среднем – 11 месяцев) [15–16 ].
С учетом полученных данных в отделении амбулаторных методов диагностики и лечения РОНЦ им. Н.Н. Блохина было проведено рандомизированное исследование, сравнивавшее эффективность применения Аранозы в дозе 667 мг/м2 внутривенно в течение 3 дней подряд или через день с повторением курса через 4 недели, с эффективностью дакарбазина – препарата, традиционно применяющегося в химиотерапии МК. Дакарбазин вводился в стандартном режиме по 400 мг внутривенно в течение 5 дней (2000 мг за один курс лечения).
Аранозу и дакарбазин получили 114 и 99 больных МК соответственно. Общая эффективность применения двух препаратов оказалась практически одинаковой: 14,9% – для Аранозы и 10,1% – для дакарбазина. Частота полного регресса опухоли составила 3,5 и 2%. Это исследование показало низкую активность стандартного режима лечения диссеминированной МК дакарбазином и целесообразность применения Аранозы в более высокой разовой дозе [17]. Результаты использования Аранозы в режиме монотерапии при диссеминированной МК суммированы в табл. 2 [18].
По данным 3 исследований, включивших 291 пациента, общая эффективность монотерапии Аранозой составила 20,6% (60/291), в т.ч. 5,2% полных регрессов длительностью от 6 до 18 месяцев. Выраженные клинические эффекты наблюдались при метастазах меланомы в лимфоузлы, кожу и подкожную клетчатку.
По результатам II фазы клинических испытаний Фармакологический комитет МЗ РФ в 1996 г. разрешил клиническое применение Аранозы при диссеминированной МК, что стимулировало работу по созданию лекарственных комбинаций на ее основе.
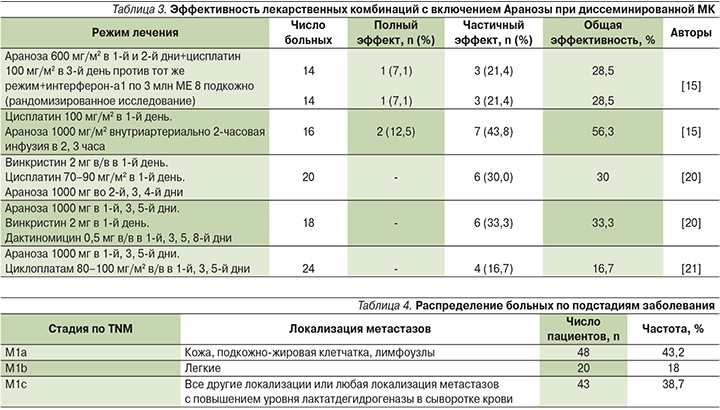
В табл. 3 представлены результаты исследований по изучению эффективности режимов комбинированной химиотерапии с использованием Аранозы, разработанных в отделении химиотерапии и отделении изучения новых противоопухолевых лекарств НИИ клинической онкологии РОНЦ им. Н.Н. Блохина [17–21].
В отделении биотерапии опухолей НИИ клинической онкологии РОНЦ им. Н.Н. Блохина проведено проспективное рандомизированное исследование по изучению эффективности комбинированной биохимиотерапии при ММ, составленной на основе отечественных противоопухолевых препаратов: Аранозы, реаферона (рекомбинантный интерферон α) и ронколейкина (рекомбинантный интерлейкин-2). Основные критерии включения: гистологически подтвержденная ММ, наличие измеряемых очагов поражения; ECOG (Eastern Cooperative Oncology Group) статус 0–2, отсутствие тяжелых сопутствующих заболевании; отсутствие аутоиммунных и аллергических заболеваний, отсутствие метастазов в головном мозге, возраст 18–70 лет.
С января 2003 по июнь 2006 г. в исследование включены 117 пациентов с ММ, из них доступны для анализа 111 больных (мужчин – 45, женщин – 66). Распределение больных по подстадиям заболевания представлено в табл. 4.
Оценка эффективности производилась по стандартным критериям оценки для солидных опухолей (RECIST – Response Evaluation Criteria In Solid Tumors), оценка токсичности – в соответствии с общепринятой шкалой Национального института рака (NCI CTC v.3). Оцениваемыми показателями эффективности были: частота ответа на лечение, длительность ответа, время до прогрессирования, а также оценка токсичности данных комбинаций. Режимы лечения включали следующие комбинации: Араноза+ронколейкин; Араноза+реаферон; Араноза+ ронколейкин+реаферон (табл. 5).
Указанные комбинации в качестве 1-й линии терапии получали 32,4% пациентов, у остальных 67,6% пациентов лечение проводилось во 2-й и последующих линиях лечения.
Эффективность изученных режимов приведена в табл. 6.
Как видно из представленных данных, наименее эффективным из исследуемых режимов оказалась комбинация Аранозы и ронколейкина (частота объективных ответов составила 17,6%). Достоверных различий в эффективности между режимами «Араноза+реаферон» и «Араноза+реаферон+ронколейкин» получено не было (частота объективных ответов составила 25 и 30% соответственно). В то же время по частоте достижения контроля заболевания наиболее выигрышно выглядит комбинация Аранозы и реаферона, где этот показатель составил 52,3%.
При анализе длительности ответа и времени до прогрессирования обращает на себя внимание, что комбинация, включающая Аранозу, ронколейкин и реаферон, вызывала более длительные ответы и увеличивала время до прогрессирования по сравнению с двумя другими режимами (табл. 7).
Объяснить эти различия в настоящее время не представляется возможным, поскольку они могут быть связаны как с малой выборкой пациентов, так и с синергичным действием комбинации цитокинов.
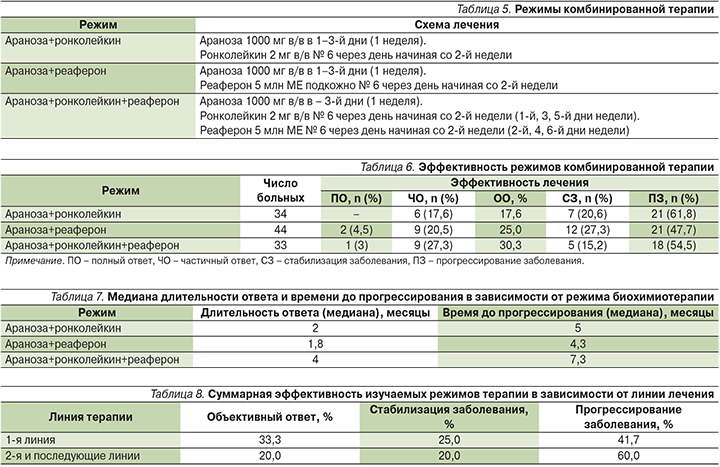
Дополнительно было изучено влияние предшествовавшего лечения на эффективность терапии (табл. 8).
Как и следовало ожидать, суммарная эффективность изучаемых комбинаций в 1-й линии терапии оказалась более высокой, чем во 2-й и последующих (частота объективных ответов – 33 и 20% соответственно, частота достижения контроля над заболеванием – 58 и 40% соответственно). Тем не менее полученные результаты указывают на потенциальную возможность использования комбинаций Аранозы после прогрессирования на фоне таргетных и иммуноонкологических препаратов.
Анализ переносимости показал, что наиболее частыми побочными эффектами Аранозы были лейко- и тромбоцитопении (III–IV степени выявлены у 25–30% пациентов). Среди наиболее частых побочных эффектов цитокинов отмечены гриппоподобный синдром, гипотония (в большинстве случаев I–II степеней).
Таким образом, результаты, полученные при изучении эффективности применения Аранозы у больных диссеминированной МК, а также умеренная токсичность и возможность проведения лечения в амбулаторных условиях послужили основанием для использованию данного препарата больными ММ в условиях ежедневной клинической практики [22].
Заключение
Данные экспериментальных и клинических исследований оригинального отечественного цитостатика Аранозы группы нитрозомочевины показали его эффективность у больных диссеминированной МК, не уступающую таковой дакарбазина, который до недавнего времени оставался стандартом лекарственного лечения меланомы. Препарат может быть рекомендован к использованию при ММ в монорежиме и в составе лекарственных комбинаций после прогрессирования на фоне современных таргетных и иммуноонкологических препаратов.



