Обоснование
Рак желудка является серьезной проблемой для современной онкологии [1–3]. Местнораспространенный рак желудка (МРРЖ) сопровождается различными метаболическими нарушениями, которые негативно влияют на переносимость противоопухолевого лечения, качество и продолжительность жизни пациентов [1]. Частота встречаемости нутритивной недостаточности (НН) среди пациентов с МРРЖ составляет от 40 до 60%, при этом распространенность саркопении достигает 30% [1–3]. Изучается роль НН как важного прогностического фактора эффективности неоадъювантной химиотерапии (НАХТ) у пациентов с МРРЖ. Наличие признаков НН у пациентов с МРРЖ связано с большим риском развития послеоперационных осложнений как инфекционной, так и неинфекционной природы [2, 3] и ведет к снижению показателей общесоматического статуса. Доказано, что наличие НН приводит к ограничению применения методов противоопухолевого лечения [4–13]. Стоит также отметить, что, согласно результатам некоторых исследований, предиктором высокой токсичности лекарственной терапии служит наличие саркопении у пациентов с МРРЖ [8–20].
Большая часть исследований, изучающих прогностическую роль НН в противоопухолевом лечении рака желудка, включала сведения, основанные на небольших выборках пациентов. При этом в исследованиях внимание уделялось исходам хирургических вмешательств [1–20]. Все вышеизложенное и определило актуальность настоящего исследования, посвященного изучению прогностической роли НН и саркопении у пациентов с МРРЖ, получавших НАХТ.
Цель исследования: оценить прогностическую роль НН и саркопении у пациентов с МРРЖ, получавших НАХТ (ретроспективное исследование).
Методы
Проанализированы ретроспективные данные 100 пациентов с МРРЖ (T2-4N0-3M0), средний возраст – 56,9 (45,9–67,9) года, из них 65 мужчин и 35 женщин, получавших НАХТ на базе НМИЦ онкологии им. Н.Н. Петрова за 2013–2018 гг.
Протокол исследования был одобрен на заседании локального этического комитета ФГБУ НМИЦ онкологии им. Н.Н. Петрова Минздрава РФ (выписка № 11/171 от 18.10.2018).
На основании данных медицинской документации были проанализированы сведения о нутритивном статусе (НС) пациентов, включившем антропометрические данные (рост, масса тела, индекс массы тела) на момент начала НАХТ, а также информацию о потере массы тела в анамнезе до момента начала специализированного лечения. НН определялась как наличие низкого значения ИМТ (<18,5 кг/м2) и/или потери массы тела на 5% в течение 3 месяцев.
Саркопения оценивалась по данным мультиспиральной компьютерной томографии (МСКТ) на этапе первичной диагностики и после завершения НАХТ с целью расчета скелетно-мышечного индекса (СМИ) (рис. 1).
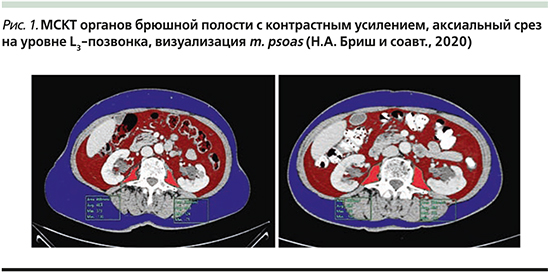
Данный показатель СМИ позволяет оценить объем общей мышечной массы тела (ММТ) человека. Для расчета СМИ на аксиальном срезе на уровне позвонка L3 определяют общую площадь поясничных мышц (см2). Для вычисления СМИ полученное значение необходимо разделить на квадрат роста пациента (м2) (см. формулу). Пороговые значения СМИ, ниже которых объем ММТ оценивается как саркопения, для мужчин составляет 52,4 и для женщин – 38,5 см2/м2 [21].
-
Всем пациентам с целью диагностики распространенности опухолевого процесса и планирования дальнейшего лечения на первом этапе была выполнена диагностическая лапароскопия с получением смывов с брюшной полости и срочным цитологическим исследованием. В дальнейшем все пациенты получали НАХТ. Всего проведено 340 циклов НАХТ на основе фторпиримидинов, в среднем 3–4 цикла. После оперативного вмешательства пациенты продолжили адъювантную химиотерапию внезависимости от степени патоморфологического регресса опухоли. По данным КТ, выполнявшейся каждому пациенту после завершения этапа НАХТ, также была оценена частота объективных ответов на лечение, согласно системе критериев оценки ответа солидных опухолей (RECIST 1.1). Степень патоморфологического регресса опухоли определялась согласно четырехуровневой системе оценки Японской ассоциации по изучению рака желудка (JGCA, 2017).
Степень нежелательных явлений (НЯ) оценивали согласно критериям NCI CTCAE v5.0. Среди НЯ, развивавшихся на фоне НАХТ, наибольший интерес представляли такие, как нейтропения 3–4 ст., фебрильная нейтропения (ФН), тошнота и рвота 2–3 ст., мукозиты 1–3 ст., астенический синдром 2–3 ст., венозные тромбоэмболические осложнения (ВТЭО).
Описательная статистика для качественных данных приводилась в виде числа пациентов, обладающих исследуемым признаком, и доли размера этой подгруппы пациентов в общей группе, выраженной в процентах, различия между выборками – критериями Стьюдента или ранговым критерем Манна–Уитни. Нормальность распределения определялась критерием Колмогорова–Смирнова. Кривые дожития строились по методу Каплана–Мейера и сравнивались при помощи логрангового критерия. Уровень значимости равнялся 0,05. Анализ статистических данных проводился в программе IBM SPSS 20.0.
Результаты исследования
До начала НАХТ НН была зарегистрирована у 47 (47%) пациентов с МРРЖ, после НАХТ – у 62 (62%); саркопения – у 11 (11%) и 22 (22%) пациентов соответственно.
У пациентов без признаков НН частичный регресс наблюдался в 71% случаев, что превышает данный показатель (41,9%) в группе с НН (р=0,001).
Частота полного регресса (pCR, G3 по классификации JGCA, 2017) у пациентов с НН составила 4,8%, у пациентов без НН – 23,7% (р<0,001). Распределение по степеням патоморфологического регресса на лечение (G) в группах с признаками НН и без них представлено в табл. 1.
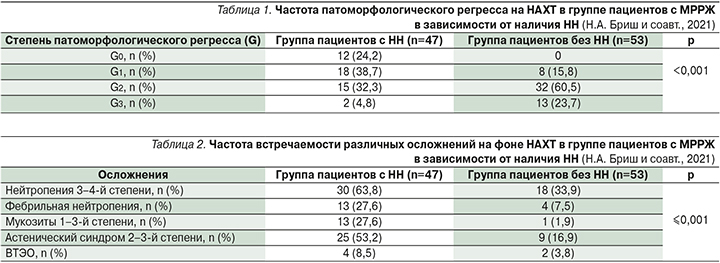
При оценке частоты развития осложнений у пациентов с МРРЖ на фоне НАХТ были получены следующие данные: у пациентов с НН нейтропения 3–4-й степени встречалась в 63,8%, у пациентов без НН в 2 раза реже – у 33,9% пациентов (р≤0,001). Частота развития ФН составила 27,6%, в группе без НН – 7,5% (р=0,001). Мукозиты 1–3-й степени развились у 27,6% пациентов с НН, у пациентов без НН – в 1,9% случаев (р≤0,001) (табл. 2).
По результатам проведенного ретроспективного исследования доказано, что НН является важным прогностическим фактором, что подтверждается результатами оценки 5-летней БСВ и ОВ пациентов с МРРЖ.
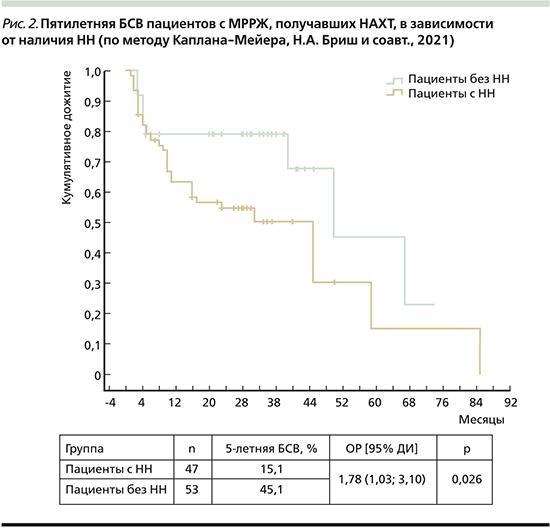
Значение показателя 5-летней БСВ в группе пациентов с НН составило 15,1%, в группе без НН – 45,1% (отношение рисков [ОР]=1,78, 95% доверительный интервал [ДИ]: 1,03–3,10; р=0,026, рис. 2).
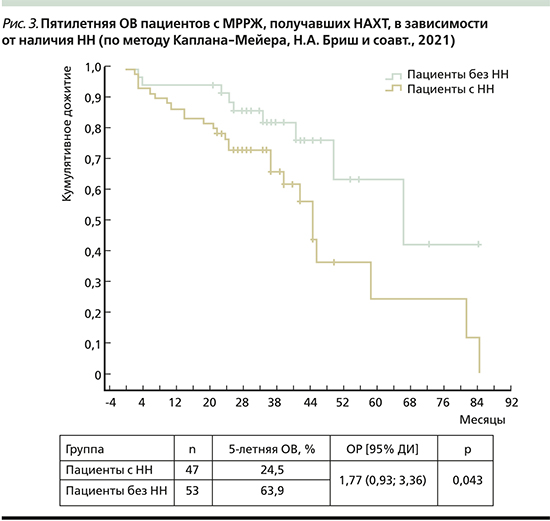
Показатель 5-летней ОВ в группе пациентов с НН составил 24,5%, тогда как для пациентов без НН ОВ достигла 63,9% (ОР=1,77, 95% ДИ: 0,93–3,36; р=0,043, рис. 3).
При этом наличие саркопении в группе пациентов с МРРЖ с НН не оказало влияния на показатели выживаемости пациентов с МРРЖ (p>0,05).
Обсуждение
Проблема НН весьма значима в онкологической практике, в особенности среди пациентов с злокачественными новообразованиями желудочно-кишечного тракта. Согласно полученным данным ретроспективного исследования, НН является неблагоприятным прогностическим маркером объективного и патоморфологического ответов на НАХТ. По результатам проведенного ретроспективного исследования частота НН среди пациентов с МРРЖ составила 50%, что соответствует данным ранее проведенных исследований [1–3].
Также впервые установлено, что частота осложнений коррелирует с наличием НН до начала НАХТ. При анализе литературных источников было установлено, что в ходе проведения подобных исследований не оценивалось влияние НН на частоту осложнений НАХТ [1–3, 8–10, 13, 17].
Впервые оценена прогностическая долгосрочная значимость НН на фоне НАХТ у пациентов с МРРЖ по результатам 5-летней БСВ, которая составила 45,1% без НН против 15,1% у пациентов с НН (ОР=1,78, 95% ДИ: 1,03–3,10; р=0,026) и 5-летней ОВ – 63,9 и 24,5% соответственно (ОР=1,77, 95% ДИ: 0,93–3,36; р=0,043).
В ходе проведенного ретроспективного исследования были получены неоднозначные данные относительно роли саркопении у больных МРРЖ при проведении НАХТ. По результатам исследования частота саркопении была зарегистрирована у 11% до начала НАХТ и у 22% пациентов МРРЖ после завершения НАХТ. Это свидетельствует о том, что факт проведения лекарственного лечения негативно влияет на состояние скелетной мускулатуры. Полученные результаты соответствуют литературным данным [1, 8, 9, 23, 24]. Однако наличие саркопении, по результатам исследования, не оказывало влияния на показатели выживаемости больных МРРЖ, прошедших этап НАХТ. Аналогичные данные были получены в исследовании Mirkin K.A. et al., где было показано, что у пациентов с аденокарциномой желудка, проходящих НАХТ, у которых была саркопения практически в 2 раза чаще развивались осложнения в послеоперационном периоде, по сравнению с пациентами без саркопении (р=0,005), но также не было показано влияние саркопении на показатели выживаемости, что, по мнению авторов, может быть связано с малой выборкой пациентов, вариабельностью критериев оценки саркопении, ретроспективностью исследования и требует дальнейшего изучения [8]. В то же время Palmela C. et al, показали, что наличие саркопении и саркопенического ожирения у больных МРРЖ было ассоциировано с ранним прекращением НАХТ, а у пациентов с саркопеническим ожирением были достоверно хуже показатели общей выживаемости [9].
В исследовании Tan et al. было показано, что саркопения является важным предиктором дозолимитирующей токсичности у больных местнораспространенным раком пищевода и желудка, проходящих НАХТ, кроме того медиана общей выживаемости у пациентов с саркопенией была в 1,8 раза меньше, по сравнению с пациентами без саркопении (р=0,04) [23]. Разнородность полученных данных отчасти может объясняться тем, что до сих пор не существует единых референсных значений СМИ для определения саркопении, поэтому зачастую в исследованиях используются различные значения данного показателя, что влечет за собой определенные сложности для интерпретации полученных данных. Кроме того, авторы ряда исследований заявляют о существовании ограничений в проведенных исследованиях (малая выборка, разнородность групп пациентов, включение сведений об азиатской популяции больных МРРЖ и т.д.), которые также могли оказать влияние на полученные результаты. Следовательно, для получения достоверных результатов оценки роли саркопении в комплексном лечении больных МРРЖ необходимо дальнейшее изучение проблемы с проведением более крупных исследований. В то же время важно отметить, что согласно последним рекомендациям Европейского общества медицинской онкологии ESMO (European Society for Medical Oncology) саркопения является центральным фактором, влияющим на клинические исходы противоопухолевого лечения, а применение противоопухолевых препаратов признано важной причиной развития саркопении [22].
Заключение
Проведенный ретроспективный анализ свидетельствует о том, что нутритивная недостаточность является неблагоприятным прогностическим фактором эффективности неоадъювантной химиотерапии у больных местнораспространенным раком желудка, достоверно влияющим на показатели 5-летней общей и бессобытийной выживаемости. В связи с чем, как при проведении противоопухолевого лечения, так и на этапе подготовки к нему, важно своевременное выявление у пациентов нутритивной недостаточности или риска ее развития и проведение нутритивной поддержки, которая на сегодняшний день неоспоримо является неотъемлемой частью лечения пациентов со злокачественными новообразованиями.
Вклад авторов. Н.А. Бриш – сбор и обработка материала, написание текста, редактирование, ответственность за целостность всех частей статьи. Т.Ю. Семиглазова – концепция и дизайн исследования, утверждение окончательного варианта статьи, ответственность за целостность всех частей статьи. Е.В. Ткаченко, Т.С. Голованова – редактирование, утверждение окончательного варианта статьи. Я.А. Ульянченко, Ю.В. Алексеева, С.М. Шарашенидзе – сбор материала. Л.В. Страх – сбор материала, статистическая обработка. А.М. Карачун, А.С. Артемьева, Л.Н. Шевкунов, Л.В. Филатова, В.В. Семиглазов, Б.С. Каспаров, С.А. Проценко, А.М. Беляев – утверждение окончательного варианта статьи.



