Введение
Соматическая патология значительно повышает материнские риски [1, 2]. Роды и послеродовой период без коморбидного терапевтического фона (с минимальным индексом коморбидности) связаны с низким уровнем материнской заболеваемости [3]. Сопутствующая патология внутренних органов ассоциирована с пятикратным увеличением вероятности материнской смерти от прямых осложнений беременности [4]. Исследования материнской заболеваемости представляют эффективный способ мониторинга стандартов акушерской помощи, в то время как изучение качества материнской помощи является альтернативной стратегией снижения материнской смертности [5].
Коморбидность все чаще рассматривают как фактор риска бактериальных инфекций, устойчивых к антибиотикам [6]. Высокая степень коморбидности в первую очередь негативно влияет на прогноз и тяжесть послеродовых инфекционно-воспалительных осложнений [4]. Следовательно, стратификацию риска послеродовых осложнений и выбор метода их профилактики у беременных следует осуществлять дифференцированно в зависимости от коморбидного состояния. Однако на сегодняшний день окончательно не определены экстрагенитальные заболевания (ЭГЗ), патогенетически связанные с развитием послеродовой инфекции. Ранее E.V. Kuklina et al. обнаружили, что только кесарево сечение (КС) и сочетание хронических соматических инфекций были ассоциированы с увеличением числа тяжелых послеродовых инфекционных осложнений [7]. По мнению авторов этого исследования, только острые соматические бактериальные инфекции и/или обострения хронических инфекций при беременности коморбидны, т.е. патогенетически связаны с кластерным заболеванием – послеродовым (послеоперационным) эндометритом, а все остальные являются лишь параллельно сосуществующей патологией. При полиморбидности хроническая патология протекает изолированно от основного заболевания, не конкурирует с ним и не служит фоном для его развития. Однако число исследований, позволяющих достоверно устанавливать причинно-следственные связи основного (индексного) заболевания и адекватно классифицировать коморбидность/полиморбидность, согласно выявленным патогенетическим механизмам, ограниченно. Не закончена и валидация (проверка на пригодность) прогностических шкал и индексов коморбидной патологии у акушерских пациентов.
Терминологическая путаница и отсутствие единой классификации сочетанных заболеваний висцеральных систем значительно осложняют сложившуюся ситуацию. В статьях отечественных авторов по специальности «акушерство и гинекология», индексированных в базе данных Российского индекса научного цитирования (РИНЦ), в подавляющем большинстве случаев понятия «коморбидность» и «полиморбидность» использованы как синонимы. Указанные термины традиционно заменяют на «экстрагенитальная патология» и «сопутствующие заболевания», при этом не выделяют основной патологии (перечислены заболевания, объединенные лишь на том основании, что они не являются акушерским осложнением беременности), т.е. авторы не применяют классическое определение коморбидности, предложенное A.R. Feinstein более 50 лет назад [8].
Термин «экстрагенитальная патология» встречается исключительно в отечественных исследованиях, при этом экстрагенитальную патологию традиционно подразделяют на первичную (существующие до наступления беременности и параллельно ей протекающие сочетанные хронические заболевания) и вторичную (возникающую при беременности и этиопатогенетически связанную с ней). Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. В.И. Кулакова предлагает следующее определение: «Вторичная экстрагенитальная патология включает состояния, этиологически связанные с беременностью и, как правило, проходящие по ее окончании; к наиболее частым и наиболее значимым ее видам относят: анемию беременных, гестационную гипертензию, гестационный диабет, гестационный пиелонефрит, тромбоцитопению беременных, холестатический гепатоз беременных (акушерский холестаз), острую жировую дистрофию печени, перипартальную кардиомиопатию, несахарный диабет беременных, гестационный гипертиреоз, глюкозурию беременных» [9]. Согласно данной трактовке, при оценке коморбидных состояний в акушерстве вместо индексного (исследуемого) заболевания выделяют беременность, вторичным ЭГЗ является любая патология, возникшая на фоне беременности, а первичные ЭГЗ – это параллельно сосуществующие хронические заболевания (преморбидный фон), этиологически не ассоциированные с беременностью. Однако это противоречит определению, приведенному в национальных клинических рекомендациях «Коморбидная патология в клинической практике» (2019), где под термином «коморбидность» следует понимать «сосуществование у одного больного двух или более хронических заболеваний, этиопатогенетически взаимосвязанных или совпадающих по времени появления вне зависимости от активности каждого из них» [10].
При коморбидности в структуре акушерского диагноза нет четкости в определении основного, конкурирующего и фоновых заболеваний, сопутствующей патологии и осложнений. «Основное заболевание – состояние, которое самостоятельно или за счет развития осложнений вызывает первоочередную необходимость оказания медицинской помощи в связи с наибольшей угрозой работоспособности, жизни и здоровью, либо приводит к инвалидности, либо становится причиной смерти» [11] (статья 2, пункт 18, Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации»). При формулировании предварительного или промежуточного клинического диагноза основным считают заболевание, ставшее причиной обращения к врачу, госпитализации и лечебно-диагностических мероприятий.
Согласно принятым критериям формулирования диагноза, послеродовую инфекцию чаще всего регистрируют во время госпитализации в акушерском стационаре, она не служит непосредственной причиной обращения за медицинской помощью, что является определяющим для основного заболевания. В связи с этим выделить основную, прогностически неблагоприятную патологию и ее непосредственные осложнения бывает крайне сложно, особенно при наличии конкурирующих заболеваний.
Нередко даже данные аутопсии не позволяют с уверенностью оценить наибольший вклад в танатогенез всех имеющихся у родильницы нозологических форм, чтобы выделить основ-ную.
В специальной литературе практически отсутствуют исследования, посвященные сопряженным ЭГЗ и т.н. осложненной коморбидности [12] с дебютом в послеродовом периоде. Сочетание хронических заболеваний негативно сказывается на процессе послеродовой инволюции, что может играть триггерную роль в патогенезе послеродового эндометрита [1].
В более ранних наших исследованиях установлено, что ряд хронических заболеваний, таких как железодефицитная анемия, ожирение и артериальная гипертензия, выступают факторами риска развития послеродовой субинволюции матки. Контрактильная недостаточность миометрия и нарушение дренажной функции матки предрасполагают к послеродовым кровотечениям и восходящей инфекции (Н.А. Коробков и др., 2006).
Поздний репродуктивный возраст часто ассоциируется с увеличением коморбидности, но в отношении оценки степени рисков у беременных нет однозначного мнения. Отсутствуют национальные проспективные регистры для изучения структуры факторов риска, сопутствующей патологии, качества лечения и исходов при послеродовой инфекции. В реальной клинической практике послеродовую коморбидность в основном связывают с урогенитальной инфекцией, а наиболее специфическими и достоверными факторами риска развития послеродовой инфекции являются исключительно осложнения в родах [13].
Таким образом, несмотря на возросший интерес к коморбидным состояниям, концепция полиморбидности еще не интегрирована в акушерскую практику.
На настоящий момент не разработан и унифицированный подход к оценке коморбидного статуса акушерских пациентов. В клинической практике более важна не классификация сопутствующих заболеваний на коморбидные/полиморбидные, а оценка полиморбидности с позиции прогноза заболевания и необходимости диспансерного наблюдения.
Для этого в терапевтической практике используют два основных подхода:
- простое статистическое суммирование сопутствующих заболеваний;
- интегральную оценку коморбидных патологических состояний, позволяющую стратифицировать пациентов по удельному весу коморбидности для долгосрочного прогнозирования.
Наиболее часто характеристики пациента и сопутствующие заболевания обобщают в виде индекса или баллов с целью прогнозирования неблагоприятных клинических исходов, длительности пребывания пациента в стационаре и госпитальных расходов.
Увеличение бремени ассоциированных заболеваний, осложняющих послеродовой (послеоперационный) период, о чем свидетельствует увеличение индекса коморбидности, сопровождается ростом распространенности тяжелой материнской заболеваемости и смертности [14]. Индекс сопутствующей патологии отражает бремя заболеваний у матери и служит перспективным инструментом для оценки степени материнского риска и разработки профилактической стратегии.
Наиболее широко в качестве инструментов контроля, прогноза и оценки сопутствующей патологии используют адаптированные варианты индекса коморбидности M.E. Charlson (ССI – Charlson comorbidity index), кумулятивной шкалы рейтинга заболеваний (CIRS – Cumulative Illness Rating Scale) и индекс Kaplan–Feinstein (KF). Включенные в указанных шкалах факторы риска неспецифичны, что позволяет их применять при широком спектре нозологий.
Так, в исследованиях J.C. McGregor et al. впервые успешно применены указанные инструменты измерения риска в качестве предикторов колонизации или инфицирования госпитальными штаммами метициллин-устойчивого золотистого стафилококка (MRSA – Methicillin-resistant Staphylococcus aureus) и устойчивых к ванкомицину энтерококков (VRE – Vancomycin-resistant Enterococcus) среди госпитализированных пациентов [6].
Дальнейшие исследования показали недостаточную эффективность широко распространенных общих физиологических показателей для беременных и родильниц, например шкала оценки острых физиологических расстройств и хронических нарушений (APACHE – Acute Physiology and Chronic Health Evaluations), шкала модели вероятности наступления смертельного исхода (MPM – Mortality probability models), упрощенная шкала оценки физиологических расстройств (SAPS – Simplified Acute Physiology Score) и их адаптации [15–17].
Развитие и оптимизация индексов для оценки риска у беременных и родильниц представляют перспективную область будущих исследований.
Разнообразный коморбидный фон, полиморбидность у беременных, лекарственный патоморфоз и неизбежная полипрагмазия ставят перед акушером-гинекологом сложные клинические задачи, для решения которых необходимы междисциплинарный подход и учет всех особенностей, в первую очередь при выборе персонализированных схем антимикробной профилактики и лечения. Прогнозирование во время беременности послеродовой инфекции обусловлено стремлением выявить женщин с высоким риском развития осложнений, чтобы на раннем этапе можно было принять необходимые меры для предотвращения или по крайней мере снижения частоты возникновения инфекций. Однако до сегодняшнего дня не определены клинико-патогенетические варианты ЭГЗ терапевтического профиля, ассоциированных с высоким риском развития послеродовой инфекции. Отсутствуют данные об их распространенности у беременных, о применении индекса коморбидности в акушерстве и о его прогностической значимости, доказательства синтропии или нейтропии ЭГЗ с послеродовыми инфекционно-воспалительными осложнениями.
Цель исследования: изучение коморбидности у родильниц с эндометритом после КС и выявление эффективного инструмента ее оценки для последующей стратификации пациенток на терапевтические группы с разной степенью интенсивности антимикробного лечения.
Методы
Проведено ретроспективное исследование 597 историй болезни родильниц, родоразрешенных путем операции КС, из них 355 с диагнозом «эндометрит после кесарева сечения» и 242 с физиологическим течением послеоперационного периода. С целью оценки влияния ЭГЗ на течение и прогноз послеоперационных инфекционно-воспалительных осложнений после абдоминального родоразрешения все родильницы с эндометритом были разделены на группы: основную (n=164) – с двумя и более сопутствовавшими первичными ЭГЗ, и сравнения (n=191) – без отягощенного соматического фона или с вторичными ЭГЗ; контрольную группу составили 242 родильницы с неосложненным течением послеоперационного периода после абдоминального родоразрешения.
Для оценки бремени ассоциированных заболеваний, осложняющих послеродовой (послеоперационный) период, в исследуемых группах были рассчитаны число сопутствующих ЭГЗ, приходящихся на одну пациентку, и средние значения основных индексов коморбидности (ССI, CIRS, KF и Bateman). Определена эффективность указанных индексов в стратификации родильниц на терапевтические группы для предсказания неблагоприятного прогноза при послеродовой инфекции. Дополнительно у всех родильниц проанализированы результаты микробиологического исследования метро-аспирата для выявления резистентных к антибиотикам микроорганизмов.
ССI был разработан для прогнозирования смертности среди полиморбидных пациентов стационара, а затем валидизирован для амбулаторного контроля [18]. CIRS дает универсальную возможность вне зависимости от возраста определять тяжесть и число наиболее часто встречающихся сопутствующих соматических заболеваний, что позволяет составить прогноз в отношении множества нозологий и оценить их течение [10]. KF используют как показатель коморбидности для прогнозирования 5-летней общей выживаемости при инсулиннезависимом сахарном диабете [10]. Однако на сегодняшний день отсутствует интерпретация общего показателя этих индексов и не валидированы его пороговые значения у акушерских пациентов.
В литературе можно найти единичные сообщения об успешном применении индексов в рутинной практике для акушерских пациентов [19, 20]. Коморбидность при беременности представляет собой бинарную переменную, определяемую как показатель любого из 12 медицинских состояний до беременности, указанных либо в истории родов, либо в обменной карте. Эти состояния включены в индекс сопутствующей акушерской патологии (индекс материнской коморбидности), предложенный B.T. Bateman et al. [19], в т.ч. хроническое заболевание почек, ранее диагностированная артериальная гипертензия, ишемическая болезнь сердца, врожденные пороки сердца, системная красная волчанка, вирус иммунодефицита человека, серповидноклеточная анемия, порок клапанов сердца, хроническая застойная сердечная недостаточность, легочная гипертензия, астма и ранее существовавший сахарный диабет. Указанные осложнения могут быть опасны для жизни, иметь долгосрочные последствия для здоровья беременной/родильницы и отрицательно сказываться на здоровье и благополучии новорожденного. Оценка риска – ключевой компонент дородовой помощи, она обладает преимуществом в улучшении материнских и перинатальных исходов [21].
В последней редакции (2019) индекс включает уже 24 переменные, при этом каждой может быть присвоено от 0 до 5 баллов [22]. Сильной стороной индекса акушерской коморбидности является его способность объединять несколько сложных сопутствующих заболеваний и оценивать совокупный риск, связанный с состояниями пациентов [23]. После окончательной адаптации и валидации регулярное клиническое использование индекса сопутствующей акушерской патологии перспективно с целью выявления женщин группы риска, которым необходимы усиленное наблюдение и целенаправленная помощь для предотвращения неблагоприятных исходов.
Хотя достоверность индекса материнской коморбидности исследована рядом авторов [3, 18], о последующем изучении его надежности еще не сообщалось.
Анализ статистических данных выполнен с применением пакета прикладных программ Microsoft Excel, 2013, и Statistica 10.0 (StatSoft, Inc., США). Статистическую значимость различий данных между группами определяли с помощью критерия согласия Пирсона, различия считали статистически значимыми при 0,01<α<0,05. За критерий достоверности принимали результат сравнения полученной величины и табличного значения при данном числе наблюдений (или степеней свободы) и при заданном уровне безошибочного прогноза.
Результаты
Основные характеристики родильниц, включенных в оценку коморбидности, приведены в таблице.
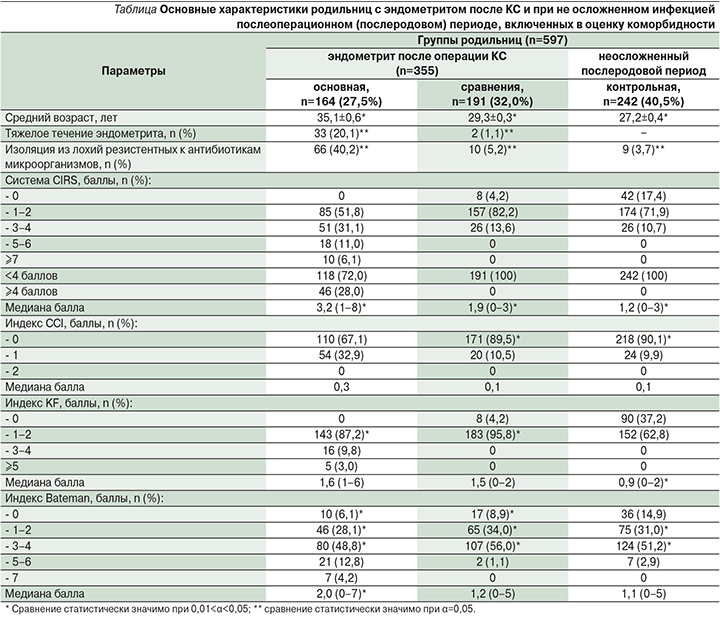
Средний возраст родильниц в основной и контрольной группах составил 35,1±0,6; 29,3±0,3 и 27,2±0,4 года соответственно. В основной группе достоверно преобладали родильницы старшего репродуктивного возраста (71,1%).
Родильницы с коморбидной патологией (основная группа) составили 46,2% всех больных эндометритом после КС, что можно объяснить поздним репродуктивным возрастом пациенток.
У родильниц основной группы достоверно чаще эндометрит после КС протекал в тяжелой форме, чем в группе сравнения (20,1 и 1,1% соответственно; р<0,05). Неблагоприятное течение послеоперационных инфекционно-воспалительных осложнений и склонность к генерализации септического процесса в первую очередь обусловлены антибиотикорезистентностью возбудителей. При наличии полиморбидности достоверно чаще из метроаспирата изолированы резистентные и полирезистентные возбудители (40,2 и 5,2% соответственно; р<0,05).
На следующем этапе для выбора оптимального инструмента контроля, прогноза и оценки коморбидности у пациентов с эндометритом после КС проведено сравнение эффективности основных индексов коморбидности с целью дальнейшей стратификации больных на терапевтические группы с разной степенью риска неблагоприятного прогноза заболевания. По балльной оценке и медиане значения индексов наибольшей информативностью обладает кумулятивная шкала рейтинга заболеваний. Система CIRS позволяет прогностически наиболее достоверно (р<0,05) разделить все исследуемые группы и хорошо коррелирует с тяжестью эндометрита и риском изоляции резистентных и полирезистентных его возбудителей (см. таблицу). Другие шкалы показали невысокую эффективность в оценке прогноза заболевания в исследуемых группах, но продемонстрировали неблагоприятное влияние коморбидности на послеоперационную заболеваемость в акушерстве.
При анализе случаев неблагоприятного течения эндометрита и риска изоляции резистентных и полирезистентных возбудителей выявлены статистически значимые различия в зависимости от кумулятивной шкалы рейтинга заболеваний при дискриминирующем значении кумулятивного индекса (4 балла), вычисленном для разделения родильниц основной группы с первичными ЭГЗ на подгруппы благоприятного и негативного прогноза.
Медиана значения индекса CIRS в основной группе составила 3,2 (диапазон от 1 до 8). Родильницы с эндометритом после КС со значением кумулятивного индекса ≥4 баллов составили группу высокого риска неблагоприятного прогноза (46/28,0% родильниц), а при <4 баллов– группу низкого прогностического риска (118/72,0% родильниц).
Так, в подгруппе полиморбидных пациентов с благоприятным прогнозом достоверно реже отмечено тяжелое течение эндометрита по сравнению с подгруппой негативного прогноза (5,1 и 58,7% соответственно; р<0,05) и реже изолированы микробные возбудители со сниженной чувствительностью к антибиотикам (18,6 и 95,7% соответственно; р<0,05).
Обсуждение
Коморбидность первичных ЭГЗ и послеродового эндометрита признают многие исследователи [24, 25], однако по данному вопросу опубликовано ограниченное число эпидемиологических исследований. M. Knight et al. привели доказательства, согласно которым хронические ЭГЗ являются предиктором худшего прогноза при послеродовых инфекционных осложнениях [4]. Выявлена также прямая корреляционная связь между степенью тяжести ЭГЗ и носительством полирезистентной микрофлоры [26].
Возникает вопрос о влиянии соматической патологии на возникновение послеродовой инфекции. На сегодняшний день однозначно можно утверждать только следующее: какими бы ни были найденные в дальнейших исследованиях общие патогенетические механизмы, существует отчетливая связь с неблагоприятным фоном – хроническим системным воспалением [27], что ухудшает течение послеродового периода и способствует развитию осложнений.
Выявленные особенности позволяют рассматривать первичные ЭГЗ в качестве фактора риска развития пуэрперальной инфекции и первичного звена в цепи последовательных событий в концепции послеродового континуума. Прерывая на различных этапах цепь последовательных событий патогенеза с помощью адекватных лечебно-профилактических мероприятий, можно предотвратить развитие послеродовых инфекционно-воспалительных осложнений.
Наличие у родильниц основной группы отягощенного соматического анамнеза – заболеваний сердца и сосудов, гипертонической болезни, вторичной артериальной гипертензии, сахарного диабета, хронических инфекций, ревматических заболеваний с постоянным приемом системных глюкокортикоидов и других патологий – сопряжено с частыми госпитализациями в многопрофильные стационары и родильные дома. Лечебно-диагностические манипуляции, нарушающие физиологические барьеры, и использование антимикробных препаратов снижают колонизационную резистентность слизистых оболочек, способствуют развитию инфекций, связанных с оказанием медицинской помощи (ИСОМП). По мнению проф. А.Л. Верткина и соавт., указанная патогенетическая связь с развитием инфекции представляет ятрогенный вид коморбидности [12].
Вынужденное ингибирование микробной популяции антибиотиками в условиях стационара и селективное удаление групп бактерий, ответственных за формирование барьера против колонизации и/или персистенции транзиторной микрофлоры, способствуют снижению колонизационной резистентности, заселению освобожденных ниш полирезистентными госпитальными штаммами.
ЭГЗ – один из ключевых модифицируемых факторов риска развития госпитальных инфекций в акушерстве и в то же время отдельные нозологии. Информация о наличии у беременной первичных ЭГЗ важна с позиции оптимизации управления риском неблагоприятных клинических исходов родов (внутриутробное инфицирование, послеродовые инфекционные осложнения, сепсис), адекватного выбора стратегии лечения или антибиотикотерапии, профилактики возможных послеоперационных осложнений. ЭГЗ напрямую или косвенно снижают эффективность работы родильного дома за счет увеличения объема затрат, числа послеродовых осложнений и неблагоприятно влияют на исходы для матери и плода.
В структуре вторичных ЭГЗ группы сравнения основное место занимали анемия, патология гепатобилиарного и желудочно-кишечного тактов, эндокринной и мочевыделительных систем.
В акушерской практике среди всех ЭГЗ к предикторам развития послеродовой инфекции традиционно относят урогенитальные (восходящие) инфекции, что отчасти объясняет повышенную частоту развития послеродовых инфекционных осложнений у беременных с инфекцией мочевыделительной системы, но не полирезистентный характер этиологического агента. Однако в первую очередь именно сниженная чувствительность к антибактериальным препаратам ведущих возбудителей наиболее неблагоприятно влияет на прогноз и исход инфекционных послеродовых осложнений. Другой соматической патологии, анатомически не связанной с органами малого таза, уделено значительно меньше внимания. При этом вариант неуточненной коморбидности и на первый взгляд «случайность» новых комбинаций ЭГЗ и послеродовой инфекции в скором времени могут быть объяснены с научных и клинических позиций.
В основе коморбидного течения ЭГЗ у беременных и послеродовой инфекции лежат сложные ассоциации (синдром «взаимного отягощения», транслокация аутофлоры, клинико-ситуационный сценарий ИСОМП, overlap-синдром и др.), что затрудняет ведение данной категории акушерских пациентов начиная с момента эмпирического назначения антибиотика с превентивной или лечебной целью. Поскольку ЭГЗ влияют на уровень резистентности госпитальной микрофлоры, необходимо дальнейшее изучение данного вопроса, что позволит повысить эффективность антимикробной терапии и профилактики послеродовых инфекционно-воспалительных осложнений.
Выводы
У родильниц с эндометритом после КС в реальной клинической практике наблюдался высокий уровень коморбидной патологии (46,2%).
Влияние, которое оказывают первичные ЭГЗ терапевтического профиля на развитие тяжелых инфекционных осложнений в послеоперационном периоде (в отличие от вторичных), статистически значимо.
Среди изучаемых индексов коморбидности система CIRS наиболее хорошо коррелирует с тяжестью течения эндометрита после КС и частотой изоляции полирезистентных возбудителей, что обусловливает неблагоприятный прогноз заболевания и высокий риск неудач при назначении стандартной схемы эмпирической антимикробной терапии.
Система CIRS показала достоверно лучшее распределение пациентов на прогностические группы по риску носительства полирезистентной микрофлоры, являясь одновременно и надежным инструментом контроля и оценки сопутствующей патологии для стратификации родильниц с эндометритом на стандартные или интенсивные (содержащие антибиотики резерва) схемы антимикробного лечения с целью персонификации терапии.
Индекс материнской коморбидности Bateman, примененный в нашем исследовании для анализа сопутствующей патологии при эндометрите после КС, оказался недостаточно эффективным предиктором неблагоприятного прогноза заболевания и не может быть использован для стратификации родильниц на терапевтические группы.



