Введение
Своевременная диагностика и рациональное лечение эндометрита после абдоминального родоразрешения предупреждают развитие более тяжелых послеоперационных осложнений и зависят от правильного представления о возбудителях этого заболевания. Однако этиологическая структура эндометрита после кесарева сечения (ЭПКС) в различных акушерских стационарах сильно варьируется в зависимости от локальной эпидемиологической ситуации, имеющихся формуляров периоперационной антибиотикопрофилактики и от послеродовой терапии [1]. Таким образом, существуют объективные трудности в разработке общепринятых подходов к назначению эмпирической этиотропной терапии послеоперационного эндометрита. Также этому способствуют постоянные изменения в устойчивости возбудителей к антибиотикам и фармакоэкономическая политика родильных домов [2]. При проведении рациональной антимикробной химиотерапии важное значение имеет правильный выбор препарата, основанный на определении чувствительности возбудителя инфекции к ряду антибиотиков. Все вышесказанное делает изучение этиологии послеоперационного эндометрита и антибиотикорезистентности основных патогенов весьма актуальным.
Целью настоящего исследования стало изучение этиологической структуры ЭПКС и выявление наиболее эффективных антибактериальных препаратов на основании исследований in vitro.
Методы
Под нашим наблюдением находились 70 родильниц после абдоминального родоразрешения, послеоперационный период которых осложнился эндометритом. В качестве периоперационной антибиотикопрофилактики за 30 минут до разреза кожи внутривенно введен цефазолин 2 г. Эндометрит протекал в легкой или среднетяжелой форме и не требовал перевода в обсервационное отделение многопрофильного стационара. В отношении всех больных было проведено микробиологической исследование метроаспирата. Лохии забирались специальным инструментом, исключающим контаминацию флорой из шейки матки и влагалища. Более подробно используемая методика описана в наших более ранних исследованиях [1].
Идентификация выделенных аэробов проведена по общепринятым методикам на основании морфологических, тинкториальных и биохимических свойств. Чувствительность микроорганизмов исследовали к 15 антимикробным химиопрепаратам, наиболее часто используемым в акушерских стационарах.
Результаты исследования
Этиология послеоперационного эндометрита
В результате проведенных микробиологических исследований у 70% родильниц с послеоперационным эндометритом пришли положительные посевы. В основном изолировались условно-патогенные микроорганизмы, населявшие желудочно-кишечный тракт (рис. 1). Их доля составила 44%. В 15% случаев причиной метроэндометритов стали золотистый стафилококк и стрептококки.
В результате анализа микробного спектра установлено, что в этиологической структуре ЭПКС доминирующими микроорганизмами являлись энтеробактерии. Среди них в подавляющем большинстве встречались Escherichia coli (23%), что дает основание считать этот микроорганизм одним из ведущих этиологических агентов при послеоперационном эндометрите. Второе место по частоте занимают энтерококки (21%), третье – стрептококки (10%). Staphylococcus aureus составляют 5% от идентифицированных возбудителей. Другие представители условно-патогенной микрофлоры (представители семейства энтеробактерий, стрептококк группы В и Staphylococcus haemolyticus) изолировались в единичных количествах.
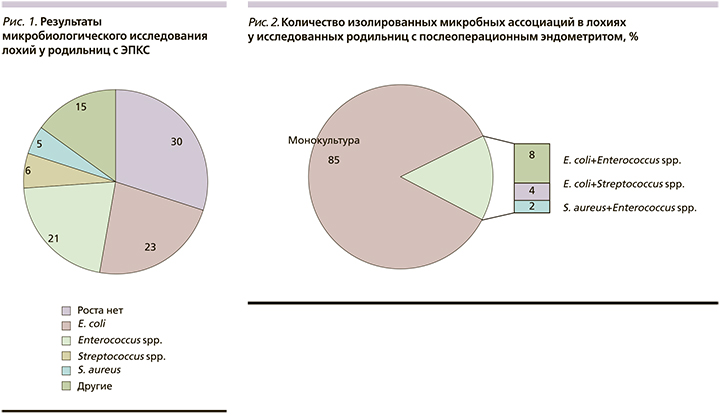
У 30% обследованных родильниц роста флоры доступными средствами обнаружено не было.
Ассоциации ≥2 микроорганизмов, выделенных из полости матки, встретились в 15% всех положительных посевов (рис. 2). Преобладали ассоциации микроорганизмов, в которых были представлены как грамотрицательные, так и грамположительные возбудители, относящиеся к различным таксономическим группам.
Наиболее частое выделение E. coli совместно с Enterococcus spp. из очага инфекции при эндометрите позволяет сделать предположение о синергизме этих микроорганизмов в развитии патологического процесса при этом заболевании.
Антибиотикочувствительность утеротропных патогенов
Важным этапом культуральной диагностики эндометритов является определение чувствительности выделенных возбудителей к антимикробным препаратам. Однако с учетом средней продолжительности получения результатов при послеродовой инфекции для назначения эмпирической антибактериальной терапии в ранние сроки существенно использование данных локального мониторинга антибиотикорезистентности ведущих возбудителей.
Результаты изучения чувствительности к антибиотикам, наиболее часто встречающихся при послеоперационном эндометрите в данном акушерском стационаре, представлены на рис. 3–5.
К наиболее активным препаратам в отношении E. coli относятся β-лактамные антибиотики: меропенем (группа карбапенемов), пиперациллин (группа уреидопенициллинов) и ингибиторозащищенные аминопенициллины (амоксициллин+клавулановая кислота). Также отмечено полное отсутствие резистентности всех выделенных штаммов кишечной палочки к фосфомицину. Минимальное количество резистентных и промежуточно резистентных штаммов выявлено к норфлоксацину и азитромицину. Наименьшую чувствительность выделенные штаммы E. coli обнаружили к ампициллину, гентамицину и цефозалину.
В целом выделенные штаммы Enterococcus spp. были менее чувствительными к изучаемым антибиотикам, чем E. coli. Сохраняется высокая чувствительность ко всем β-лактамным антибиотикам, включая ампициллин. Обращает внимание минимальная резистентность энтерококка к гентамицину (антибиотику второго ряда при лечении послеродовой инфекции), назначаемому дополнительно к цефалоспоринам. Чувствительность к цефалоспориновым антибиотикам не исследовалась, т.к. к ним энтерококк природно резистентен. Наибольшую нечувствительность энтерококки показали к фторхинолонам (норфлоксацин и ципрофлоксацин) и азитромицину.
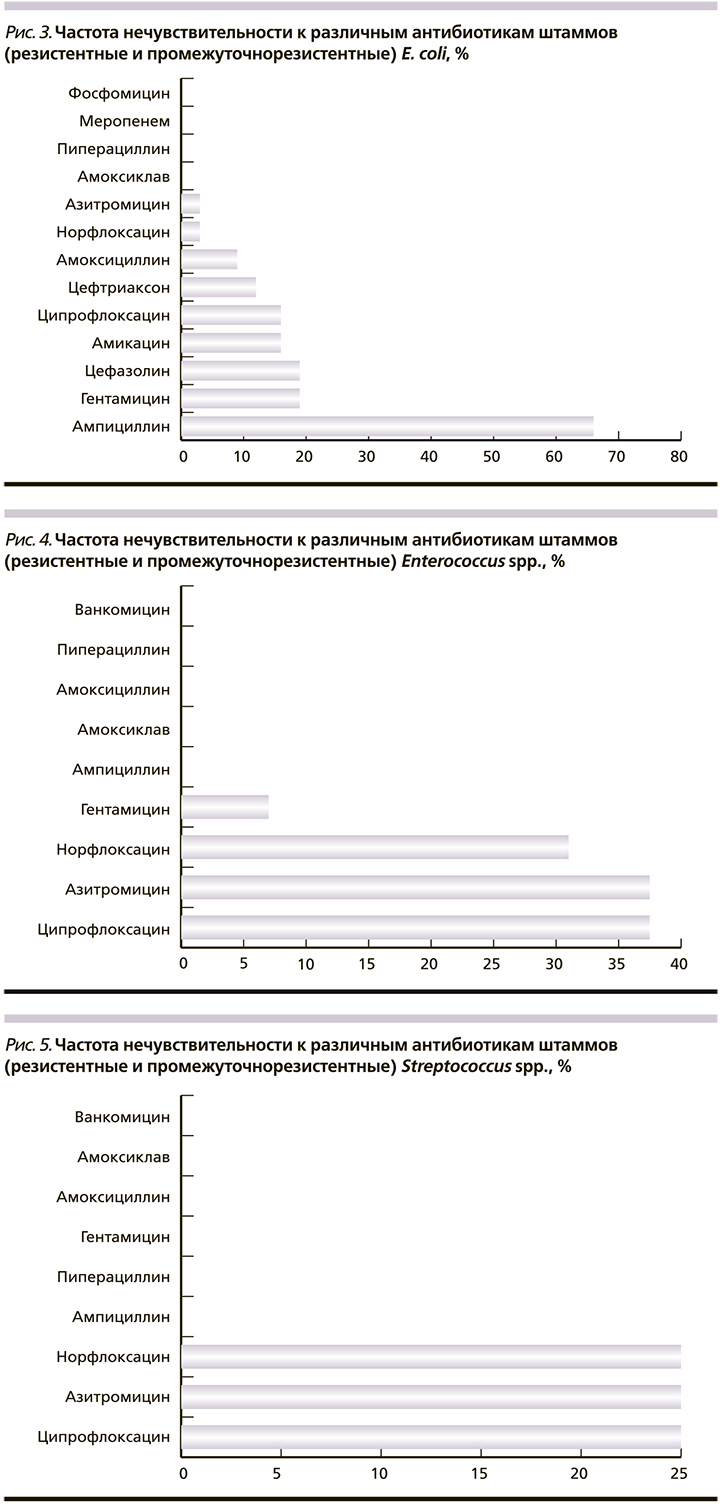
Streptococcus spp. показали наилучшие результаты по чувствительности к исследуемым антибиотикам. Подавляющее большинство изолированных штаммов были высокочувствительными ко всем β-лактамным антибиотикам, а также к гентамицину. Наименее активными антибиотиками были азитромицин и фторхинолоны.
Золотистый стафилококк в небольшом количестве высеивался из метроаспирата родильниц с эндометритом. Уровень резистентности оказался невысоким. Из антибактериальных препаратов в отношении данного возбудителя активны антистафилококковые пенициллины, цефалоспорины всех поколений, линкомицин. Низкая чувствительность S. aureus обнаружена к эритромицину, ампициллину, ципрофлоксацину, гентамицину и клиндамицину.
Наиболее проблемными микроорганизмами с точки зрения этиотропной терапии оказались E. coli (самый широкий спектр устойчивости к антибиотикам) и Enterococcus spp. (природно не чувствительные к цефалоспоринам).
Обсуждение
Результаты исследования микрофлоры полости матки наглядно демонстрируют, что ЭПКС остается полимикробным заболеванием, а ведущее место в его этиологии принадлежит кишечной палочке, энтерококкам и облигатным условно-патогенным микроорганизмам кожных покровов (стрепто- и стафилококкам), которые нередко встречаются в ассоциациях. Присутствие их в ассоциациях усложняет проведение этиотропной терапии, учитывая характерную для них резистентность к антибактериальным препаратам.
Даже при использовании современных методов этиологической диагностики возбудитель послеоперационного эндометрита был определен только в 70% случаев. Отчасти это можно объяснить погрешностями забора лохий, транспортировкой исследуемого материала или повышением роли более требовательных к культивированию патогенов (в т.ч. анаэробов).
Обращает внимание тот факт, что при бактериологическом исследовании метроаспирата ни разу не был изолирован Staphylococcus epidermidis. Данное обстоятельство дает основание говорить о качественном заборе лохий непосредственно из полости матки без контаминации исследуемого материала микрофлорой влагалища и вульвы.
Микроорганизмы, выделенные у родильниц с ЭПКС, характеризуются широкой вариабельностью чувствительности к антибиотикам. В целом выделенная флора обладала низкой резистентностью к наиболее часто используемым в родильных домах антибиотикам. Только незначительное количество штаммов имело множественную лекарственную устойчивость. Не было изолировано ни одного штамма метициллинрезистентного S. aureus и ванкомицинрезистентного энтерококка. Подавляющее большинство микроорганизмов были т.н. дикого типа. Таким образом, уровень нозокомиальной флоры в родильном доме, где проводилось настоящее исследование, был крайне низок.
Основными возбудителями послеоперационного эндометрита оказались E. coli и Enterococcus spp. В совокупности данные патогены обусловили каждый второй ЭПКС. Стрептококки и S. aureus служат патогеном среднего уровня приоритетности. В проведенном исследовании не использовалось анаэробное культивирование и таким образом не была учтена роль облигатно анаэробной неклостридиальной флоры. Также необходимо подчеркнуть, что исследованы родильницы с послеоперационным внутрибольничным эндометритом легкой, среднетяжелой степени и абортивным течением. Пациентки с эндометритами тяжелого течения были переведены в обсервационное отделение многопрофильной больницы.
Наиболее этиологически значимые микроорганизмы обладали высокой чувствительностью к следующим антибиотикам: меропенем (группа карбапенемов), пиперациллин (ингибиторонезащищенный уреидопенициллин), амоксиклав (амоксициллин+клавулановая кислота) и фосфомицин.
Карбапенемы (имипенем и меропинем) и пиперациллин (защищенный тазобактамом) служат препаратами сверхширокого спектра действия. Относительно высокая стоимость делают нецелесообразным их применение в качестве препаратов выбора при эмпирической терапии эндометрита. Исключение составляют случаи тяжело протекающего заболевания, предположительно вызванного полирезистентными возбудителями (в т.ч. резистентными к цефалоспоринам III поколения).
Обращает внимание, что незащищенный амоксициллин не имеет преимуществ перед комбинированным амоксиклавом, но очень выгоден фармакоэкономически. В то же время у ампициллина уровень резистентности самый высокий из всех β-лактамных антибиотиков. Очевидно, что ценность ампициллина как антибиотика для лечения инфекций, вызванной грамотрицательными патогенами, крайне низка.
Цефалоспорины в целом выказывают невысокую эффективность. Уровень резистентности к ним наиболее значимых патогенов колеблется от 0 до 35% (в зависимости от поколения антибиотика). К цефазолину чувствительны около 70% клинических изолятов (без учета энтерококков). Иногда выделялись штаммы кишечной палочки, резистентные к цефалоспоринам III поколения, но чувствительные к амоксициллину, пиперациллину и карбапенемам. Данное обстоятельство необходимо учитывать при создании формуляра эмпирической антибактериальной терапии послеродовой инфекции в данном акушерском стационаре.
Аминогликозидный антибиотик гентамицин имеет несколько лучшие показатели. Частота нечувствительности выделенных штаммов была в пределах 0–20%. С учетом невысоких показателей чувствительности гентамицин применяют только при высокой вероятности энтерококковой и синегнойной инфекции и только в комбинации с другими антибактериальными препаратами. Ни в одном из руководств по эмпирической терапии послеродовой инфекции нет указаний на монотерапию гентамицином, одним из излюбленных в отечественной практике препаратов.
Возможность использования линкосамидов (клиндамицин и линкомицин) ограничена случаями послеоперационного эндометрита, когда применение пенициллинов и цефалоспоринов противопоказано (например, при аллергии), а также в случаях подозрения на анаэробную инфекцию.
Неудовлетворительные результаты показали фторхинолоны (ципрофлоксацин и норфлоксацин) и макролиды (эритромицин и азитромицин).
Выводы
- Бета-лактамные антибиотики остаются наиболее эффективными препаратами при лечении ЭПКС.
- Наблюдается уменьшение чувствительности этиологически значимых патогенов к цефазолину (антибиотику первого ряда при эмпирическом назначении с целью периоперационной антибиотикопрофилактики в оперативном акушерстве). Именно этим фактом можно объяснить основное количество клинических неудач при использовании стандартной схемы антибиотикопрофилактики при абдоминальном родоразрешении.
- С учетом снижения резистентности к цефалоспоринам и высокого уровня встречаемости энтерококков при этиотропной терапии послеоперационного эндометрита наиболее оправданно использовать первым этапом не монотерапию, а комбинацию цефтриаксона с гентамицином или замену данной комбинации на ингибиторозащищенные пенициллины.
- Комбинация амоксициллин+ гентамицин более выгодна, чем цефтриаксон+гентамицин. Амоксициллин (даже без комбинации с ингибитором) активней, чем цефалоспорины III поколения.
- Антибиотиками резерва остаются карбапенемы и пиперациллин (ингибиторозащищенный). Данные препараты необходимо резервировать в послеродовом отделении для лечения эндометритов, резистентных к стартовой эмпирической терапии.
- Несмотря на длительное использование в акушерстве, сохраняется достаточно высокая чувствительность значимых патогенов к цефазолину (основному антибиотику, используемому для периоперационной антибиотикопрофилактики при абдоминальном родоразрешении), что дает основания к продолжению его широкого применения с целью профилактики раневой инфекции в акушерстве.
- Нецелесообразно продолжать в послеродовом периоде профилактическую терапию эритромицином (назначенную в дородовом или родильном отделении при преждевременном излитии околоплодных вод), т.к. патогенная утеротропная флора имеет один из наиболее высоких уровней резистентности к макролидам.
- Фторхинолоны не рекомендуются для стартовой эмпирической терапии послеоперационного эндометрита. Однако в последнее время большие надежды возлагают на новые поколения данной группы антибиотиков, но их место в терапии послеродовой инфекции у лактирующих женщин еще не определено.
- Проведенное исследование еще раз подчеркивает необходимость обязательного мониторинга чувствительности к антибиотикам микрофлоры, выделенной у родильниц с послеоперационным эндометритом, при разработке локального формуляра антибактериальной терапии и рациональных схем периоперационной антибиотикопрофилактики.



