Введение
Опухоли придатков кожи – это большая группа новообразований, морфологическим источником которых являются потовые железы или пилосебационный аппарат кожи (клетки волосяного фолликула, сальных и апокриновых желез). Происхождение данных новообразований может быть как спорадическим, так и генетически детерминированным (синдром Бёрта–Хогга–Дубе, синдром Брука–Шпиглера, синдром Каудена и синдром Мьюра–Торре) [1, 2].
Злокачественные опухоли придатков кожи, представляющие для нас наибольший интерес, встречаются крайне редко. Ретроспективное исследование, основанное на результатах базы данных программы наблюдения, эпидемиологии и конечных результатов Национального института рака США, проведенное с 1988 по 2006 г., выявило 4032 случая злокачественных поражений придатков кожи [3]. Средний возраст пациентов с установленным диагнозом составил 70 лет. В 65% случаев опухолевый процесс отмечался в области головы и шеи, 10-летняя выживаемость составила 97% [3].
Стоит отметить, что большинство пациентов с морфологически подтвержденной злокачественной опухолью придатков кожи – носители мутации в генах, предрасполагающих к развитию онкологического процесса (табл. 1) [1].
Визуальная диагностика опухолей придатков кожи сложна, клинические проявления большинства новообразований кожи схожи: часто это полушаровидные папулы размером от нескольких миллиметров до нескольких сантиметров, плотноэластической консистенции, телесного или розоватого цвета, располагающиеся на коже туловища, лица или волосистой части головы. Длительное время развитие опухоли протекает бессимптомно, однако в отличие от доброкачественных новообразований злокачественные склонны к быстрому росту и изъязвлению [4].
На сегодняшний день патогенез злокачественных образований придатков кожи до конца не изучен, что обусловливает сложности в диагностике и лечении данной патологии [1]. Тем не менее возникновение опухолей у пациентов с наследственными синдромами заставило ученых задуматься о наличии мутаций в генах ДНК и РНК, контролирующих процессы пролиферации и дифференцировки клеточного аппарата. Например, мутации в гене CYLD (cylindromatosis gene), хромосомы16q12-q13, ответственной за кодирование фермента убиквитин-гидролазы, участвующего в негативной регулировке клеточной пролиферации посредством механизма ядерного фактора каппа В (NF-кВ), приводит к усилению экспрессии NF-kB и устойчивости к апоптозу. Такая «поломка» активизирует опухолевый процесс. Именно этот механизм наблюдается при синдроме Брука–Шпилера [5].
Мутации в генах EGFR, HRAS, TP53, RB1, ATM, ARID1A, PIK3CA и CDKN2A [6] были выявлены при секвенировании ДНК пациентов с морфологически подтвержденным диагнозом «порокарцинома, злокачественная порома эккринного или апокринного происхождения». А секвенирование РНК тех же пациентов позволило обнаружить слияние гена YAP1 примерно в 65% порокарцином [7].
Наиболее значимыми молекулярно-генетическими маркерами аденокистозного рака, возникающего в слюнных, реже в слезных железах, а также верхних дыхательных путях и в других органах, являются нарушения транслокации хромосомы 6 и хромосомы 9 «MYB-NFIB», а также экспрессия белка S-100 и протоонкогена c-KIT (в 90%) [8].
D. Bell et al. в своем исследовании агрессивной папиллярной аденокарциномы пальцев (АПАП) провели полное геномное секвенирование ДНК девяти пациентов с морфологически подтвержденным диагнозом АПАП. Анализ полученных данных продемонстрировал наличие мутаций в гене BRAF-V600E (BRAF c.1799T>A p.V600E) у одного из девяти исследованных пациентов, что составило 11% [9].
Таким образом, таргетная терапия может стать одним из вариантов лечения пациентов с первичной апокринной карциномой (ПАК) в случае выявления «мишени – мутации онкогена». Вот почему необходимо продолжать многоцентровые исследования с большей выборкой пациентов с целью подтверждения эффективности воздействия лекарственного лечения на сигнальные пути онкогенеза.
ПАК – редко встречающееся злокачественное образование, преимущественно развивающееся из потовых желез, наибольшее скопление которых отмечается в аксиллярной области. Реже ПАК можно наблюдать на лбу, веках, ушных раковинах, туловище, аногенитальной области, запястьях, ступнях, пальцах рук и ног [10]. В 1944 г.
Хорн впервые описал апокринную карциному, однако на сегодняшний день число описанных клинических случаев с трудом достигает сотни, что объясняет сложности в определении основных диагностических критериев и разработке принципов лечения ПАК [11–15].
Заболеванию чаще подвержены пожилые пациенты, средний возраст которых составляет 67 лет, преимущественно мужского пола. Корреляции между расовой принадлежностью и заболеваемостью выявлено не было [11]. Апокринная карцинома потовой железы характеризуется «вялым» течением: медленными темпами роста и прогрессирования, что в свою очередь приводит к обращению пациента на поздних стадиях заболевания. Основной путь метастазирования лимфогенный; гематогенный путь также описан некоторыми авторами [16]. ПАК потовой железы имеет высокую частоту рецидива и метастазирования в региональные лимфатические узлы. Намного реже сообщается об отдаленных метастазах в легкие, печень и кости. Поражение головного мозга в мировой литературе было описано всего лишь дважды [16].
На сегодняшний день методом выбора остается широкое иссечение опухоли кожи (отступ от края резекции должен составлять 1–2 см) с лимфаденэктомией при цитологически верифицированном метастазе в лимфатический узел [1–15, 17]. По данным некоторых исследований, профилактическая лимфаденэктомия не влияет на риск возникновения рецидива и выживаемость [2, 5]. Тем не менее P.N. Bogner et al. продемонстрировали эффективность и целесообразность выполнения биопсии сторожевого лимфатического узла. Так, определение последнего позволяет уточнить критерий N и принять решение о проведении подмышечной лимфаденэктомии, как в случаях и с другими видами рака кожи [18, 19].
Вопрос о применении лекарственного лечения остается спорным [11–15, 17]. В рутинной практике адъювантная химиотерапия (ХТ) не применяется в связи с резистентностью опухоли к ХТ [13, 14]. Однако описаны случаи благоприятных ответов опухоли на различные схемы ХТ у пациентов с метастатической формой ПАК, что, безусловно, требует дальнейшего изучения вопроса о применении ХТ [20–22]. Интересно, что ПАК потовой железы достаточно часто экспрессирует на своей поверхности рецепторы к эстрогену и прогестерону в отличие от большинства первичных апокринных карцином молочной железы, чем обусловлено применение гормональных препаратов, таких как тамоксифен.
В литературе описано два клинических случая применения тамоксифена: первый продемонстрировал полный ответ опухоли на проводимое лечение [23], второй – отсутствие прогрессирования в течение 3 лет. Таким образом, гормональная терапия может применяться в качестве не только лечения метастатической ПАК потовой железы, но и в качестве адъювантной гормональной терапии [24].
Что же касается лучевой терапии, то последняя рекомендована для паллиативного лечения на поздних стадиях заболевания [15]. Чемберлен и соавт. предложили рассмотреть лучевую терапию в качестве метода выбора при наличии следующих критериев [17]:
- Большой размер опухолевого узла (≥5 см).
- Наличие положительного края резекции.
- Умеренная или низкая степень дифференцировки опухоли.
- Наличие лимфоваскулярной инвазии.
Клинический случай
Пациент Г. 1947 г.р. Диагноз: апокринная карцинома придатков кожи правой подмышечной области, III ст., ypT2N1M0, с метастатическим поражением подмышечных лимфоузлов справа, состояние после 6 курсов системного лекарственного лечения (паклитаксел+карбоплатин), состояние после хирургического лечения в объеме широкое иссечение опухоли правой подмышечной области с подмышечно-подлопаточно-подключичиной лимфаденэктомией справа.
В сентябре 2016 г. пациент впервые отметил появление опухоли на коже правой подмышечной области с тенденцией к росту, к врачам не обращался. В период с сентября 2016 по март 2018 г. отмечено ухудшение состояния за счет увеличения размеров опухоли на коже, а также появление плотных, умеренно болезненных л/узлов в правой подмышечной области.
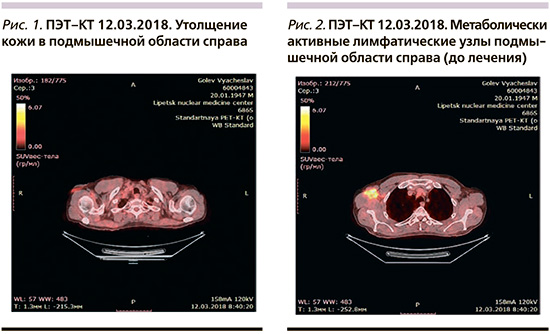
В марте 2018 г. самостоятельно обратился к онкологу с жалобами на появление увеличенных лимфатических узлов в правой подмышечной области, была выполнена позитронно-эмиссионная томография – компьютерная томография (ПЭТ–КТ), по данным которой в аксиллярной области справа определилась группа лимфатических узлов до 24×15 мм (рис. 2) с повышенной метаболической активностью фтордезоксиглюкозы – ФДГ (SUVmax=6,1) специфического характера. Утолщение кожи подмышечной области справа до 30×30×10 мм (SUVmax=1,56; рис. 1).
Выполнена соr-биопсия опухоли кожи, аксиллярных лимфоузлов. По данным гистологического исследования – аденокарцинома. Иммуногистохимическое (ИГХ) исследование не позволило четко определить органоспецифичность метастаза аденокарциномы в лимфатическом узле, однако по экспрессии маркеров нельзя исключить опухоль желудка, панкреато-билиарной системы.
Выполнены эзофагогастродуоденоскопия, колоноскопия – данных за опухолевую патологию получено не было.
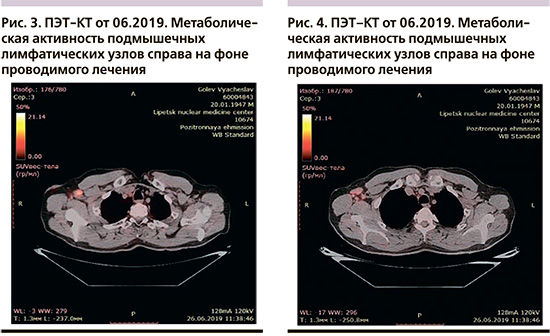
С января по июнь 2019 г. пациенту было проведено 6 курсов ХТ в режиме паклитаксел 175 мг/м2 и карбоплатин АUC6 , курс каждые 3 недели. На фоне лечения было достигнуто клиническое улучшение в виде регрессирования размеров метастатических лимфоузлов, однако по данным ПЭТ–КТ, проведенного в июне 2019 г. (рис. 3, 4), достигнута стабилизация опухолевого процесса и увеличение метаболической активности радиофармпрепарата в опухоли: в аксиллярной области справа сохранялась группа лимфатических узлов размером 24×15 мм без выраженной динамики с повышенной метаболической активностью ФДГ (SUVmax 9,49 была 6,1). Сохранялось утолщение кожи подмышечной области справа до 30×30×10 мм (SUVmax=2,56 была 1,56).
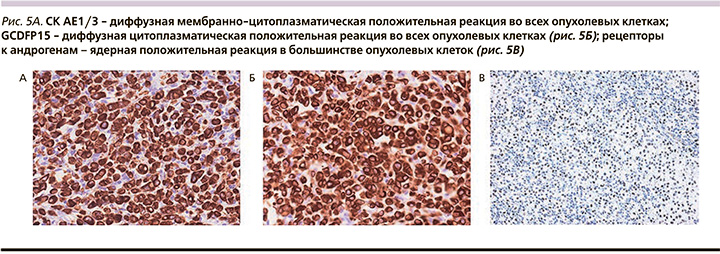
Пациент обратился в федеральную клинику, где при пересмотре готовых гистологических препаратов и выполнения ИГХ-исследования было сделано следующее заключение: апокринная карцинома придатков кожи с наличием рецепторов андрогенов, с метастазом в правом подмышечном лимфатическом узле. Для уточнения варианта карциномы и ее первичной локализации дополнительно проведено ИГХ-исследование на срезах с парафиновых блоков опухоли кожи и метастаза в лимфатическом узле на автоматическом иммуностейнере Ventana BenchMark Ultra c применением систем визуализации антигена: ultraView Universal DAB Detection Kit и OptiView DAB IHC Detection Kit c использованием антител к Pan-СK AE1/3, GCDFP15, AR, HER2/neu, Ki67, HMB-45: выявлена диффузная экспрессия в опухолевых клетках: СK AE1/3 диффузная мембранно-цитоплазматическая положительная реакция во всех опухолевых клетках (рис. 5А, Б, В).
Оценка Her2-статуса по ASCO/CAP (American Society Of Clinical Oncology/College Of American Pathologists): эспрессия белка HER2: «0». Индекс пролиферативной активности в опухолевых клетках Ki-67 – 7%. При сравнении опухолевых клеток новообразования кожи и метастаза в лимфатическом узле выявляется их сходство.
Оперативное вмешательство выполнено 05.08.2018 в объеме широкого иссечения опухоли кожи правой подмышечной области, подмышечно-подключично-подлопаточной лимфаденэктомии справа.
По данным планового морфологического и ИГХ-исследований операционного материала, опухоль кожи была представлена диффузным инфильтратом в дерме из атипичных крупных клеток с хорошо выраженной обильной эозинофильной гранулярной цитоплазмой и с полиморфными светлыми ядрами, видимыми ядрышками (рис. 6A), редкими фигурами митозов (рис. 6Б).
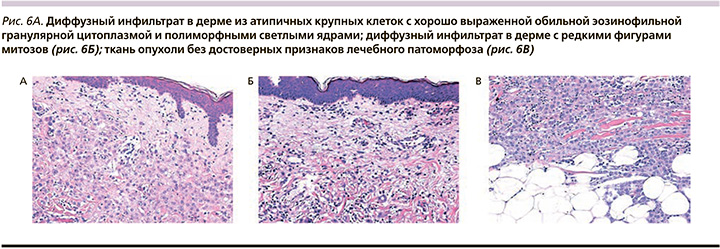
Некрозы не определялись. Отмечались пери- и интраневральный периваскулярный рост, опухолевые комплексы в просвете лимфатических сосудов. Ткань опухоли без достоверных признаков лечебного патоморфоза. Опухоль прорастала все слои дермы и врастала в подлежащую жировую клетчатку (рис. 6В).
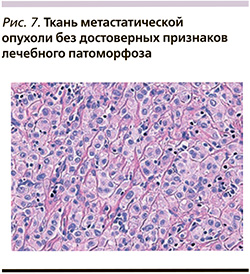 Во всех 50 лимфатических узлах подмышечно-подлопаточно-подключичной клетчатки – метастазы рака, аналогичного вышеописанному строению, с тотальным и субтотальным замещением лимфоидной ткани опухолевой (рис. 7), с прорастанием капсулы лимфоузлов и окружающей жировой клетчатки вплоть до края последней. Ткань метастатической опухоли без достоверных признаков лечебного патоморфоза.
Во всех 50 лимфатических узлах подмышечно-подлопаточно-подключичной клетчатки – метастазы рака, аналогичного вышеописанному строению, с тотальным и субтотальным замещением лимфоидной ткани опухолевой (рис. 7), с прорастанием капсулы лимфоузлов и окружающей жировой клетчатки вплоть до края последней. Ткань метастатической опухоли без достоверных признаков лечебного патоморфоза.
Согласно гистологическому строению опухоли кожи и результатам ИГХ-исследования, новообразование кожи соответствует апокринной карциноме ее придатков без достоверных признаков лечебного патоморфоза, с метастазами во всех 50 лимфатических узлах подмышечно-подлопаточно-подключичной клетчатки без признаков лечебного патоморфоза.
Для определения потенциальной чувствительности опухоли к препаратам группы 5-фторурацила, простым алкилирующим агентам, производным платины, и применения иммунотерапии дополнительно проведено ИГХ-исследование с использованием антител к MLH1, MLH2, PMS2, Р53 с целью уточнения микросателлитной нестабильности (табл. 2), а также определения ER (эстрогеновые рецепторы) и PR (прогестероновые рецепторы).
Антитела, используемые в исследовании, представлены в табл 3.
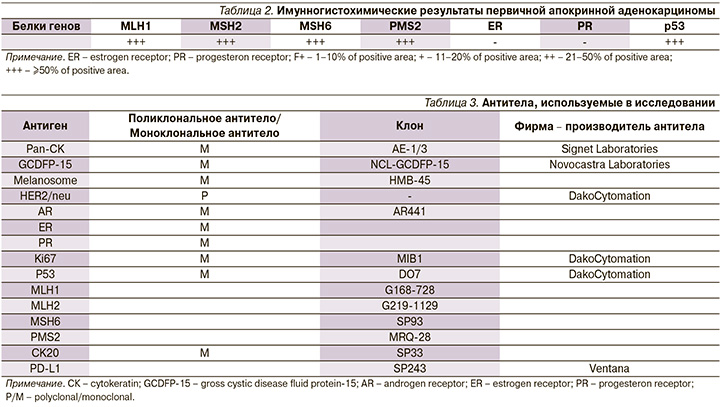
Таким образом, утраты ядерной экспрессии белков репарации (MMR) микросателлитной ДНК (MSS) в опухолевых клетках не обнаружено – иммунофенотип опухоли со стабильной системой репарации микросателлитной ДНК (MSS): низкая вероятность микросателлитной нестабильности.
Реакции на СК20, ER и PR в опухолевых клетках были отрицательными.
Экспрессия PD-L1 не определялась в 100% опухолевых клеток.
Было проведено молекулярно-генетическое исследование биопсии опухоли, тестирование транслокаций c участием генов NTRK 1, 2, 3; тестирование мутаций в гене PIK3CA (экзоны 9, 20). В исследуемом образце данные изменения не найдены.
После получения планового морфологического исследования пациент повторно обсужден на междисциплинарном консилиуме, где с учетом редкой морфологической структуры и отсутствия каких-либо клинических рекомендаций по лечению данного морфологического типа опухоли, приняв во внимание наличие во всех удаленных лимфатических узлах подмышечной области метастазов, а также отсутствие данных за отдаленное метастазирование, с целью достижения максимального локального контроля принято решение о проведении дистанционной лучевой терапии на правую подмышечную область и лекарственной терапии: аналоги лютеинизирующего гормона рилизинг-гормона (золадекс 10,8 мг п/к 1 раз в 3 месяца или диферелин 11,25 мг), а также антиандрогенной терапии флутамидом 250 мг 3 раза в сутки с последующим контрольным обследованием через 3 месяца с момента начала лечения.
В послеоперационном периоде была проведена лучевая терапия на правую аксиллярную область РОД 6,5 Гр, 5 раз в неделю, 5 фракций, СОД – 32,5 ГР (69 иГр). Без осложнений. Начаты инъекции зодакса 10,8 мг п/к 1 раз в 3 месяца и прием флутамида 250 мг 3 раза в сутки.
По данным ПЭТ–КТ в феврале 2020 г. признаки прогрессирования отсутствовали.
Пациенту было рекомендовано продолжение терапии по вышеуказанной схеме.
Обсуждение
Вопрос о применении лекарственного лечения остается спорным. Поскольку не существует стандартных подходов к лекарственной терапии ПАК, лекарственная терапия данного заболевания остается темой исследований. Некоторые авторы высказывают предположение, будто схемы ХТ, эффективные в лечении рака молочной железы, могут оказаться эффективными и в лечении ПАК [3]. Поскольку ПАК гистологически сходен с апокриновым подтипом рака молочной железы, развитие опухоли и эффективность различных химиотерапевтических режимов может походить на таковую для апокринового подтипа рака молочной железы. Действительно, ПАК экспрессирует поверхностный апокриновый маркер GCDFP-15 и HER2 [1–4]. Оказалось, что анти-Her2/neu – агенты, которые активно используются в лечении рака молочной железы с гиперэкспрессией HER2, такие как трастубумаб и лапатиниб, эффективны при лечении метастатической ПАК с гиперэкспрессий Her2 [1, 2]. В литературе описан клинический случай лечения метастатической ПАК с гиперэкспрессией HER2/neu: заболевание резко регрессировало при применении комбинации пертузумаба и трастузумаба с доцетакселом. Лечение было назначено по аналогии с терапией HER2-позитивного рака молочной железы. В результате развития значимого клинического эффекта комбинированной терапии удалось выполнить радикальное хирургическое лечение. После выполнения операции пациенту проводилась лучевая и монотерапия трастузумабом. Авторы публикации предполагают, что комбинация таргетной терапии на основе пертузумаба с ХТ доцетакселом может стать новым вариант лечения пациентов с HER2-положительным метастатическим ПАК [8].
В литературе имеются сообщения, согласно которым при раке кожи апокринового происхождения определяется повышенная экспрессия RANKL [5]. Описан клинический случай эффективности антитела в отношении RANKL деносумаба в адъювантной терапии ПАК [6]. В литературе описан клинический случай успешного применения иммунотерапии пембролизумабом пациентки 85 лет с метастатической апокриновой аденокарциномой кожи [7]. В базе данных клинических исследований ClinicalTrial.gov зарегистрировано одно исследование по лечению апокриновой аденокарциномы. В настоящее время запущено исследование 2-й фазы NCT02834013 по оценке эффективности ниволумаба и ипилимумаба в лечении пациентов с редкими опухолями, в т.ч. с апокриновой аденокарциномой.


