Актуальность
В развитых странах в структуре онкологической заболеваемости женщин рак молочной железы (РМЖ) занимает 1-е или 2-е место (20–25 % всех случаев рака). Более чем у половины больных РМЖ на том или ином этапе заболевания развиваются отдаленные метастазы. Метастатический РМЖ (мРМЖ) – неизлечимое заболевание, однако современные лечебные подходы позволяют достигать клинически значимых результатов. Выявление все новых и новых молекулярно-генетических и иммуногистохимических маркеров и их корреляций позволяет индивидуализировать тактику лечения больных [1]
К наиболее значимым факторам неблагоприятного прогноза при мРМЖ относится избыточная экспрессия HER2 – трансмембранного рецептора с активностью тирозинкиназы, что служит результатом амплификации гена HER2 в 17-й хромосоме [2, 3]. Исследования показали, что HER2-положительный подтип чаще встречается среди молодых женщин с распространенными стадиями болезни, характеризуется высокой агрессией и быстрой диссеминацией опухолевого процесса, не зависит от размеров опухоли. Даже при минимальных размерах карцином и в отсутствие поражения регионарных лимфоузлов гиперэкспрессия HER2 ассоциирована с неблагоприятным течением заболевания [3, 4]. Сегодня определение HER2-статуса при РМЖ обязательно для всех стадий заболевания, необходимо для оценки прогноза и выработки оптимального лечебного алгоритма. Определение HER2-статуса в опухоли стандартизировано и выполняется на парафиновых блоках опухоли с помощью иммуногистохимического анализа и при сомнительном результате анализа (HER2-2+) дополняется определением амплификации гена методом гибридизации in situ (ISH) [5–7].
Анти-HER2-терапия в настоящее время является стандартным подходом к лечению больных раком молочной железы (РМЖ) с гиперэкспрессией HER2 или амплификацией гена HER2 и обычно дополняет химио- или гормонотерапию [8].
Трастузумаб эмтанзин (T-DM1) представляет собой конъюгат антитела и химиопрепарата (ADC), доставляющий последний непосредственно в HER2-положительные раковые клетки, благодаря чему ограничивается повреждение здоровых тканей [8, 9].
Механизм противоопухолевого действия T-DM1 складывается из эффектов трастузумаба и DM1 и является многоступенчатым: на I этапе трастузумаб связываясь с HER2-рецептором, осуществляет весь спектр своего противоопухолевого воздействия, а именно вызывает блокаду сигнальных путей HER2, активирующих рост опухоли, и маркирует опухолевую клетку для иммунной системы. Далее образовавшиеся комплексы поступают внутрь клетки посредством обычного эндоцитоза, где при участии внутриклеточных ферментов происходит разрушение линкера и высвобождение химиопрепарата DM1, который вызывает гибель клетки за счет нарушения полимеризации микротрубочек и остановки клеточного цикла [8, 9].
Применение трастузумаба эмтанзина в монотерапии во второй линии лечения метастатического HER2-позитивного РМЖ позволяет добиваться существенного увеличения общей выживаемости до 2,5 лет и увеличить медиану времени до прогрессирования заболевания на 50% по сравнению со стандартной комбинацией лапатиниба и капецитабина (по данным исследования EMILIA) [10–12]. Представленные данные крупных рандомизированных исследований говорят о том, что современная терапия HER2-положительного РМЖ позволила перевести фатальное течение заболевания в длительно контролируемую форму [11, 12].
Задачей нашего исследования стала оценка эффективности и связанной с ним токсичности препарата трастузумаб эмтанзин (T-DM1) при лечении метастатического РМЖ у пациенток с висцеральным кризом.
Методы
В исследование включены пациентки с HER-2 положительным статусом мРМЖ, у которых имело место прогрессирование после адъювантной химио- или гормонотерапии с трастузумабом либо прогрессирование на 1-й линии химиотерапии (ХТ) и трастузумаба с развитием висцерального криза, ECOG≤2, с адекватной функцией печени, почек, костного мозга. Т-DM1 применялась в качестве 2-й линий лечения мРМЖ. Препарат назначался в дозе 3,6 мг/кг 1 раз 3 недели. Оценку эффекта проводили каждые 2–3 курса, согласно критериям RECIST 1.0, по результатам спиральной компьютерной томографии или магнитно-резонансной томографии.
Оценивали непосредственный противоопухолевый эффект. Токсичность проведенного лечения оценивалась согласно критериям CTCAE 4, анализ общей и безрецидивной выживаемости – по Каплану–Майеру. Статистическая обработка данных проводилась с помощью пакета программ Statistica 10.0.
В исследование были включены 14 пациенток в возрасте 30–49 лет, средний возраст составил 44 года (табл. 1).

По рецептурному статусу женщины распределялись следующим образом: ER+ и/или PR+ – 6 (42,9%), ER- и/или PR – 8 (57,1%).
Все больные мРМЖ исходно имели различные стадии заболевания, представленные в табл. 2.
У 71,42% пациенток исходно имела место III стадия процесса. Независимо от исходной стадии болезни к началу терапии у всех пациенток был метастатический распространенный опухолевый процесс.
У 7 (50%) пациенток отмечено прогрессирование заболевания на фоне адъювантной терапии трастузумабом, у 2 (14,3%) – на фоне гормонотерапии и трастузумаба, у 5(35,7%) – на фоне таксанов и трастузумаба.
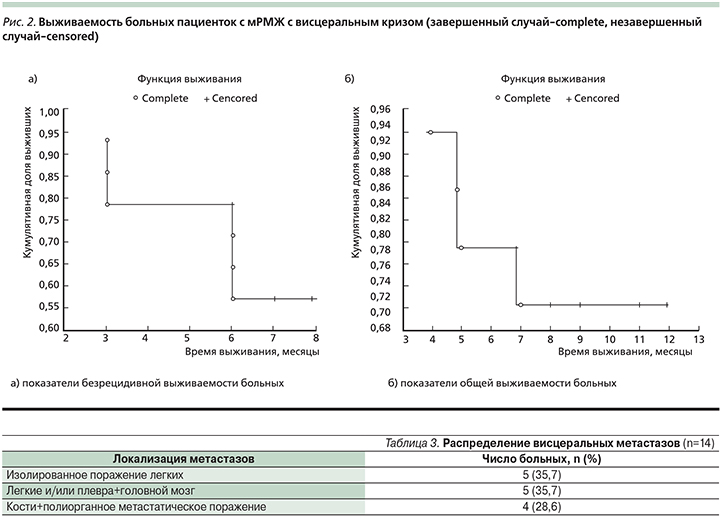
В табл. 3 представлено распределение висцеральных метастазов: в процесс было вовлечено более трех органов и систем 4 (28,6%) пациенток: кости, печень, легкие. Метастатическое поражение одного органа у 5 (35,7%) пациенток было представлено поражением легких, сочетанное поражение легких и головного мозга у 5 (35,7%). Терапию трастузумабом эмтанзином начинали при относительно удовлетворительном состоянии пациентов (ECOG-1–2), удовлетворительных гематологических и биохимических показателях крови.
Проведено от 3 до 8 курсов лечения препаратом Т-DM1, терапию продолжали до достижения максимального эффекта или прогрессирования заболевания, или неприемлемой токсичности.
Таким образом, 3 (21,4%) больным проведено 8 курсов; 5 (35,7%) – 3 курса и в связи с прогрессированием процесса пациентки подверглись другому лечению. Остальные 6 (42,8%) пациенток получили по 6 курсов противоопухолевой терапии.
Результаты
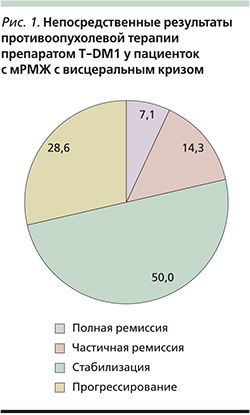
Результаты проведенного лечения представлены на рис. 1.
Общий ответ составил 71,4% (10 пациенток), из них у 1 (7,1%) наблюдалась полная ремиссия (ПР), у 2 (14,3%) – частичная (ЧР), у 7 (50%) пациенток – стабилизация процесса. Прогрессирование процесса отмечено у 4 (28,6%) пациенток.
Медиана безрецидивной выживаемости не достигнута из-за небольшого срока наблюдения. Общая безрецидивная выживаемость составила 58%, медиана общей выживаемости – 9 месяцев. Общая годичная выживаемость составила около 71,4% (рис. 2).
Полученные данные по безрецидивной и общей выживаемости подтверждают мнение многих авторов об эффективности применения препарата трастузумаб эмтанзин в группе больных, ранее получавших лечение таксанами и трастузумабом, а продолжительность изучаемых показателей соответствовала литературным данным [3, 10].
При изучении токсичности проводимой химиотерапии, согласно CTC AE 4.0, нами было проанализировано 76 курсов ХТ. Согласно публикациям, к наиболее частым серьезным побочным эффектам относятся астения, тромбоцитопения, рвота, боли в животе. Из негематологических осложнений в нашей группе больных преобладали гастроинтестинальные (72%). Из них (гастроинтестинальных осложнений) чаще наблюдались тошнота – в 26,3%, боли в животе – 26,3%.
Спектр и выраженность токсических проявлений терапии препарата Т-DM1 представлены в табл. 4.
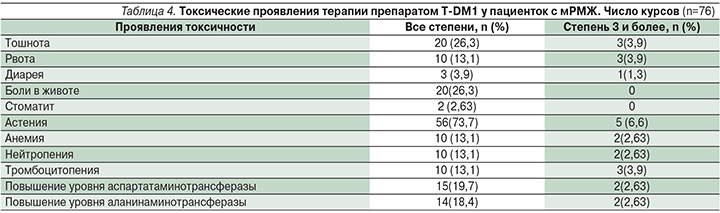
В целом следует отметить удовлетворительную переносимость препарата, несмотря на перечисленные возможные побочные эффекты, следует обратить внимание на астению 1–2-й степеней – 73,7%. Побочные эффекты в основном были слабо выражены, при появлении 3-й степени и более адекватно поддавались лекарственной коррекции.
Имея собственный опыт применения препарата Т-DM1, хотелось бы продемонстрировать наиболее впечатливший нас результат применения препарата первой линии терапии метастатического HER2-положительного РМЖ при прогрессировании во время проведения адъювантной терапии препаратом трастузумаб.
Клинический случай
Пациентка Д. 62 лет находилась на обследовании и лечении в ФГБУ РНИОИ МЗ РФ с 07.12.2016.
Образование в железе обнаружила в ноябре 2016 г., самостоятельно обратилась в РНИОИ. Обследована, выполнена трепанбиопсия опухоли правой молочной железы 07.12.2016. Верификация процесса ГА № 102350-351: карцинома. При иммуногистохимическом исследовании опухоли левой молочной железы выявлено отсутствие экспрессии рецепторов прогестерона и эстрогена (ER-и PR-, Ki-67 80%). Реакция антител с рецепторами HER2/neu 3+. Спиральная рентгеновская компьютерная томография (СРКТ) головного мозга от 07.12.2016: без очагов.
СРКТ органов шеи, грудной клетки (ОГК), брюшной полости (ОБП) и органов малого таза (ОМТ) от 07.12.2016: легкие без очагов, печень без очагов, внутригрудные, забрюшинные лимфоузлы не увеличены, патологических объемных образований в полости малого таза не выявлено.
В костях без деструкции. Остеохондроз L5–S1. В правой молочной железе опухоль 3,4×3 см, аксиллярные л/у справа до 4 см.
В результате проведенного обследования пациентке установлен диагноз «рак правой молочной железы T4N2Mo, St IIIB, нелюминальный HER-2-позитивный, кл. гр. т2».
С 12.12.2016 проведено комплексное лечение: 4 курса препаратами доксорубицин, эндоксан (циклофосфамид), далее 4 курса пертузумаб, трастузумаб, доцетаксел.
На этапах выполнялось контрольное обследование: СРКТ головы, шеи, ОГК, ОБП и малого таза от 09.06.2017: без онкопатологии.
22.06.2017 выполнена радикальная мастэктомия справа. ГА № 55368-78/17 инфильтрирующая карцинома неспецифического типа, склероз, лечебный патоморфоз 2-й степени, № 55368-78/17, в оставшейся молочной железе, клетчатках и лимфоузлах опухолtq нет.
С 13.07 по 09.08.2017 проведен курс лучевой терапии на послеоперационный рубец СОД 50 гр, на подключичную зону справа СОД 44 гр. Затем таргетная адъювантная терапия трастузумабом в течение года.
В январе 2018 г. на фоне таргетной адъювантной терапии трастузумабом появились жалобы на кашель, одышку, головокружение, головные боли.
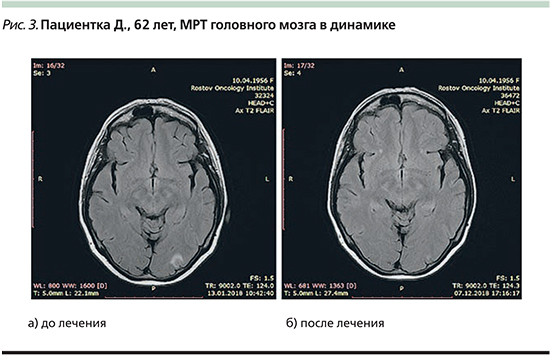
Магнитно-резонансная томография головного мозга с внутривенным контрастированием от 13.01.2018. Заключение: МР-картина солитарного опухолевого поражения левой затылочной доли 7×7 мм интракортикально с наличием перифокального отека до 11×11 мм. Кортикальная атрофия, лейкодистрофия (рис. 3а).
При дообследовании СРКТ органов шеи, грудной клетки, брюшной полости, малого таза от 13.01.2018: с обеих сторон множественные метастатические очаги до 1,3 см, увеличение предаортальных лимфоузлов 1,2 см (рис. 4а).
Принято решение о назначении пациентке препарата трастузумаб эмтанзин в дозе 3,6 мг/кг внутривенно 1 раз в 21-й день. На текущий момент проведено 18 циклов терапии препаратом, достигнут полного ответа.
МРТ головного мозга с внутривенным контрастированием от 07.12.2018. Заключение: МР-картина незначительной диффузной кортикальной атрофии мультифокальных супратенториальных очагов глиоза сосудистого генеза. Метастатическое поражение не определяется (рис. 3б).
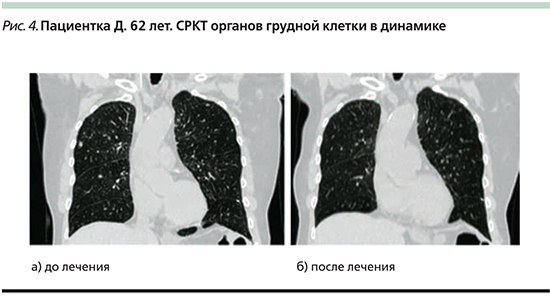
СРКТ органов шеи, грудной клетки, брюшной полости, малого таза от 07.12.2018: данных за метастатическое поражение легочной ткани не выявлено (рис. 4б). Пациентка ведет активный образ жизни, работает. Из побочных эффектов, связанных с терапией, тошнота 1–2-й степеней. Планируется продолжение терапии препаратом трастузумаб эмтанзин.
Заключение
Проведенный нами анализ применения препарата Т-DM1 показал, что препарат обладает достаточно высокой эффективностью для пациенток с HER-2-положительным мРМЖ при достаточно благоприятном профиле токсичности.



