Введение
Рецептор 2-го типа человеческого эпидермального фактора роста (HER2) является трансмембранным белком – членом семейства HER (HER1 – HER4). Гиперэкспрессия и/или амплификация гена HER2 выявляется примерно у 20% больных раком молочной железы (РМЖ) и коррелирует с агрессивным течением заболевания, высоким риском метастазирования, низкой выживаемостью и низкой эффективностью стандартной химиотерапии.
Появление первого таргетного анти-HER2-препарата – Герцептина (трастузумаб), рекомбинантного гуманизированного моноклонального антитела, драматически изменило течение и прогноз HER2-положительного РМЖ. Высокая эффективность режимов с включением Герцептина была продемонстрирована как при диссеминированном процессе, так и при операбельном РМЖ в неоадъювантном и адъювантном лечении. Вслед за Герцептином были разработаны и другие таргетные препараты с иным механизмом действия – лапатиниб и пертузумаб. Необходимо отметить, что их самостоятельное применение демонстрирует скромные результаты и на практике их используют в комбинации с химиотерапией. Инновационным этапом лечения HER2-положительного РМЖ стало создание трастузумаба эмтанзина (Кадсила) – конъюгата таргетного моноклонального антитела трастузумаба и цитотоксического препарата DM1, объединенных с помощью стабильного тиоэфирного связывающего агента, предупреждающего распад конъюгата в кровотоке. При создании первых конъюгатов предпринимались попытки использования уже одобренных для клинического применения препаратов, таких как винбластин и доксорубицин. Однако их активность в конъюгатах оказалась слишком низкой, т.к. таргетных клеток достигало лишь небольшое количество циркулирующих в крови комплексов. Необходимо было использовать значительно более мощный препарат, который был слишком токсичным для применения вне конъюгата с моноклональным антителом.
В настоящее время для создания конъюгатов используют препараты трех групп: ауристатины, калихеамицины и мэйтанзины. DM1 – мейтанзиноид, является цитостатиком, ингибирующим комплекс микротрубочек, вызывая остановку клеточного цикла и гибель клетки. При этом он обладает очень высокой противоопухолевой активностью, в сотни раз превышающей таковую паклитаксела и доксорубицина [1]. При взаимодействии таргетного компонента с рецептором HER2 реализуется противоопухолевая активность трастузумаба, при этом, по данным доклинических исследований in vivo, комплекс трастузумаба эмтанзина и HER2-рецептора посредством эндоцитоза поступает внутрь опухолевой клетки, где расщепляется с высвобождением DM1. При этом происходит адресное воздействие химиопрепарата на опухолевую клетку, что приводит к более избирательному эффекту и ослаблению системных побочных эффектов, связанных с действием химиотерапии на здоровые ткани [2]. Доклинические исследования с использованием радиоактивных меток показали, что комплексы антитела и химиопрепарата быстро накапливаются и долго сохраняются в опухолевой ткани, при этом пик концентрации антител наблюдается через 1 день после введения, а препарата – через 2 дня. Из нормальных тканей и сыворотки крови компоненты элиминировались одинаково быстро, исключение составляла гепатобилиарная система – там максимальная концентрация определялась через 4 часа после введения, а затем быстро снижалась.
В настоящее время клинические испытания проходит ряд конъюгатов различных таргетных препаратов. По четырем из них исследования завершены. К применению кроме трастузумаба эмтанзина рекомендован брентуксимаб ведотин, используемый при рецидивной или рефрактерной CD30-положительной лимфоме Ходжкина или системной крупноклеточной лимфоме. Завершаются исследования III фазы инотузумаба озогамицина, в которых показана эффективность препарата при рецидивирующем и рефрактерном остром лимфобластном CD22-позитивном лейкозе у взрослых. Гемтузумаб озогамицин был одобрен к применению в 2000 г. для лечения острого миелобластного лейкоза, однако в 2010 г. одобрение было отозвано [3].
Что касается трастузумаба эмтанзина, то после ряда успешных исследований у различных категорий больных HER2-положительным РМЖ (табл. 1) были проведены его крупные рандомизированные исследования III фазы: EMILIA и TH3RESA.

Рандомизированное открытое международное многоцентровое исследование III фазы EMILIA
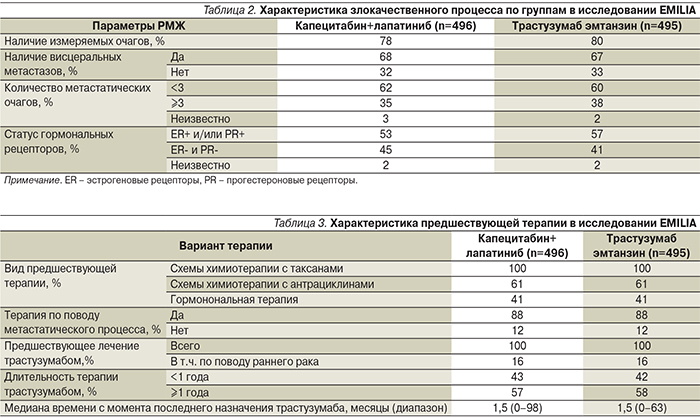
В рандомизированном исследовании III фазы EMILIA сравнивали эффективность и безопасность трастузумаба эмтанзина и комбинации лапатиниба и капецитабина, являвшейся в то время одним из основных стандартов лечения второй линии [2]. В исследование были включены больные распространенным HER2-положительным РМЖ, ранее получившие лечение таксанами и трастузумабом и имевшие прогрессирование болезни. Рандомизация проводилась по двум направлениям: первая группа получала трастузумаб эмтанзин 3,6 мг/кг внутривенно каждые 3 недели (n=495), вторая – лапатиниб 1250 мг внутрь в дни 1–21 и капецитабин 2 г/м2 внутрь в дни 1–14 (n=496).
Обе группы были сопоставимыми по основным прогностическим факторам, включая распространенность опухоли, статус гормональных рецепторов и предшествующее лечение (табл. 2, 3).
Исследование показало, что лечение трастузумабом эмтанзином было, очевидно, более эффективным по сравнению с комбинацией лапатиниб/капецитабин: выживаемость без прогрессирования составила 9,6 против 6,4 месяца (ОР=0,65; 95% ДИ – 0,55–0,77; р<0,001); медиана общей выживаемости – 30,9 против 25,1 месяца (ОР=0,682, 95% ДИ – 0,55–0,85, р=0,0006); частота объективного эффекта – 43,6 против 30,8%; длительность ответа – 12,6 против 6,5 месяцев.
Таким образом, применение трастузумаба эмтанзина позволило увеличить выживаемость без прогрессирования на 50%, снизив риск прогрессирования или смерти на 35%. Медиана общей выживаемости также выросла почти на 6 месяцев, что представляется чрезвычайно важным для этой прогностически неблагоприятной группы больных. Объективный эффект был выше на 13%, причем его длительность увеличилась на 6 месяцев и превысила 1 год.
Еще более значительное увеличение медианы общей выживаемости отмечено у больных, имевших метастазы в головной мозг (в исследование включались пациентки с бессимптомными метастазами после проведенной ранее лучевой терапии): с 12,9 до 26,8 месяца, последнее беспрецедентно в контролируемых клинических исследованиях.
Отмечен также благоприятный профиль безопасности препарата: у получавших трастузумаб эмтанзин реже встречались нежелательные явления 3–4-й степеней (40,8 против 57% при применении лапатиниба и капецитабина), что устранило необходимость значительного снижения дозы: доза трастузумаба эмтанзина была снижена лишь для 16% больных (доза лапатиниба редуцирована для 27%, капецитабина – для 53% больных).
По результатам исследования EMILIA трастузумаб эмтанзин был одобрен FDA для применения при прогрессировании HER2-положительного РМЖ после лечения трастузумабом и таксанами. Препарат вошел в зарубежные (ASCO, ESMO, NCCN), а затем и отечественные рекомендации в качестве препарата выбора второй линии после предшествующей терапии трастузумабом и препаратом из группы таксанов (последовательно или в комбинации) при метастатическом или местно-распространенном неоперабельном HER2-положительном РМЖ. Трастузумаб эмтанзин может быть также с успехом применен при прогрессировании на фоне адъювантной терапии или в течение 6 месяцев после ее окончания; а также в 3-й и последующих линиях, если пациент не получал его ранее.
Открытое рандомизированное исследование III фазы TH3RESA
В 2014 г. были опубликованы первые результаты другого аналогичного по дизайну крупного рандомизированного исследования III фазы – TH3RESA [8]. Исследование включило 600 больных HER2-положительным РМЖ, получивших не менее двух линий предшествующей анти-HER2-терапии, в т.ч. трастузумаб, таксаны и лапатиниб. Рандомизация проведена в соотношении 2:1, терапию трастузумабом эмтанзином в стандартной дозе 3,6 мг/кг каждые 3 недели получили 400 больных, 200 пациенткам проведено лечение по выбору исследователя (табл. 4).
Результаты исследования близки к таковым в протоколе EMILIA, закономерно продемонстрировав очевидное преимущество трастузумаба эмтанзина. Отмечено увеличение выживаемости без прогрессирования почти в 2 раза (с 3,3 до 6,2 месяца, ОР=0,528; 95% ДИ – 0,422, 0,661; р<0,0001), статистически значимое повышение общей выживаемости, медиана которой в исследуемой группе к настоящему времени не достигнута (ОР=0,552; 95% ДИ – 0,369, 0,826; р=0,0034. Объективный ответ составил 31,3% по сравнению 8,6% при терапии по выбору исследователя (95% ДИ – 16,2, 29,2; р<0,0001). При применении трастузумаба эмтанзина благоприятнее был профиль безопасности: реже отмечались нежелательные явления 3–4-й степеней (32 против 43%), в т.ч. требующие редукцию дозы препаратов в связи с токсичностью (9 против 20%) и приводящие к отмене лечения (7 против 11%). Практический интерес представляют результаты подгруппового анализа, где максимальное преимущество в эффективности было продемонстрировано в отношении больных старшей возрастной группы (≥75 лет) и соматически отягощенных (ECOG-2) пациенток.
Результаты исследования клинической безопасности применения трастузумаба эмтанзина
В недавно опубликованном анализе безопасности применения трастузумаба эмтанзина суммированы результаты 6 исследований, в которых 884 больных HER2-положительным РМЖ получали препарат в стандартной дозе 3,6 мг/кг 1 раз в 3 недели [9]. Нежелательные явления стали причиной снижения дозы препарата для 17,2% больных, причиной прекращения лечения – только для 7%. Наиболее частыми нежелательными явлениями, если учитывать все степени выраженности, были слабость, тошнота, тромбоцитопения и запоры. Чаще всего отмечались 3–4-я степени тромбоцитопении (11,9%) и повышение уровня АСТ в сыворотке крови (4,3%). Побочные эффекты 3–4-й степеней выраженности были редкими, как правило, бессимптомными и обратимыми. Тромбоцитопения была кратковременной, надир отмечался на 8-й день цикла с полным восстановлением к 15-му дню, и, как правило, не вызывала значимых кровотечений. Лишь у 2 пациентов отмечена взаимосвязь тромбоцитопении 3–4-й степеней с кровотечением 3–4-й степеней. Механизм тромбоцитопении неясен, предполагается влияние на созревание мегакариоцитов мейтанзиноидного компонента препарата. Вероятно, он же ответствен за гепатотоксичность. Последняя проявлялась в основном бессимптомным повышением уровней АСТ и АЛТ, которое также было транзиторным, и в большинстве случаев к началу очередного цикла наблюдалось восстановление показателей. Значимое (3–4-й степеней) повышение уровней трансаминаз, как правило, сохранялось в течение 1–2 циклов лечения, затем показатели не превышали 1–2-ю степени. В случае необходимости коррекция дозы препарата позволяла продолжить лечение. Из 884 больных у 3 была верифицированная биопсией нодулярная регенеративная гиперплазия, которая может привести к нецирротической портальной гипертензии и служит однозначным показанием к прекращению лечения.
В небольшом исследовании [10] изучена фармакокинетика трастузумаба эмтанзина при нормальной и сниженной функции печени. Не выявлено различий в системной концентрации DM1 при нормальной функции печени и при ее снижении слабой и умеренной степени выраженности. С учетом описанной кардиотоксичности трастузумаба каждые 12 недель на фоне лечения исследовали фракцию выброса левого желудочка. Следует отметить, что лишь у 1,5% больных (13 случаев) было отмечено ее снижение, при этом 11 случаев были 1–2-й степеней [8]. Это очень низкий показатель, особенно с учетом того, что 91% больных ранее уже получали лечение, включавшее трастузумаб.
Недавно опубликованное исследование, в котором 153 больных получали трастузумаб эмтанзин в течение года после антрациклин-содержащей терапии в плане нео/адъювантного лечения [11], продемонстрировало безопасность такой последовательности лечения: клинически значимой кардиотоксичности отмечено не было, и лишь у 2,7% больных наблюдалось бессимптомное снижение фракции выброса левого желудочка.

Перспективы использования трастузумаба эмтанзина
В настоящее время открыт ряд клинических исследований, результаты которых в будущем, возможно, позволят внести коррективы в показания к применению препарата. MARIANNE (регистрационный номер NCT01120184) – крупное рандомизированное исследование, в которое планируется включить 1095 больных HER2-позитивным РМЖ, ранее не получавших лечения по поводу метастатического заболевания (1-я линия лечения). Рандомизация проходит по трем направлениям: первое – стандартная терапия комбинацией трастузумаба с доцетакселом или паклитакселом; второе – трастузумаб эмтанзин в монотерапии; третье – трастузумаб эмтанзин в комбинации с пертузумабом. Результаты этого исследования продемонстрируют, насколько оправданно применение трастузумаба эмтанзина в первой линии терапии с точки зрения эффективности и безопасности лечения; интересна также возможность сравнить эффективность монотерапии трастузумабом эмтанзином и комбинации T-DM1 с пертузумабом.
Пертузумаб и трастузумаб имеют взаимодополняющие механизмы действия, образуя связь с различными доменами HER2. Пертузумаб блокирует лиганд-индуцированные сигнальные пути, активируемые как через HER2, так и через рецепторы HER1, 3, 4.
В исследовании CLEOPATRA [12] было доказано повышение эффективности при использовании комбинации пертузумаба и трастузумаба в сочетании с доцетакселом. In vitro была показана роль неурегулина-1b – лиганда HER3 (NRG-1b) в развитии резистентности к антимитотическим агентам, таким как DM1 (компонент конъюгата трастузумаба эмтанзина). Вероятно, NRG-1b является одним из механизмов резистентности опухоли к трастузумабу эмтанзину, который можно преодолеть при совместном применении препарата с пертузумабом. Исследования I–II фаз уже показали приемлемый профиль безопасности этой комбинации [13,14], которая в настоящее время изучается как в исследовании MARIANNE, так и в ряде других исследований III фазы, в т.ч. по применению трастузумаба эмтанзина в нео/адъювантном лечении.
Из числа наиболее интересных можно отметить KAITLIN (регистрационный номер NCT01966471) и KATHERINE (NCT01772472). В адъювантном исследовании KAITLIN 1850 больных HER2-положительным РМЖ после хирургического лечения и антрациклин-содержащей химиотерапии проходят рандомизацию: первая группа получает стандартное лечение: таксаны (4 курса)+трастузумаб+пертузумаб до года, вторая – трастузумаб эмтанзин в комбинации с пертузумабом в течение года.
В нео/адъювантном исследовании KATHERINE, включившем 1484 операбельных HER2-положительных больных, после стандартного неоадъювантного лечения, включившего трастузумаб, при наличии остаточной инвазивной опухоли после хирургического вмешательства пациенток рандомизируют на стандартное продолжение трастузумаба длительностью до года или назначают трастузумаб эмтанзин. Оригинальный дизайн этого исследования дает возможность сделать попытку индивидуализации лечения в зависимости от степени патологического регресса опухоли.
Заключение
Кадсила – первый уникальный препарат, сочетающий таргетное моноклональное антитело трастузумаб и цитотоксический препарат DM1. Использование стабильного линкера в этом конъюгате обеспечивает таргетную доставку цитостатика непосредственно к опухолевым клеткам. Проведенные исследования III фазы позволяют позиционировать Кадсилу как препарат выбора во второй линии лечения HER2-положительного РМЖ после использования таксанов и трастузумаба. Эффективность его значительно превышает существовавшие до настоящего времени стандарты лечения при благоприятном спектре токсичности. Основными побочными эффектами служат тромбоцитопения и повышение уровня трансаминаз, которые в большинстве случаев бессимптомны, обратимы и позволяют проводить лечение в полном объеме.



