Введение
В повседневной клинической практике терапевту приходится сталкиваться с пациентами, страдающими различными острыми и хроническими заболеваниями легких, среди которых бронхоэктатическая болезнь (БЭБ) занимает особое место. При БЭБ, особенно в дебюте заболевания, симптомы не отличаются специфичностью, многие укладываются в клиническую картину более привычных нозологических форм, таких как хронический бронхит, пневмония, бронхиальная астма, хроническая обструктивная болезнь легких (ХОБЛ) и др. [1]. При обзорной рентгенографии органов грудной полости (ОГП) выявить четкие рентгенологические паттерны не удается [2, 3], а компьютерная томография при этом проводится не всегда. Бронхоскопия и исследования, позволяющие выявлять специфические лабораторные маркеры заболевания, не всегда доступны лечебным учреждениям терапевтического профиля.
В литературе до сих пор ведутся дискуссии о первичности и вторичности развития бронхоэктазов на фоне тех или иных патологических состояний, при этом генетическим дефектам и хроническому воспалению дыхательных путей, чаще связанному с респираторными инфекциями и бронхообструкцией, придают основное значение [2, 4, 5].
Микобактериозы – отдельная группа инфекционных заболеваний, вызываемых нетуберкулезными микобактериями. Начиная с конца XX в. во всем мире растет число случаев этих заболеваний, особенно среди лиц с иммунодефицитными состояниями, ВИЧ-инфекцией, хроническими заболеваниями легких, в числе которых стоит и БЭБ [1, 3, 4]. Официальной статистики по микобактериозу легких (МБЛ) в России нет, отсутствуют нормативные документы по диагностическим и лечебным подходам, социальной поддержке таких пациентов, нет четкого понимания, кто из специалистов ответствен за их лечение и наблюдение [5].
Сочетание БЭБ и МБЛ – вдвойне сложная клиническая ситуация, справиться с которой можно только при условии комплексного подхода с участием смежных специалистов.
Клинический случай
Представляем клиническое наблюдение пациентки Ж. 37 лет с ВЭБ и МБЛ, которое может быть интересным в плане накопления практического опыта ведения таких пациентов.
Из анамнеза. Родилась доношенной, в срок, роды проходили через естественные родовые пути, однако при рождении самостоятельно не дышала. Проводилась искусственная вентиляция легких (ИВЛ). Со слов пациентки, более 10 дней находилась под наблюдением с диагнозом «врожденная пневмония». В детстве частые бронхиты, пневмонии. Состояла на учете у детского пульмонолога, наблюдалась с разными диагнозами: «хронический обструктивный бронхит», «бронхиальная астма», «бронхоэктазия». Со слов больной, терапия постоянно менялась. Назначались ингаляционные глюкокортикостероиды (ГКС) с бронхолитическими препаратами, периодически системные ГКС. Ее часто госпитализировали в детское отделение по поводу обострений заболевания, которое в основном проявлялось усилением отхождения мокроты, появлением одышки, повышением температуры. Медицинская документация этого периода не сохранилась. Отягощена наследственность по бронхиальной астме.
Впервые к врачу, будучи взрослой, обратилась в 21 год (2003). На фоне переохлаждения отметила повышение температуры до 38,3°С, появление боли в грудной клетке при глубоком дыхании. Кашель беспокоит пациентку с детства, но в тот период стала отходить мокрота зеленоватого оттенка. При рентгенографии ОГП были выявлены изменения в нижней доле левого легкого инфильтративного характера. Поставлен диагноз внебольничной пневмонии, назначена антибактериальная терапия (АБТ), на фоне которой сохранялись рентгенологические изменения в нижней доле левого легкого, что объясняли вероятным наличием бронхоэктазов. Детального обследования в то время не проводилось.
В последующем обратилась за медицинской помощью в 24 года (2006) в связи с беременностью. На последнем триместре беременности у пациентки усугубились проблемы с дыханием. Появились выраженная слабость, тахикардия, боли в нижней половине грудной клетки, преимущественно слева, усилился кашель, увеличилось количество отделяемой мокроты. Объема проводимого лечения в тот период не помнит. Роды самостоятельные, через естественные родовые пути. Ребенок родился живым с небольшой массой тела, околоплодные воды темно-зеленого цвета. После родоразрешения обследование пациентки продолжилось. Было высказано предположение о наличии специфического процесса в легких, в связи с чем была направлена в дифференциально-диагностическое отделение областной клинической туберкулезной больницы (ОКТБ) Саратова. Поставлен диагноз «очаговый туберкулез левого легкого». МБТ (-). Проходила тест-лечение, однако курс терапии прервала из-за недостаточной эффективности, со слов пациентки, и плохой переносимости назначенных препаратов.
В декабре 2015 г. в возрасте 33 лет впервые попала в терапевтическое отделение 1-й Городской клинической больницы им. Ю.Я. Гордеева (1ГКБ) Саратова. Предъявляла жалобы на кашель с зеленоватой мокротой, повышение температуры, боль в грудной клетке слева при дыхании и кашле, слабость, потливость, снижение аппетита. Заболела остро после контакта с больной ОРВИ дочерью. 04.12.2015 появился кашель с зеленоватой мокротой, повысилась температура до 38°С. Начала самостоятельно принимать амоксициллин, ацетилцистеин.
К 08.12.2015 состояние несколько улучшилось: кашель беспокоил меньше, но продолжала отходить зеленая мокрота, температура снизилась до 37,5°С, отмечалась только в вечерние часы.
С 09.12.2015 отметила появление боли в грудной клетке слева при дыхании, температура тела – 39°С. Доставлена скорой помощью в отделение терапии. При поступлении выписок из ОКТБ не предоставила, сообщила только, что проходила обследование на туберкулез, и данный диагноз подтвержден не был. Объективно: состояние средней тяжести. Кожные покровы чистые, влажные, без сыпи и видимых отеков. Пальпируются единичные подмышечные лимфоузлы размером с горошину, безболезненные, подвижные. Частота сердечных сокращений (ЧСС) – 100 в 1 минуту, артериальное давление (АД) – 110/70 мм рт.ст., рост – 168 см, масса тела – 52 кг, ИМТ – 19 кг/м2, температура тела – 37,5°С. Форма грудной клетки воронкообразная, деформирована за счет впалой грудины. Обе половины грудной клетки синхронно участвуют в акте дыхания, число дыхательных движений – 18 в 1 минуту. При аускультации: дыхание над большей поверхностью легких жесткое, слева в нижних отделах незначительно ослабленное, там же выслушиваются влажные, мелкопузырчатые, незвучные хрипы. По данным рентгенографии ОГП: слева в S9, S10 определяется затемнение средней интенсивности неоднородной структуры за счет инфильтрации легочной ткани. Справа легочные поля прозрачны, легочный рисунок не изменен. Корни легких существенно не изменены. Синусы плевры свободны. Границы средостения смещены из-за разворота. Диафрагма куполообразная, расположена обычно. Заключение: вероятная левосторонняя нижнедолевая пневмония.
С первых суток пациентка получала внутривенно антибактериальные препараты: цефтриаксон (2 г в сутки) в комбинации с линкомицином (900 мг в сутки), муколитическую терапию. Несмотря на стабилизацию состояния, снижение температуры тела с сохранением субфебрилитета в вечерние часы, улучшение общего самочувствия, уменьшение слабости, кашель с отделением зеленоватой мокроты сохранялся. При рентгеноконтроле на 9-е сутки динамики не выявлено, сохранялась инфильтрация легочной ткани нижней доли левого легкого. В связи с этим проведена смена АБТ на левофлоксацин 750 мг в сутки, прием муколитических препаратов (амброксол через небулайзер) продолжен. На этом фоне уменьшение кашля, прекращение отхождения зеленоватой мокроты, стойкая нормализация температуры тела. На рентгенограмме через 7 дней: сохраняется пятнисто-тяжистое затемнение нижней доли левого легкого. Нижняя доля левого легкого выглядит уменьшенной в объеме. Сердце смещено влево. Справа без инфильтративных и очаговых изменений легочной ткани. Корни тяжистые. Синусы свободны. Заключение: рентгенологическая картина характерна для бронхоэктазов левого легкого. Пациентка была выписана из отделения с улучшением, рекомендовано дальнейшее наблюдение и обследование у пульмонолога.
С апреля 2018 г. отметила значительное ухудшение самочувствия. Кашель усилился, появилась одышка при умеренной физической активности, слабость. Самостоятельно обратилась в ОКТБ, где прошла обследование.
В анализе мокроты методом люминесцентной микроскопии обнаружены кислотоустойчивые микобактерии. При рентгенографии в левом легком определялся инфильтрат неоднородной структуры. Была госпитализирована в отделение Областного клинического противотуберкулезного диспансера (ОКПТД) с диагнозом: «инфильтративный туберкулез левого легкого» в фазе распада МБТ (-), ГДУ IБ МБТ (-), где с 16.04.2018 по 27.07.2018 проводилась химиотерапия по I режиму. На фоне лечения процесс трансформировался в цирротический туберкулез; по результатам консилиума рекомендовано хирургическое лечение. Пациентка была переведена в туберкулезное легочно-хирургическое отделение (ТЛХО) ОКТБ, где 01.08.2018 была выполнена операция: видеоассистированная торакоскопическая комбинированная резекция S4, S5, базальных сегментов левого легкого. В первые сутки послеоперационного периода у пациентки развилось кровотечение, в связи с чем проведены реторакотомия, гемостаз. 07.11.2018 пациентке выполнена задняя внеплевральная 4-реберная торакопластика слева. Послеоперационный процесс осложнился развитием экссудативного плеврита. В ТЛХО находилась до 28.01.2019. Получала лечение по интенсивной фазе I режима. Несмотря на это, отмечена отрицательная рентгенологическая динамика: нарастание инфильтративных изменений в левом легком. Данные спирографии: нарушение функции внешнего дыхания по смешанному типу: тяжелая рестрикция (ЖЕЛ – 45%), нарушение проходимости во всех калибрах бронхов умеренные (ОФВ1 – 47%). Результаты фибробронхоскопии. Трахеобронхиальное дерево осмотрено с обеих сторон до субсегментов. Слева устье бронхов, слизистая доступных бронхов с явлениями катарального воспаления. Секрет густой, мутный в значительном количестве. Пациентка вновь переведена в терапевтическое отделение ОКТБ.
В связи с неэффективностью терапии, прогрессирующим течением заболевания в июне 2019 г. пациентка направлена на обследование и лечение в ФГБНУ «Центральный научно-исследовательский институт туберкулеза» (ЦНИИТ) Москвы. По результатам многократного исследования мокроты и операционного материала (парафиновые блоки) в ЦНИИТ в соответствии с критериями Американского торакального общества [6] подтверждена нетуберкулезная этиология процесса – микобактериоз (выявлены Mycobacterium avium). Диагноз: «микобактериоз оперированного левого легкого. Бронхоэктатическая болезнь в фазе стихающего обострения. Левосторонний экссудативный плеврит в стадии рассасывания». Рекомендованная схема лечения: риф-ампицин+моксифлоксацин+кларитромицин+амикацин, муколитики, пробиотики с рентгеноконтролем через 3 месяца.
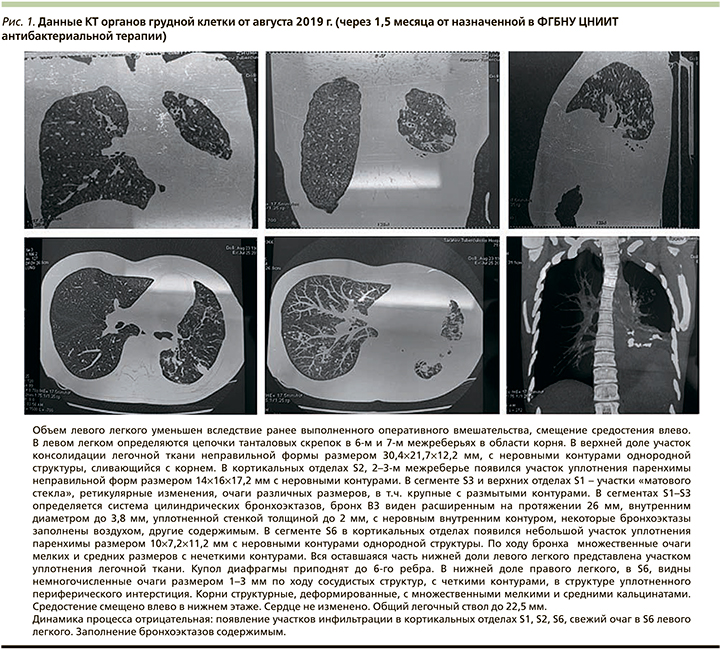
В связи с тем что МБЛ часто развивается у пациентов с ВИЧ-инфекцией [3, 7], пациентка была обследована на ВИЧ, хронические вирусные гепатиты. Результаты серологического исследования отрицательные. Рекомендованное лечение пациентка самостоятельно прервала в связи с развитием аллергических реакций. Данные КТ через 1,5 месяца после назначенного лечения (рис. 1) свидетельствовали об отсутствии положительной динамики.
30.10.2019 у пациентки появилась субфебрильная температура, увеличилось количество мокроты, на фоне кашля развилось кровохарканье, в связи с чем вызвала скорую помощь и была доставлена в терапевтическое отделение 1ГКБ. Со слов больной, до настоящего времени в мокроте очень редко отмечались прожилки крови, в день поступления в стационар в мокроте появились темно-красные сгустки в значительном количестве, данные симптомы отмечала трижды за предшествовавшие госпитализации трое суток; светлая мокрота в объеме до 50 мл отходит ежедневно, раз в 2 недели ее объем достигает 200 мл, при обострении заболевания мокрота приобретает желто-зеленый цвет, иногда с неприятным запахом.
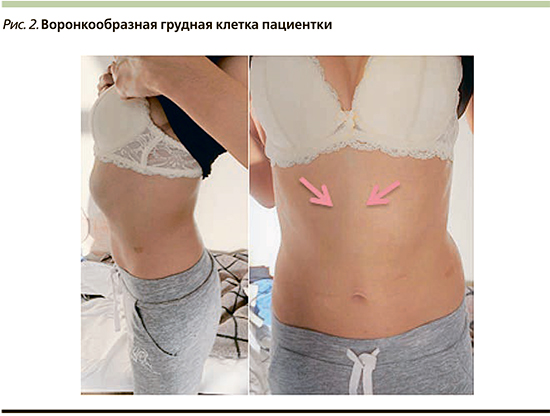
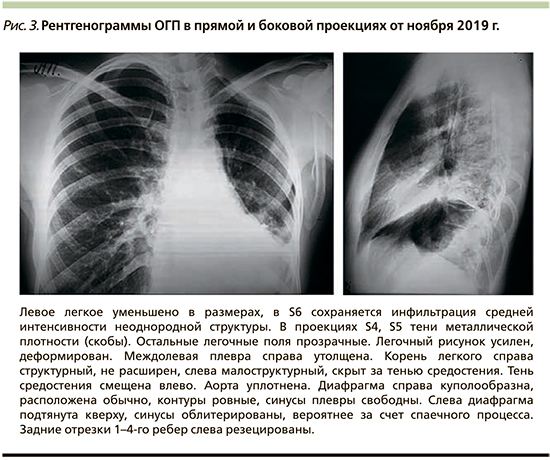
Данные обследования. Состояние пациентки удовлетворительное, занимает активное положение. Температура тела нормальная. Кожные покровы обычной окраски, лимфоузлы не увеличены. Грудная клетка деформирована (грудина вдавлена — воронкообразная грудная клетка; рис. 2), на левой половине грудной клетки имеются послеоперационные рубцы. Акропахии нет. В легких аускультативны сухие свистящие хрипы в проекции верхней доли левого легкого, нижней доли правого легкого на форсированном выдохе; незвучные влажные хрипы в проекции верхней доли левого легкого. Тоны сердца ясные, ритмичные, ЧСС – 82 в 1 минуту, АД –110/75 мм рт.ст. Отеков периферических и полостных не отмечено. На рентгенограммах (рис. 3) свежих инфильтративных изменений не выявлено, т.е. исключена внебольничная пневмония. Показатели общих анализов крови, мочи, биохимического анализа крови, С-реактивного белка в пределах нормальных значений. Признаков дыхательной недостаточности в покое нет, сатурация кислорода в покое – 95%, при умеренной физической активности возникает одышка. При этом занимается восточными танцами, йогой, с повседневной физической активностью справляется. Данные ЭКГ: синусовая тахикардия, ЧСС – 82 в 1 минуту, горизонтальное положение электрической оси, неполная блокада правой ножки пучка Гиса.
Проведена гемостатическая терапия (этамзилат внутримышечно 500 мг в сутки) с положительным эффектом, рецидива кровохарканья не было. С целью профилактики гемоаспирационной пневмонии к лечению добавлены амоксициллин/клавуланат+метронидазол. Для проведения бронхоскопии и определения дальнейшей тактики ведения пациентка переведена в отделение торакальной хирургии, где при обследовании показаний к оперативному вмешательству выявлено не было, выписана под амбулаторное наблюдение пульмонолога.
Обсуждение
При рассмотрении данного клинического наблюдения сразу возникает вопрос относительно очередности развития патологических процессов в легких пациентки и их взаимовлиянии. Учитывая длительный анамнез инфекционных и хронических заболеваний легких, которыми пациентка страдала в детстве, включая врожденную пневмонию, вероятность первичного развития БЭБ очень высока. При первой госпитализации в возрасте 21 года в нижней доле левого легкого были выявлены бронхоэктазы. Затем последовал 15-летний период длительного диагностического поиска с тест-лечением инфильтративного туберкулеза, оперативным вмешательством по поводу развития цирротического туберкулеза, наконец повторным исследованием мокроты и операционного материала, изменением диагноза на МБЛ вследствие неэффективности проводимой химиотерапии. Таким образом, хронологически о наличии БЭБ стало известно раньше, чем о МБЛ. По данным литературы, легочные инфекции, вызванные атипичными микобактериями, наиболее часто встречаются среди лиц с иммуносупрессивными состояниями, у пациентов с заболеваниями легких, например БЭБ [3, 4, 6], что укладывается в клиническую картину заболевания нашей пациентки.
С другой стороны, клинические и рентгенологические признаки МБЛ многообразны и рентгенологическая картина МБЛ неспецифична. Как правило, она проявляется различными вариантами одно- либо двусторонней легочной диссеминации [1, 3], у мужчин чаще имитируя туберкулез, у женщин – бронхоэктазы [3, 8–10]. О сложностях дифференциальной диагностики диссеминированных изменений в легких неоднократно упоминалось в литературе [11, 12]. Клинические симптомы микобактериозов органов дыхания также не отличимы от таковых при туберкулезе и большинстве неспецифических заболеваний легких [1]. Таким образом, МБЛ у нашей пациентки мог протекать под «маской» хронического обструктивного бронхита с бронхоэктазами. Именно такая неспецифичность клинических и рентгенологических проявлений затрудняет раннюю диагностику этого инфекционного процесса. Пациентов часто ведут под другими диагнозами, и лишь неэффективность терапии побуждает к дальнейшему обследованию и поиску причин неудач в лечении, что можно проследить на примере нашей пациентки.
Кроме того, доказано, что M. avium нельзя считать обычным представителем бактериальной микрофлоры при БЭБ [13]. И если ранее считалось, что эти микроорганизмы колонизируют легкие при уже сложившихся структурных изменениях бронхиального дерева, в частности бронхоэктазах, при этом не вызывая прогрессирования процесса, то последние данные говорят о развитии инфильтративных изменений в легких и прогрессирующем ухудшении легочной функции на фоне инфицирования M. avium [13].
В нашем случае нельзя исключить, что клиническая картина хронического обструктивного бронхита, по поводу которого пациентка наблюдалась еще у детского пульмонолога, а впоследствии развитие бронхоэктазии – это и есть вариант течения микобактериоза дыхательных путей. Вопросы о хронологической последовательности развития патологий и их взаимовлиянии остаются дискутабельными. В литературе последних лет дискуссия о взаимовлиянии атипичных микобактерий и БЭБ продолжается [14].
Сложности подбора терапии в условиях данной коморбидности также неоднократно обсуждались в литературе. Известно, что M. avium характеризуется устойчивостью к большинству противотуберкулезных препаратов [13]. И даже после проведенного с положительным эффектом первоначального курса терапии возможны рецидивы инфекции [13]. Курс АБТ, по данным некоторых авторов [1, 7], должен продолжаться 10–12 месяцев после получения абациллярной мокроты. В ситуации с нашей пациенткой высокой приверженности проводимой терапии не наблюдается. Вне лечебных учреждений антибактериальные препараты она не принимает, т.к. считает их малоэффективными. Кроме этого у нее неоднократно развивались аллергические реакции на антибиотики группы макролидов, фторхинолонов, входящие в схемы лечения инфекции M. avium. По некоторым данным, частота плохой переносимости АБТ при лечении МБЛ может достигать 63% [1].
Результаты последней КТ ОГП (см. рис. 1) свидетельствуют о сохранении активного МБЛ у пациентки. В отношении БЭБ также нельзя констатировать стабилизацию течения процесса. Развившееся легочное кровотечение можно расценивать как прогрессирование заболевания и дальнейшую деструкцию бронхиального дерева. Таким образом, необходим дальнейший поиск оптимального лечения пациентки в данной клинической ситуации.
Заключение
В России нет статистических данных о распространенности МБЛ. При этом среди пациентов, обратившихся за медицинской помощью в ЦНИИТ с 2011 по 2014 г. в рамках диагностики туберкулеза, 59,6% был установлен данный диагноз [1]. С проблемой МБЛ может столкнуться терапевт или пульмонолог, при этом необходимо помнить, что пациент мог наблюдаться в прошлом с иным диагнозом, в т.ч. с туберкулезом, либо в анамнезе есть упоминание о наличии бронхоэктазов.
Подбор адекватной АБТ в представленном клиническом наблюдении будет ключевым звеном успеха в лечении пациентки. Элиминация M. avium как одного из ведущих факторов деструктивных изменений в бронхиальном дереве позволит уменьшить частоту обострений БЭБ и стабилизировать состояние пациентки, тем самым улучшить ее качество жизни. В связи с этим необходимо дальнейшее бактериологическое исследование мокроты с определением антибиотикочувствительности и подбора новых схем химиотерапии, в т.ч. с учетом переносимости.
Вклад авторов
Сергеева В.А., Панкова Т.Н., Гаврищук Т.В. – сбор информации, интерпретация данных, написание статьи. Все авторы имели неограниченный доступ к данным и участвовали в обсуждении результатов исследования, а также прочли и одобрили окончательный вариант рукописи.



